RNA干扰SALL4基因对儿童睾丸卵黄囊瘤细胞增殖和凋亡的影响
2019-12-20吕敏蔡祖仁陈肖鸣
吕敏,蔡祖仁,陈肖鸣
(温州医科大学附属第一医院 小儿外科,浙江 温州 325015)
人类婆罗双树样基因(SALL4)是spalt样(SALL)基因家族(SALL1~4)的成员之一,最初克隆是基于其DNA序列与果蝇同源基因spalt(sal)1,2,3同源,主要参与胚胎的发育[1]。SALL4是一种锌指结构蛋白转录因子,表达于细胞核内,在维持胚胎干细胞(embryonic stem cells,ESCs)的多能性和自我更新方面起着至关重要的作用[2]。出生后,SALL4的表达下调,在大多数成年组织中缺失。然而大量研究发现,SALL4在恶性肿瘤却恢复表达,SALL4的异常表达通过维持肿瘤干细胞的特性,促进肿瘤增殖、侵袭和转移[3]。自从SALL4首次作为癌基因在白血病中被发现后,SALL4的功能已经在各种类型的癌症中得到了研究[4]。目前在肺癌、乳腺癌、胃癌和结直肠癌细胞中,SALL4已经被证明可以调节细胞活力、凋亡和致瘤性[5-8]。到目前为止,SALL4在儿童睾丸卵黄囊瘤细胞中的作用鲜见报道。因此,本研究通过分析干扰SALL4的表达对儿童睾丸卵黄囊瘤细胞体外增殖、凋亡的影响,进一步明确SALL4与儿童睾丸卵黄囊瘤的关系。
1 材料和方法
1.1 材料
1.1.1 载体:成品pGPU6/GFP/Neo-SALL4 shRNA干扰载体购于上海吉玛生物公司,包含针对951干扰位点的1条特异性干扰序列(5’-GACCGUUCCAGUGU AAGAUTT-3’)和1条阴性干扰序列(5’-GTTCTCCGAACGT GTCACGT-3’)[9]。
1.1.2 细胞:利用原代组织培养技术对手术切除的1例儿童睾丸卵黄囊瘤标本进行原代培养,通过连续培养,初步建立起卵黄囊瘤细胞系,并对其生物学进行鉴定[10-11]。
1.1.3 主要试剂:RNA抽提Trizol、Opti-MEM I低血清培养基均购于美国Invitrogen公司,DMEM培养基、FBS购于美国Gibco公司,RT-PCR试剂盒购于美国Thremo公司,SYBR Green PCR Master Mix购于大连宝生物公司,SALL4一抗、辣根标记鼠二抗购于美国Abcam公司,GAPDH一抗购于美国Bioworld公司,CCK-8试剂购于日本DOJINDO公司,流式细胞术试剂盒购于美国Sigma公司,其余试剂为实验室常备。
1.2 方法
1.2.1 细胞培养:所有细胞均培养在含10%胎牛血清的DMEM培养基,CO2培养箱设定的条件为37 ℃,5% CO2。转染前1 d取对数期生长(细胞80%~90%融合)的细胞,以2×105/孔接种于无菌6孔板。实验分3 组:空白对照组、阴性对照组、SALL4干扰组。
1.2.2 实时荧光定量PCR检测:待转染48 h后,收集各组细胞,提取总RNA。严格按照说明书用反转录试剂将总RNA反转录为cDNA,并在RT-PCR仪上进行扩增,选用GAPDH作为内参。各基因引物如下:SALL4引物(正向引物5’-CCGCACTGAGATGGAAGGT-3’,反向引物5’-GCTGGGCTGCTAACAAAGG-3’,合成产物大小 143 bp);GAPDH引物(正向引物5’-TTGGCTACAGCAAC AGGGTG-3’,反向引物5’-TCTACATGGCAACTGTGAGGA G-3’,合成产物大小182 bp)。 扩增反应条件为95 ℃, 3 min;95 ℃,15 s,62 ℃,30 s,72 ℃,30 s,进行40 循环。实时荧光定量PCR以绿色荧光染料SYBR Green作为检测试剂,循环结束后,通过对溶解曲线的分析,鉴定扩增产物的特异性,用2-ΔΔCt法对数据转换后进行统计分析。
1.2.3 Western blot检测蛋白表达:取转染72 h细胞,用冰PBS冲洗3次,用RIPA裂解液在冰上裂解30 min后,12 000 r/min离心1 min,取上清液上样,BCA蛋白浓度测定试剂盒(江苏碧云天公司)测定蛋白浓度。用8% SDS-PAGE凝胶电泳分离等量的变性蛋白并转至PVDF膜上。经5%脱脂奶粉或BSA在室温下封膜1 h后,与鼠抗人SALL4一抗(1:500)结合,4 ℃孵育过夜。第2天用TBST洗膜3次后加入辣根过氧化物酶标记的山羊抗鼠二抗(1:5 000)室温孵育2 h后TBST洗膜。加入ECL发光反应液,暗室显影定影后曝光,扫描入计算机。
1.2.4 细胞增殖检测:CCK-8试剂盒检测细胞增殖能力。取转染后细胞以104/孔接种于无菌96孔板,37 ℃,5% CO2培养箱。于接种12、24、48、72 h后,分别加入含10% CCK-8试剂的完全培养基,孵育1~3 h后用酶标仪在450 nm波长下测各孔的OD值。分3个实验组,分别为空白对照组、阴性干扰组、SALL4干扰组,设置5个复孔,去掉每组5个复孔中的最大值和最小值,将各孔的OD值减去本底OD值(不含细胞的完全培养基加CCK-8试剂),统计OD值作为细胞增殖活力值。绘制细胞生长曲线。
1.2.5 细胞凋亡检测:细胞经不含EDTA的胰酶消化和离心后,加入400 μL的Binding Buffer悬浮细胞液中,用An-nexin V-FITC/PI细胞凋亡检测试剂盒染色,在BD FACS Arial II流式细胞仪进行检测。
1.3 统计学处理方法 采用SPSS20.0软件进行统计分析。计量资料以表示,组间两两比较采用方差检验。P<0.05为差异有统计学意义。
2 结果
2.1 SALL4干扰结果检测 分别在mRNA和蛋白水平验证SALL4的干扰结果。SALL4干扰组的mRNA水平(24.0%±4.0%)较阴性对照组(93.0%±43.0%)显著下降(P<0.05),SALL4干扰组的SALL4蛋白相对表达量(0.39±0.10)较阴性对照组(1.02±0.09)显著降低,差异均有统计学意义(P<0.05),见图1。
2.2 干扰SALL4对儿童睾丸卵黄囊瘤细胞增殖的影响 CCK-8实验结果表明,干扰SALL4后儿童睾丸卵黄囊瘤细胞的增殖活力显著下降,差异均有统计学意义(P<0.05),见表1。
2.3 干扰SALL4对儿童睾丸卵黄囊瘤细胞凋亡的影响 SALL4干扰组的细胞凋亡率(72.50%±1.02%)明显高于阴性对照组(66.63%±2.99%),差异有统计学意义(P<0.05);SALL4干扰组的细胞凋亡率与空白对照组(70.40%±0.75%)比差异无统计学意义(P=0.213),见图2。

图1 干扰SALL4后儿童睾丸卵黄囊瘤细胞的SALL4 mRNA和蛋白相对表达量
表1 干扰SALL4对儿童睾丸卵黄囊瘤细胞增殖的影响(OD值,每组n=3,)

表1 干扰SALL4对儿童睾丸卵黄囊瘤细胞增殖的影响(OD值,每组n=3,)
与阴性对照组比:aP <0.05
?
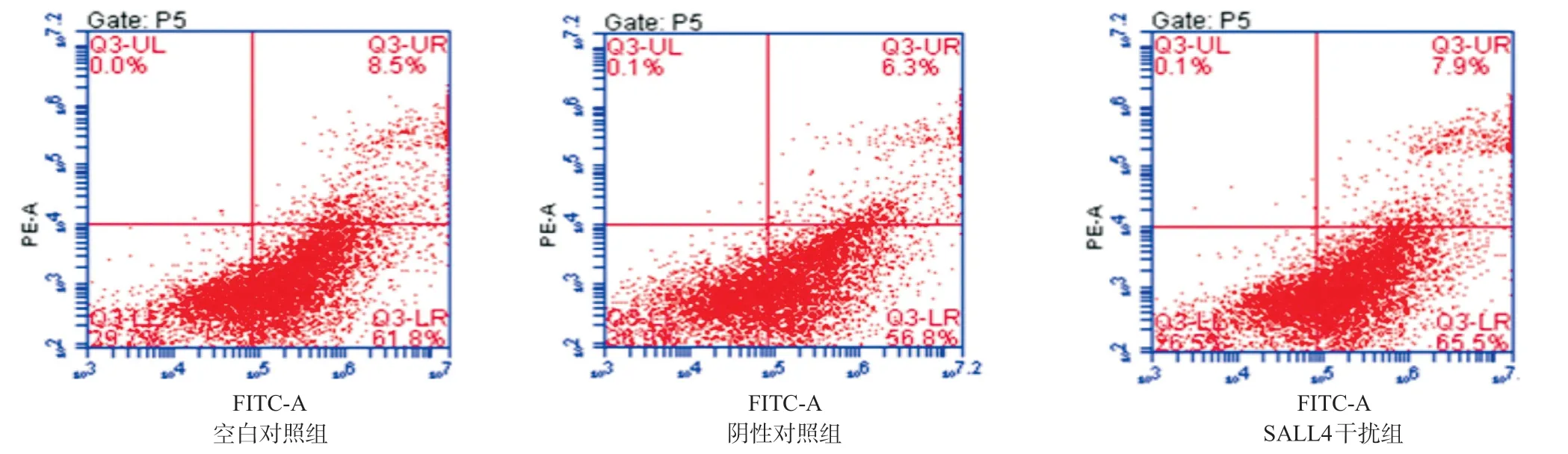
图2 干扰SALL4对儿童睾丸卵黄囊瘤细胞凋亡的影响
3 讨论
儿童原发性睾丸肿瘤很少见,占儿童实体肿瘤的1%,年发病率为0.5~2/10万男孩[12-13]。大约有75%的儿童睾丸肿瘤为恶性,其中以卵黄囊肿瘤最常见。卵黄囊瘤由胚胎外系生殖细胞异常分化而形成的,又称为内胚窦瘤,其恶性程度高,病情进展快,预后较差,如不尽早干预,常较快发生远处转移,其中多以血行转移为主[14]。目前治疗主要以早期手术完整切除肿瘤辅以化疗,但远期效果并不理想。随着目前肿瘤靶向治疗的研究日益深入,越来越多的证据证实基因干扰可作为一种潜在的方法用于肿瘤的治疗。
ESCs以其强大的多能性而闻名,能够在人体内分化为大于220种细胞类型[15-16]。SALL4是一种锌指转录因子,属于SALL基因家族,位于20号染色体上,它与果蝇spalt序列同源,是胚胎干细胞自我更新和多能性维持的关键因子。SALL4在胚胎发育过程中逐渐下降,随着组织的成熟而沉默[17]。但迄今为止,在十多种实体肿瘤如肺癌、肝癌、胃癌和子宫内膜癌和几种常见白血病中均发现了SALL4的异常高表达[5,18-20]。越来越多的证据表明,高水平的SALL4表达与恶性肿瘤的进展有关,包括促进转移、增殖,故而SALL4被认为一种新的原癌基因[21]。YANG[22]报道,下调SALL4的表达诱导细胞周期停滞在G1期,从而抑制白血病细胞的增殖。另一项研究证明,SALL4表达的上调可促进肺癌细胞的迁移、侵袭和转移[23]。PAN等[24]发现SALL4激活长链非编码RNA DANCR促进胃癌细胞增殖转移。CAO 等[25]通过对睾丸肿瘤的免疫学研究,发现其在典型精原细胞瘤、无性细胞胚胎性癌和卵黄囊瘤中均呈高表达。同时有学者针对儿童卵黄囊瘤标志物进行研究,发现相比传统的AFP标志物,SALL4是一个具有较高特异性和敏感性的肿瘤标志物[26]。尽管有报道称SALL4的异常表达会影响各种癌症的发生和预后,但是在儿童睾丸卵黄囊瘤中的作用尚不清楚。
本研究设计靶向SALL4的干扰载体并转染儿童睾丸卵黄囊瘤细胞,采用体外研究的方法观察干扰SALL4表达对儿童睾丸卵黄囊瘤细胞增殖、凋亡的影响,从而探讨SALL4在儿童睾丸卵黄囊瘤发生中的作用机制。本研究证实在儿童睾丸卵黄囊瘤细胞中干扰SALL4后,抑制了细胞中SALL4 mRNA的表达,进而抑制SALL4蛋白的表达,导致儿童睾丸卵黄囊瘤细胞增殖明显下降,细胞数量减少。同时发现SALL4表达下调后在细胞的早期凋亡水平显著升高,抑制SALL4可能会促进细胞凋亡,抑制细胞的增殖。然而,其发生机制仍不明确。细胞凋亡是一个多步骤过程,受到各种功能基因的调控。目前发现的几种经典的致瘤途径如Wnt/β-catenin、PTEN、Bmi-1等均与SALL4的表达有关[27],我们猜测SALL4通过对以上某些经典凋亡通路的调节,从而在儿童睾丸卵黄囊瘤细胞的进展和预后中起着关键的中介作用(这也将是我们下一步的研究重点),因此我们的研究表明,SALL4可作为儿童睾丸卵黄囊瘤生物治疗一个可能的潜在靶点。
