液相色谱—串联质谱法测定番茄和黄瓜中敌菌灵残留量
2019-12-19陈景春
陈景春 -
(上海必诺检测技术服务有限公司,上海 201114)
敌菌灵化工产品学名2,4-二氯-6-(邻氯代胺基)均三氮苯,由三聚氰酰氯与邻氯苯胺在脱酸剂存在下作用而得到的一种杀菌剂,外观为白色至黄色结晶,熔点159~160 ℃,能溶于链烃类和其他多数有机试剂,如甲苯、二甲苯、丙酮等(在碱性介质中30 ℃以下即可分解)[1-2]。敌菌灵具有低毒、内吸性和杀菌谱较广等特点[3],主要用于防治瓜类中常见的黑星病、炭疽病、霜霉病,水稻中的稻瘟病、胡麻叶斑病、烟草赤星病,番茄斑枯病以及各种农作物中常见的灰霉病等。
农药在农业生产过程中无可避免地被使用,对环境和生物链均有极大的破坏性,而水果、蔬菜上的农药残留问题也是由来已久的,已经对人体健康和生命安全造成了严重的威胁[4]。随着人类对农药残留问题的日益重视,日本、美国及欧盟国家都制定了相关标准,规定了在水果、蔬菜和粮食中的最大残留限量值,并对其残留量进行监测。日本农药注册保留标准规定果品(草莓除外)、蔬菜、甜菜等敌菌灵最大残留量(MRL)值为10 mg/kg、草莓为20 mg/kg,中国在GB 2763—2016《食品安全国家标准 食品中农药最大残留限量》中规定了敌菌灵在黄瓜和番茄中的最大残留量(MRL)值为10 mg/kg。
农药残留分析的样品种类繁多,化学组成复杂,要使分析仪器能检测到痕量的残留农药,需对样品进行必要的提取、浓缩和净化处理[5-6]。固相萃取是近年发展起来的一种样品预处理技术,由液固萃取和液相色谱柱技术相结合发展而来,能有效地将分析物与干扰组分分离,减少样品预处理过程,操作简单、省时、省力,现已广泛应用于农药残留的分析中[7]。目前,测定蔬菜、水果中敌菌灵农药残留量的检测文献和标准方法主要集中在高效液相色谱法[8-10]和气质联用法[11-12]等,但液相色谱及气质联用法在实际使用中,存在灵敏度较低,选择性较差、分子离子峰难以识别、不能准确区分干扰物及目标物等缺点,文献[12]使用液相色谱—质谱联用法检测敌菌灵但并未对样品进行净化及浓缩。
试验拟通过固相萃取进行净化,结合高效液相色谱—串联质谱高选择性、高灵敏性的优势,对组分复杂的样品进行实时分析,以期能够提供精准的目标物结构信息、相对分子质量等信息,为判定目标物提供依据。
1 试验部分
1.1 试验设备
电子分析天平:BP211D型,德国Sartorius公司;
高效液相色谱—质谱联用仪:Agilent 1290+6470型,美国安捷伦公司;
高速冷冻离心机:Sovall ST16R型,美国赛默飞世尔公司;
漩涡振荡器:Basic Vortex Mixer型,美国Talboys公司;
氮吹仪:DC-24型,上海安谱实验室科技股份有限公司。
1.2 材料与试剂
番茄、黄瓜:购自上海大润发超市;
乙腈、正己烷、甲醇、丙酮、甲酸:色谱纯,美国Sigma公司;
氯化钠:分析纯,国药集团化学试剂有限公司;
敌菌灵标准物质:(99.0±1.0)%,德国Dr. Ehrenstorfer公司;
弗罗里硅土(Florisil)固相萃取柱:500 mg/6 mL,美国Waters公司。
1.3 样品提取及净化
准确称取粉碎均匀的样品10 g(精确到0.01 g)于50 mL 离心管中,准确加入20 mL乙腈溶液,用高速匀浆机均质1 min,加入3~5 g氯化钠于离心管中,盖上瓶盖,于涡旋振荡器上剧烈振荡5 min。在4 ℃条件下,以8 000 r/min 离心10 min,移取乙腈层至圆底烧瓶中,残渣用20 mL乙腈反复提取1次,合并乙腈层,于40 ℃旋转蒸发至近干,加入3.0 mL正己烷振荡溶解,待净化。
依次使用3 mL正己烷—丙酮溶液(体积比85∶15)和正己烷分别预淋洗弗罗里硅土固相萃取柱,待正己烷接近流尽时,加入待净化液, 用50 mL梨形瓶接收洗脱液,用15 mL正己烷—丙酮溶液(体积比85∶15)分3次冲洗圆底烧瓶后过弗罗里硅土固相萃取柱,收集洗脱液,在40 ℃条件下旋转蒸发至近干。用1 mL甲醇溶液溶解,经0.22 μm有机相滤膜过滤,待上质谱分析。
1.4 液相及质谱分析条件
1.4.1 液相部分 色谱柱:Infinitylab Poroshell 120 EC-C18(2.7 μm,3.0 mm ×100 mm);流动相:A为甲醇,B为0.1%甲酸水溶液(流动相梯度洗脱条件具体见表1);流动相流速:0.4 mL/min;进样量:5 μL;色谱柱温:40 ℃。
1.4.2 质谱部分 离子源类型:电喷雾离子源(ESI);离子源温度:150 ℃;电喷雾电压:1.2 kV;毛细管电压:3 500 V;

表1 流动相梯度洗脱条件
扫描方式及监测方式分别为正离子扫描及多反应监测(MRM);干燥气温度:350 ℃,干燥气流量:11 L/min;去溶剂气流量:11 L/min;去溶剂气温度:350 ℃;雾化气压力:172 kPa;在正离子扫描模式下,直接进样敌菌灵标准溶液并进行母离子全扫描,确定以分子离子m/z275为母离子,然后对其进行子离子扫描,得到2个监测离子分别为153和214,并且通过调节毛细管电压,锥孔电压及碰撞能量等,优化质谱参数,并得到最终结果。具体数值见表2。

表2 敌菌灵的多反应监测质谱参数
1.5 标准贮备液及标准工作曲线绘制
准确称取敌菌灵农药标准品,用甲醇定容,得到浓度为1 mg/mL标准贮备液,并置于4 ℃冰箱保存。分别吸取适量敌菌灵农药标准贮备液,用甲醇稀释成标准工作液,在空白基质中分别添加0.1,0.5,1.0,2.0,5.0,10.0 μg的敌菌灵标准溶液,按样品同样处理后上机测定,得到敌菌灵的标准工作曲线。敌菌灵标准品图谱见图1。

图1 敌菌灵标准品图谱
1.6 样品提取溶剂的选择
根据化学性质,敌菌灵易溶于甲醇、乙腈、丙酮等多数有机试剂,在水中几乎不溶解[1-2]。试验选取了3种在农药残留检测中常用且极性各不相同的提取试剂:乙酸乙酯、丙酮和乙腈。通过在空白基质中添加敌菌灵标准品,并使用这3种试剂进行提取,测定其样品回收率。
1.7 净化固相萃取柱的选择
净化是样品前处理部分的关键环节,选取合适的固相萃取柱能够有效地去除基质中的杂质,缩短净化时间,有效富集被测物,大大提高检测的灵敏度。方法选择GCB固相萃取柱及Florisil柱进行比对,通过添加敌菌灵标准溶液,经过固相萃取柱净化后,测定其回收率,对其进行比较。
1.8 净化固相萃取柱的选择
于15 mL试管中加入适量的敌菌灵标准工作液,氮吹至近干后,加入3 mL正己烷溶解,涡旋混和均匀,通过预淋洗完的Florisil柱,分别用5,10,15,20 mL 4种不同用量的正己烷—丙酮溶液(体积比85∶15)进行洗脱,同时收集洗脱液,40 ℃条件下氮吹至近干,用1 mL甲醇溶解,经0.22 μm有机相滤膜过滤,上机分析。
1.9 基质效应的评价
吸取适量敌菌灵农药标准贮备液,分别使用甲醇及空白样品处理液进行定容,得到相同浓度的工作液后上机测定。
2 结果与讨论
2.1 样品提取溶剂的选择
提取结果显示,乙酸乙酯、丙酮和乙腈3种试剂均能有效提取敌菌灵,回收率分别为95%,92%,97%(均大于80%),能达到农药残留分析的要求[13]。其中使用乙腈提取时,在提取液加入氯化钠并振荡离心后能够与水相有效分离,而丙酮却难以与基质中的水分离,为下一步的净化工作带来困难。与此同时,乙腈相较于乙酸乙酯,在样品中提取出的色素、脂肪、蛋白等杂质少,有利于下一步的净化。综合考虑,选择乙腈作为提取试剂。
2.2 净化固相萃取柱的选择
通过试验发现,GCB柱具有优异的色素、杂质吸附性能,但对被测物有较强的吸附,且难以洗脱,造成试验整体回收率偏低,其回收率在70%左右,而相对Florisil柱的回收率达到95%。故方法选择色素吸附性能稍弱,但利于被测物洗脱,能够满足试验回收率要求的Florisil固相萃取柱作为净化用固相萃取柱。
过GCB、Florisil固相萃取柱标准品图谱见图2、3。对比图2~3可知,GCB固相萃取柱和Florisil固相萃取柱都能基本去除基质中的干扰杂质,但使用GCB柱净化相对回收率较低,综合被测物回收率及净化效果,最终选择Florisil固相萃取柱为净化用固相萃取柱。

图2 过GCB固相萃取柱标准品图谱
Figure 2 MRM chromatogram of anilazine through GCB solid phase extraction column

图3 过Florisil固相萃取柱标准品图谱
Figure 3 MRM chromatogram of anilazine through florisil solid phase extraction column
2.3 固相萃取柱洗脱液的选择
淋洗液与回收率图谱见图4。由图4可知,洗脱液使用量为5 mL时,敌菌灵的回收率仅达到25%左右,并不能满足农残分析要求;当洗脱液用量提高到15 mL时,几乎能完全将敌菌灵洗脱,回收率达到95%;增加使用量至20 mL时,未能显著提高回收利率,故在综合成本及效率因素考虑后,方法选择使用15 mL正己烷—丙酮溶液(体积比85∶15)进行洗脱。
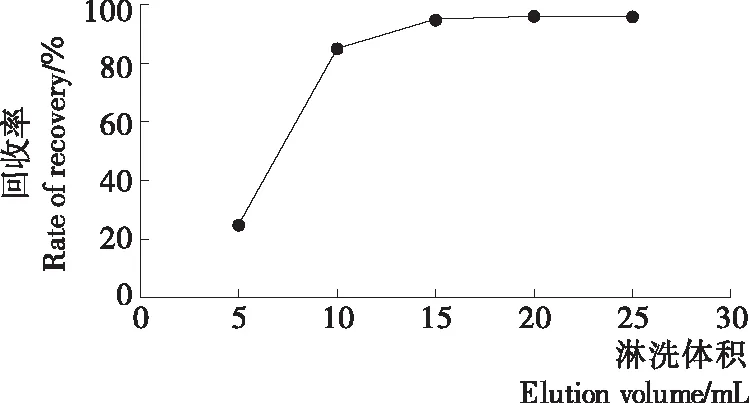
图4 淋洗液与回收率图谱
2.4 基质效应的评价
经过上机测定后发现,在番茄及黄瓜基质中敌菌灵的离子化效率较甲醇溶液中低,基质效应在80%左右,结果见表3。故在样品分析时采用相同基质内添加标准物质进行标准曲线校正以消除基质效应的影响。
2.5 线性关系与检出限
以浓度为横坐标,峰面积为纵坐标绘制敌菌灵标准工作曲线如图3所示,在0.1~10.0 μg/mL的浓度范围内呈线性关系,线性方程为Y=172.63X-335.62 (R2=0.999 8)。
同时以3倍信噪比,测得敌菌灵方法检出限为0.01 mg/kg;以10倍信噪比,测得敌菌灵方法定量限为0.03 mg/kg。
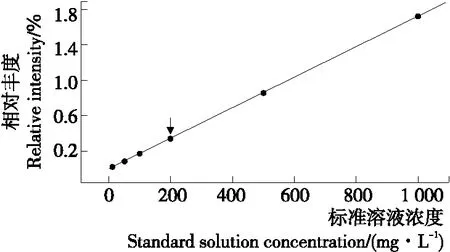
图5 敌菌灵的标准工作曲线
2.6 准确度及精密度试验
采用标准物质添加法,选取番茄及黄瓜阴性样品,分别添加0.03,0.10,0.50 mg/kg进行回收率试验,每个添加水平重复测定6次,测定后得到敌菌灵在番茄及黄瓜基质中的回收率及相对标准偏差(RSD)见表4。
3 结论
试验采用固相萃取前处理,建立了高效液相色谱—串联质谱法测定番茄和黄瓜中敌菌灵残留量的方法,并优化了试验条件,在保证分离度的前提下,采用固相萃取小柱净化,以C18色谱柱为分离柱,以甲酸水—乙腈为流动相进行梯度洗脱,经LC-MS/MS检测,以多反应监测模式监测目标化合物的特征离子进行定性定量分析。该方法添加回收率在88.3%~95.2%,变异系数在4.5%~8.8%。试验证明高效液相色谱—串联质谱法前处理方法简单、分离被测物能力强,能准确定量、定性;能够节省分析时间,提高检测效率。使用试验方法完全可以满足番茄和黄瓜中敌菌灵残留量的日常检测需求。但由于研究过程中,采用基质种类与数量有限,在叶菜类等类似基质样品中的利用有待进一步的探索和研究。

表4 敌菌灵回收率及相对标准偏差测定结果
