流式细胞外周血刺激法检测Th1/Th2在复发性流产中变化探讨
2019-12-19苗竹林钟兴明黄密琼钟文瑶王永霞赵文忠张碧云
苗竹林 钟兴明 崔 蓉 黄密琼 钟文瑶 王永霞 赵文忠 张碧云
广东省计划生育专科医院,广东省计划生育科学技术研究所(广州,510600)
复发性流产(RSA)病因复杂,有研究表明,妊娠期免疫细胞及免疫因子在母体全身及子宫局部-胎盘-胎儿之间发生了很大的变化,免疫因素在生理与病理妊娠中起重要作用[1]。目前,针对妊娠后免疫及免疫效应细胞已进行了大量基础研究[2],一些学者将T辅助细胞及其产生的细胞因子在疾病中的变化描述为:正常妊娠状态下为Th2优势状态[3],一些病理妊娠如复发性流产等是Th1/Th2失衡,或者向Th1偏移的状态[4]。尽管文献报道Th1、Th2偏移是判断妊娠结局的可靠指标,但在临床一直未得到有效利用,尤其在复发性流产方面缺乏可靠的临床资料。本研究采用流式细胞检测技术检测血清中Th1、Th2,为临床应用提供依据。
1 资料与方法
1.1 一般资料
2012年1月—2018年5月本院就诊患者。非妊娠期复发性流产患者310例为RSA组,同期无复发性流产病史的健康妇女220例为对照组;早孕期,有复发性流产史140例为早孕RSA组,无自然流产史102例为早孕对照组;稽留流产患者19例。
1.2 流式细胞检测
取外周血进行检测。FACS Calibur流式细胞仪(美国Becton Dickinson公司),鼠抗人荧光单克隆抗体(美国BD公司),佛波酯 (PMA)、离子霉素(Ion)、蛋白转运阻滞剂(BFA)、裂解液及破膜剂(Beyotime公司),4℃避光保存。FCM检测胞内细胞因子实验:取150μl全血标本于流式管中,加入150μl RPMI1640(不含小牛血清-FBS),10μl 1μg/ml PMA,10μl 50μg/ml Ionomycin以及10μl 0.5mg/ml BFA工作液,混匀;37℃,5%CO2培养3~6h。加入10μl CD3PerCP和2μl CD8APC,室温避光孵育15min;裂解,破膜后加入IFN-γ/IL-4抗体室温避光孵育20min,离心后弃除上清,上机检测。
1.3 统计学分析
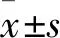
2 结果
2.1 一般情况
RSA和对照组年龄(19~43)岁,早孕RSA组与早孕对照组年龄(20~43)岁及孕(6~12)周。
2.2 Th1与Th2细胞检测
细胞经过刺激之后,流式细胞术检测中在前散射(FSC)和侧散射(SSC)的二维Dot-plot图中区分淋巴细胞群,对CD3+细胞设门,获得CD3+CD8+和CD3+CD8-两群细胞,以CD3和CD8阴性细胞反向设门来代替CD4细胞,Th1(CD4+/IFN-γ+)和Th2细胞(CD4+/IL-4+)稳定表达,见图1。
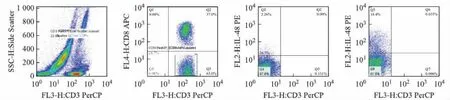
图1 Th1(CD4+/IFN-γ+)和Th2细胞(CD4+/IL-4+)流式细胞图
2.3 RSA组与对照组Th1、Th2值比较
两组比较无差异(P>0.05),均为Th1优势状态,见表1。
2.4 早孕RSA组与早孕对照组Th1、Th2值比较
早孕RSA组与早孕对照组比较无差异(P>0.05),均为Th1优势状态,见表2。
2.5 稽留流产患者Th1、Th2值变化
19例稽留流产患者 Th1为26.66±18.65,Th2为4.21±2.27,处于Th1优势状态,Th1/Th2>1,未见向Th2优势状态偏移,与对照组比较无差异(P>0.05)。
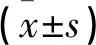
表1 两组Th1、Th2值比较
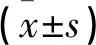
表2 两组Th1、Th2值比较
3 讨论
3.1 T淋巴细胞亚群及其细胞因子临床作用
复发性流产病因复杂,近年来有研究表明免疫因素在妊娠中起重要作用。淋巴细胞作为主要的免疫细胞, T淋巴细胞通过分泌细胞因子调节多种细胞的生长、分化和功能,调节正常与病理状态下的免疫应答,因此,细胞因子的变化是判断疾病病因与免疫状态的重要依据[5]。T辅助细胞根据自身分泌的细胞因子分成Th1、Th2两个亚群,Th1细胞主要分泌IL-2、IFN-γ和TNF-β等细胞因子,其作用主要是介导细胞免疫反应,在诱发器官特异性自身免疫病、器官移植排斥反应和抗感染免疫中起重要免疫调节作用。Th2细胞主要分泌IL-4、IL-5、IL-6、IL-10和IL-13等细胞因子,主要是调节体液免疫反应,在诱发过敏等反应中起着决定性的作用[6]。
3.2 Th1、Th2、Th1/Th2平衡与复发性流产
20世纪90年代,Wegmann[7]等首次通过动物实验研究报道,哺乳类的正常妊娠是一种Th2优势现象,蜕膜表达以IL-4为主的Th2型细胞因子,母体处于免疫耐受状态;但如果表达以IFN-γ、TNF-α为主的Th1型细胞因子,就会被母体免疫系统所排斥导致流产[8]。也有研究对RSA患者和正常妊娠妇女体内T淋巴细胞及其亚群的生物学特点进行比较分析,发现随着妊娠进展,胎盘产生细胞因子和激素通过影响Th1/Th2的平衡参与调节母体的免疫反应来维持正常妊娠[9]。目前普遍认为正常妊娠中T辅助细胞向Th2偏移是一种特殊的Th2优势现象,Th1细胞因子过度表达可导致妊娠丢失,Th1/Th2平衡偏移与RSA密切相关。目前免疫对妊娠影响的基础研究已经由Th1/Th2模式逐渐发展为Th1/Th2/Th17/Treg模式,但对临床的指导价值仍有限[10]。针对Th1、Th2、Th1/Th2平衡的研究多集中于动物实验或子宫局部[11],而女性外周血Th1、Th2变化及其意义尚不明确,缺乏临床大样本的研究资料。本研究结果,妊娠前后生理与病理妊娠状态两组女性均处于Th1优势状态,未发现Th1/Th2偏移现象,稽留流产患者同样未见Th1/Th2失衡。
3.3 流式细胞检测Th1/Th2影响因素分析
流式细胞检测主要用于检测T淋巴细胞、B淋巴细胞和NK细胞及其亚群[12],而在检测Th1、Th2等细胞变化时一般通过检测其产生的特异性细胞因子的分泌来间接判断细胞亚群的变化[13]。本实验同时标记细胞内细胞因子IFN-γ和IL-4来检测Th1细胞(CD4+/IFN-γ+)和Th2细胞(CD4+/IL-4+)。但是,静止的淋巴细胞进行特异性免疫应答时分泌的细胞因子很少,难以准确检测到。为了评估其功能,需要通过T细胞活化刺激剂诱导细胞活化使其分泌大量细胞因子,提高流式细胞术检测的敏感度和效率[14]。本研究中,PMA+Ion刺激后CD8阴性细胞反向设门可以获得稳定的细胞因子,实验方法及结果稳定可靠。复发性流产患者妊娠前Th1、Th2、Th1/Th2值与对照组比较、妊娠期有复发性流产史者与对照组比较均未见差异,未发现有Th2优势状态。
由于本研究检测Th1、Th2时操作程序复杂,时间长,使用抗体及试剂种类多,影响因素多,任何一个环节出现问题都会影响检测结果。因此,在评估复发性流产的免疫因素时,研究人员需做好实验操作质量控制。本研究结果是否与刺激剂选择有关还需进一步研究。而检测Th1、Th2细胞亚群时,只有在检测方法学上保持一致才能判断其临床应用价值。流式微球阵列术对不同荧光强度的捕获微球表面分别包被IL-2、IL-4、IL-6、IL-10和肿瘤坏死因子α(TNF-α)特异性抗体,可定量样本中IL2、IL4、IL6、IL10、和TNF-α的含量,并同时检测几种细胞因子,该方法是否可替代刺激法检测Th1、Th2、Th1/Th2值得研究。
