孕期血清脂溶性维生素及血脂水平与妊娠期高血压疾病关系
2019-12-19彭菊生
郑 君 彭菊生 饶 敏
湖北省咸宁市第一人民医院(437000)
妊娠期高血压疾病(HDP)基本病理生理变化是全身小血管痉挛,内皮损伤及局部缺血,造成多个靶器官损伤[1-2]。相关研究发现子痫前期患者外周血中有158个维生素D(VitD)相关基因表达上调,维生素D的低水平状态是子痫前期发病的一个危险因素[3]。早期妊娠血脂代谢异常,尤其是甘油三酯血症和胆固醇血症,可预测子痫前期发生,并可能有助于预测其严重程度[4]。本研究分析不同妊娠阶段血清脂溶性维生素及血脂水平变化,探讨其与HDP发生关系,为临床预防及早期治疗提供参考。
1 资料与方法
1.1 一般资料
收集2016年5月—2017年5月本院围产保健并确诊为HDP的患者为观察组,同期建档健康孕妇为对照租。入组标准:①符合《妊娠期高血压疾病诊治指南(2015)》的诊断标准[5];②年龄22~35岁;③首次围产保健在孕8~13+6周;④入选前两个月内未使用过钙剂及VitD。排除标准:①慢性高血压疾病;②合并免疫系统疾病、内分泌疾病者;③严重的肝肾功能异常等疾病;④多胎妊娠者;⑤合并营养不良或肥胖者;⑥近期服用过影响血脂代谢的药物者。本研究经本院伦理委员会审核批准,孕妇及家属知情同意并签字。
1.2 方法
留取孕妇孕早期(8~13+6周)、孕晚期(32~36周)空腹血清,检测脂溶性维生素及血脂水平。同时完成妊娠期间体质指数(BMI)、血压等常规检查。孕晚期入院待产后,观察组孕妇根据病情状况给予硝苯地平、硫酸镁等药物控制血压,分娩后记录孕龄、胎盘重量、新生儿体重。
1.3 检测方法
采用液相色谱串联质谱法进行血清脂溶性维生素A(VA)、维生素E(VE)、血清25-羟基维生素D(VD2、VD3)含量测定。酶比色法检测血清甘油三酯(TG)和总胆固醇(TC),变构酶法检测高密度脂蛋白胆固醇(HDL-C)、选择性抑制法测定低密度脂蛋白胆固醇(LDL-C)。
1.4 统计学方法
采用SPSS 23.0数据分析,计数资料以例数(%)表示,组间比较采用χ2检验或Fishers精确概率法。计量资料以均数±标准差表示,组间比较采用独立样本t检验,多组组间比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 两组对象临床资料比较
观察组102例,其中妊娠期高血压43例,轻度子痫前期37例,重度子痫前期22例。对照组75例。两组基本临床资料比较均无差异(P>0.05),见表1。
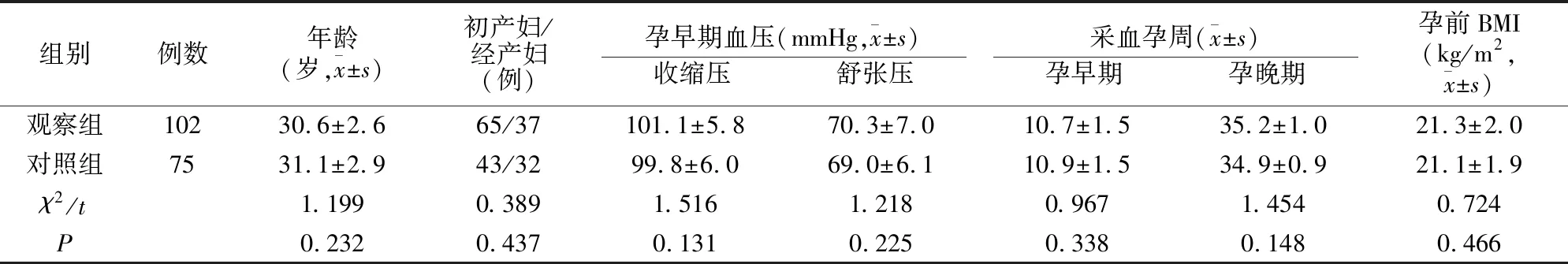
表1 两组临床资料对比
2.2 不同孕期血清脂溶性维生素水平变化
孕早期血清VA水平观察组高于对照组(P<0.05),VE、VD3、VD2水平两组无差异(P>0.05)。孕晚期血清VA水平两组均低于孕早期, VE、VD3、VD2水平均高于孕早期,且观察组血清VA水平高于对照组, VD3水平低于对照组(均P<0.05),VE、VD2水平两组无差异(P>0.05)。见表2。
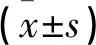
表2 两组不同孕期血清脂溶性维生素水平比较
*与孕早期比较P<0.05
2.3 不同孕期血脂水平变化
孕早期血清TG、TC水平观察组高于对照组(P<0.05),而血清HDL-C、LDL-C两组比较无差异(均P>0.05);孕晚期血清TG、TC、HDL-C、LDL-C水平两组均高于孕早期,观察组TG、TC、LDL-C水平高于对照组,HDL-C水平低于对照组(均P<0.05),见表3。孕晚期时,妊娠期高血压组、轻度子痫前期组、重度子痫前期组、对照组间TG、TC、LDL-C、HDL-C水平存在差异(P<0.05),见表4。
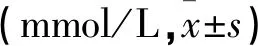
表3 两组不同孕期血脂水平比较
*与早孕期比较P<0.05
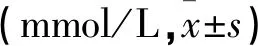
表4 孕晚期HDP不同严重程度孕妇组血脂水平比较
*与对照组相比#与妊娠期高血压组相比△与轻度子痫前期组相比P<0.05
2.4 两组分娩及新生儿情况
观察组分娩孕龄、新生儿出生体重、胎盘重量均低于对照组(P<0.05),见表5。
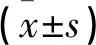
表5 两组分娩及新生儿情况比较
*与对照组相比P<0.05
3 讨论
HDP是妊娠期特发性高血压疾病,发病机制不明,主要与子宫螺旋动脉重铸不足,炎症免疫过度激活,血管内皮细胞受损、氧化应激等因素有关[6]。VA具有促进生长发育,稳定炎症因子,抑制自身免疫反应作用,可通过影响胎盘血管螺旋化、影响血管舒张功能或加剧高氧自由基损害等,在HDP中发挥作用[7]。国外学者研究发现血清VA水平在孕晚期可平均下降25%~65%,且随着HDP病情加重而下降[8]。本研究中两组孕妇晚孕期血清VA水平降低,且观察组高于对照组。VA的运载蛋白为视黄醇结合蛋白,其水平的升高与子痫前期和早产的高风险有关[9]。多项研究表明,孕期VA干预能够改善新生儿临床结局[10-11]。VE是体内抗氧化系统的一部分,能够直接清除O2-[12]。本研究中两组孕晚期VE水平均高于孕早期,但两组无明显差异,VE与HDP发生发展的关系仍需探讨。VD主要调节体内钙磷代谢水平。Baca[13]等研究表明VD缺乏可增加子痫前期的发病风险;一项系统性研究表明VD缺乏与子痫前期风险增加存在正相关[14]。本研究孕晚期观察组VD3水平低于对照组,推测孕期VD水平不足时可出现血管内皮功能障碍,导致血管顺应性降低,促使血压上升。孕期补充VD能够增加母体及脐血25-羟维生素D浓度,降低小胎龄儿分娩风险[15]。
妊娠期孕妇肠道对脂肪的吸收能力增加,血脂水平随着孕龄的增加而升高,是母体满足胎儿生长发育、维持妊娠等需求的生理适应性变化。尤其在妊娠晚期,高血脂状态利于母儿脂肪储备,为妊娠晚期、分娩期、产褥期提供能量[16]。本研究中,两组孕妇孕晚期血脂水平均升高,观察组TG、TC、LDL-C水平高于对照组,且随着疾病严重程度的加重逐渐升高,而血管保护性因子血清HDL-C水平低于对照组。HDP主要病理基础是内皮系统的结构损伤和功能障碍,高血脂状态能够增加炎症因子的表达,加重炎症反应,进一步加重内皮细胞的损伤,血脂代谢异常使脂质沉积于血管壁,引起管腔狭窄而血压升高,从而参与子痫前期疾病的发生及发展[17-18]。母体血压升高导致子宫胎盘血流灌注不足,胎盘功能下降,胎儿生长受限,本研究中观察组分娩孕龄、新生儿出生体重、胎盘重量均低于对照组,可见HDP在一定程度上影响了胎儿的生长发育。
综上所述,脂溶性维生素及血脂水平在妊娠期存在波动,血清血脂水平随孕期进展逐渐升高,VD3、HDL-C的相对不足及高血脂状态参与了HDP的发病。孕期密切监测血脂水平可预测疾病的发展,对早期干预及改善预后具有一定意义。
