富含半胱氨酸分泌蛋白-1基因免疫避孕疫苗对小鼠生育抑制
2019-12-19黄孔云
于 彬 王 梅 孙 艳 黄孔云
1.山东省枣庄市妇幼保健院(277102);2.山东省安丘市妇幼保健院;3.山东中医药大学第二附属医院
避孕疫苗由于具有专属特异性好、效果持久、作用可逆等特点, 在避孕药具中具有广阔的发展前景[1]。DNA 疫苗即基因疫苗,是指将编码某种蛋白质抗原的重组真核表达载体直接注射到动物体内,使外源基因在体内表达,产生抗原激活机体的免疫系统,从而诱导特异性的体液免疫和细胞免疫应答,因其具有成本低廉、制备简单、使用安全、免疫效果好等优点已成为疫苗研究领域中一个重要的战略方向[2]。在哺乳动物中,富含半胱氨酸分泌蛋白-1(Crisp-1)分布于附睾头部上皮细胞,是一种雄激素依赖型糖蛋白[3],在进化上高度保守,参与哺乳动物精子获能、精卵结合和融合过程,在生育抑制研究领域中是一种潜在靶点。本研究用制备的Crisp-1DNA疫苗免疫雌性和雄性BALB/c小鼠, 探讨Crisp-1DNA疫苗免疫避孕抗原有效性。
1 材料与方法
1.1 实验动物
本实验在山东大学齐鲁医院完成。选取6~8周龄SPF级BALB/c小鼠40只,雌雄各半,适应性喂养1周,室温22~24℃,湿度50%~65%,自由摄食及饮水,昼夜交替12h。随机将雌性小鼠分为观察A组和对照A组,雄性小鼠分为观察B组和对照B组,每组各10只。同时选取40只小鼠行避孕效果试验。
1.2 实验方法
1.2.1制备疫苗特异性酶切Crisp-1 TA克隆及真核表达载体pcDNA3.1, 并用T4 DNA连接酶连接上述2个酶切回收产物, 构建真核表达载体pcDNA3.1-Crisp-1, 进而转化DH5a感受态细胞。接种从菌落中挑取的 PCR 阳性重组克隆,用重组质粒转染COS-7细胞。
1.2.2免疫腹腔注射戊巴比妥钠, 待实验小鼠翻身反应消失后, 暴露股四头肌, 先注射高渗蔗糖溶液, 一定时间后在相同部位注射DNA疫苗,于每只动物两侧肢体轮流注射, 初次免疫后分别隔周进行两次加强免疫, 每次接种相同DNA疫苗量。实验组给予pcDNA3.1-Crisp-1DNA疫苗免疫, 对照组给予pcDNA3.1空载体免疫。分别于每次免疫前一天及末次免疫后3周取血眼内呲静脉, 室温静置2 h后, 3000r/min离心 20 min, 取上清-70℃贮存备用。
1.2.3血清Crisp-1检测酶联免疫吸附法(Invitrogen公司生产试剂盒)测定Crisp-1抗体水平: 将重组蛋白作为抗原包被于96孔酶标反应板中, 37℃ 孵育 1 h后 4℃过夜。每次免疫前和末次免疫后3周的血清1∶ 100稀释后作为一抗,设置阴性对照。HRP 标记的羊抗小鼠 IgG 作为二抗。加入底物 A、B 液[四甲基联苯胺(TMB)-过氧化氢溶液]显色,终止液终止反应。用酶标仪在450 nm波长下测OD值,计算样品浓度。
1.2.4免疫避孕试验末次免疫后2周, 将各组小鼠分别与正常异性小鼠合笼。将次日晨见有阴道栓的雌鼠单独喂养, 随后观察各组小鼠的妊娠率和每窝产仔数。
1.2.5组织学观察4组小鼠分别取双侧卵巢组织或睾丸附睾组织,石蜡切片,HE染色观察卵巢组织学变化。
1.3 统计学处理
2 结果
2.1 各组血清Crisp-1水平比较
血清Crisp-1抗体OD值观察A组(0.673±0.102)和观察B组(0.680±0.101)高于对照A组(0.132±0.067)和对照B组(0.128±0.061)(F=43.382,P=0.000)。
2.2 各组小鼠妊娠率比较
小鼠妊娠率观察A组(3/10,3例)和观察B组(2/10,2例)低于对照A组(9/10,9例)和对照B组(10/10,10例)(F=21.181,P=0.000)。
2.3 各组小鼠每窝产仔数比较
每窝产仔数观察A组(5.6±0.3只)和观察B组(5.5±0.9只)低于对照A组(10.1±0.5只)和对照B组(10.0±0.6只)(F=74.033,P=0.000)。
2.4 组织学观察
观察A组和对照组A组小鼠卵巢组织结构正常,无萎缩,无炎性细胞浸润,卵泡形态正常;观察B组和对照组B组小鼠睾丸、附睾基底膜完整,曲细精管直径正常,睾丸内有丰富的精子和各级精细胞,附睾有大量成熟精子。见图1。
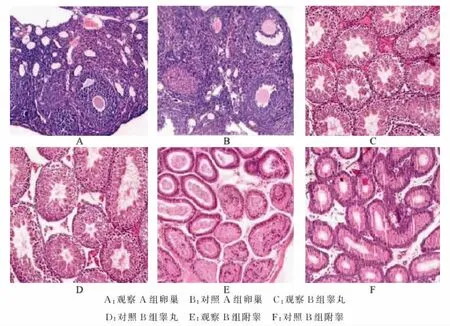
A:观察A组卵巢 B:对照A组卵巢 C:观察B组睾丸D:对照B组睾丸 E:观察B组附睾 F:对照B组附睾图1 各组小鼠性器官组织HE染色 (200×)
3 讨论
虽然医药学领域发展为全球育龄男女提供了多种避孕方法,但临床使用受限[4]。目前研制中有很多种避孕疫苗,国内外已发展的避孕疫苗有抗卵泡生成素疫苗、抗黄体生成激素疫苗、抗促性腺素释放激素疫苗、抗精抗原、抗卵抗原以及抗人绒毛膜促性腺激素避孕疫苗[5]。抗卵泡生成素疫苗和抗黄体生成激素疫苗因其副作用大在临床使用并不广泛[6]。抗黄体生成激素疫苗的制作过程简便、容易生产,但对人体的影响比较广泛故评价不高[7]。抗促性腺素释放激素疫苗虽作用显著,但作用器官较多,不良反应较严重,是否有毒副作用以及作用机制尚未阐明,故有很大争议[8]。在哺乳动物中Crisp-1的发现推动了男性免疫避孕药的发展。
目前研究发现CRISP-1在哺乳动物体内参与精子成熟、获能、精卵结合与融合等:①CRISP-1 最初结合于精子的顶体区, 伴随顶体反应之后迁移到与卵子融合的精子头部赤道板部位[9]; ②卵细胞表面可能存在Crisp-1的受体,Crisp-1的多克隆抗体可通过与卵子表面的互补位点相互作用,抑制精子与去透明带的卵细胞融合[10]; ③附睾蛋白Crisp-1在蛋白水平上特异性表达并在功能上物种之间具有同源性,推断Crisp-1为一个较好的避孕疫苗靶蛋白, 尤其是Crisp-1基因在附睾上的特异性表达[11];④CRISP-1可抑制大鼠精子获能过程中的蛋白酪氨酸磷酸化和孕酮诱导的精子顶体反应[12];⑤DNA疫苗在机体表达相应的抗原蛋白,刺激机体产生免疫应答反应,成本低廉且使用方便, 比传统的减毒疫苗和基因工程疫苗更具有优势和应用前景[13]。
本研究用以真核表达质粒为载体构建Crisp-1 并应用PCR技术克隆出鼠Crisp-1 cDNA疫苗免疫小鼠,结果显示其血清Crisp-1抗体值明显提高。说明Crisp-1 cDNA疫苗可抑制妊娠,降低生育率。雌鼠卵巢组织结构均正常、无萎缩;雄鼠睾丸、附睾基底膜和曲细精管直径均完整和正常,睾丸内有丰富的精子和各级精细胞,附睾有大量成熟精子。与对照小鼠未见明显差异,说明Crisp-1 cDNA疫苗不影响小鼠卵巢和睾丸的正常生理功能和组织结构,安全有效。实验鼠妊娠率及每窝产仔量均降低,说明该DNA疫苗具有抗生育潜能, 但避孕效果并不理想, 其原因可能是由于载体带负电荷, 难以通过双磷脂细胞膜, 在体内易被酶降解清除[14-15]。因此,要成功开发基因免疫避孕疫苗, 还需选择更合适的给药载体,提高DNA疫苗在体内主动免疫避孕效果。
总之, DNA 疫苗pcDNA3.1-Crisp-1可以诱导雌、雄性BALB/c 小鼠产生特异性抗mCrisp-1 抗体,在一定程度上抑制了小鼠的生育能力,是研究基因免疫避孕疫苗的理想靶点,值得深入研究。
