西江肉桂挥发油提取工艺优化及抗氧化研究
2019-12-19马延红李赛男刘文华
马延红,李赛男,刘文华
(肇庆学院 生命科学学院,广东 肇庆 526061)
肉桂为樟科植物肉桂(CinnamomuncassiaPresl)的干燥树皮,是《中国药典》收载的一味传统中药,也常作为调味品和香料使用[1]。肉桂气香浓烈,味甜、辣,具有补火助阳、散寒止痛、温通经脉的功效[2]。肉桂通常生长于热带、亚热带地区,中国作为世界桂皮的四大产区之一,产量占世界肉桂总产量的80%以上[3],在世界桂皮进出口贸易中占据重要地位[4]。中国的肉桂主要分布于广东、广西地区,此地出产的桂皮质优味浓,挥发油含量高,被称为“西江肉桂”。与同类桂皮相比,西江肉桂无论是挥发油含量还是挥发油形状和香气,均具有极大优势[5]。挥发油是肉桂的主要有效成分,也是发挥生理活性的重要物质基础。肉桂油中含有多种小分子醛类、酚类、烯类、醇类等化合物,具有浓烈的香味,并可随水蒸气挥发出来。桂皮醛和苯乙醛为肉桂油的主要成分,其中桂皮醛含量高达80%以上[6,7],且肉桂醛是桂皮发挥调味作用和药用价值的重要有效成分[8]。
水蒸气蒸馏法具有操作简便、成本低、无溶剂残留等优点,是目前提取肉桂油最普遍的方法[9]。水蒸气蒸馏法的提取效率受到物料粉碎粒度、料液比、浸泡时间、提取时间等多种因素影响。因此,本试验以桂皮为原料,采用水蒸气蒸馏法研究不同提取条件对肉桂油提取率的影响,确定最佳提取工艺,为肉桂油的产业化生产提供一定的参考。同时,利用体外抗氧化试验测定肉桂精油的总还原能力、羟自由基清除率和DPPH清除率,评定其体外抗氧化能力。广东肇庆作为中国肉桂的主要产区之一,种植面积基本保持在100万亩以上,产量占全国总产量的1/3[10]。提高肉桂油的加工效率和产量,探讨其深层次研究价值,对于肉桂的合理开发利用具有重要意义。
1 试验仪器
BSA124S-CW分析天平 赛多利斯科学仪器有限公司;Q-800D高速万能粉碎机 上海冰都电器有限公司;UV-6300紫外分光光度计 上海美谱达仪器有限公司;DK-98-II电炉 天津泰斯特仪器有限公司。
肉桂:产自广东肇庆,购于广州市清平药材市场;抗坏血酸标准品:购于广东光华科技股份有限公司;DPPH:购于上海源叶生物科技有限公司;无水乙醇、无水硫酸钠、三氯乙酸、铁氰化钾、三氯化铁、水杨酸:均购于广州化学试剂厂。
2 试验方法
2.1 肉桂油的提取
将桂皮适当干燥,粉碎、过筛后置于5 L的蒸馏烧瓶中,加入浸提剂,用水蒸气蒸馏法(依据试验设计选择不同的粉碎粒度、料液比、浸泡时间和蒸馏时间)提取肉桂油。经水油分离、无水硫酸钠除水后,密封保存于4 ℃冰箱中,备用。
2.2 单因素试验
选取不同的料液比、粉碎粒度、浸泡时间和蒸馏时间等因素进行单因素试验。
料液比的确定:准确称取25 g肉桂粉末,过20目筛,分别加入200,250,300,350 mL蒸馏水作提取溶剂,固定粉碎粒度为20目,浸泡时间为0 h,蒸馏时间为3 h,在以上条件下提取肉桂挥发油。
粉碎粒度的确定:准确称取25 g肉桂粉末,分别过20,50,60,100目筛,加入300 mL蒸馏水作提取溶剂,固定料液比为1∶12,浸泡时间为0 h,蒸馏时间为3 h,在以上条件下提取肉桂挥发油。
浸泡时间的确定:准确称取25 g肉桂粉末,过20目筛,加入300 mL蒸馏水作提取溶剂,分别浸泡0,1,2,3 h后提取,固定料液比为1∶12,粉碎粒度为20目,蒸馏时间为3 h,在以上条件下提取肉桂挥发油。
蒸馏时间的确定:准确称取25 g肉桂粉末,过20目筛,加入300 mL蒸馏水作提取溶剂,固定料液比为1∶12,粉碎粒度为20目,浸泡时间为0 h,分别蒸馏3,4,5,6 h,在以上条件下提取肉桂挥发油。
2.3 正交试验
利用正交试验设计优化肉桂挥发油的提取工艺,在以上4个单因素试验中,选择溶剂料液比、物料粉碎粒度、浸泡时间和蒸馏时间进行四因素三水平正交试验。
2.4 抗氧化活性的测定
2.4.1 DPPH法
量取不同量的挥发油于50 mL的容量瓶中,用95%乙醇将样品配制成 0.4, 0.8, 2.0, 4.0, 8.0 mg/mL不同浓度的样品溶液,将1 mL上述药液加入2 mL浓度为0.5 mmol/L的DPPH 溶液,室温遮光放置30 min,反应完全后,于517 nm波长处测其吸光度,每个试样做3个平行样,取平均值。用相对应浓度的抗坏血酸作为阳性对照组,并以抗坏血酸浓度和自由基清除率做标准曲线。样品结果以每克样品中所含抗坏血酸当量来表示[11]。
DPPH清除率=[(A0-A1)/A0]×100%。
式中:A0为未加药时DPPH溶液的吸光度;A1为抗坏血酸溶液或样品溶液添加DPPH溶液的吸光度。
2.4.2 总还原能力的测定
采用铁氰化钾还原法[12]。取0.4,0.8,2.0,4.0,8.0 mg/mL不同浓度的肉桂挥发油溶液各1 mL加入试管中,依次加入2.5 mL的 PBS溶液和2.5 mL 1%的K3Fe(CN)6,混匀,于50 ℃恒温水浴20 min,加入10% 三氯乙酸溶液2.5 mL,用转速为3000 r/min的离心机离心10 min,取上清液2.5 mL,再加入2.5 mL蒸馏水和0.5 mL 0.1%的FeCl3溶液,混匀,室温放置10 min后,于700 nm波长下测其吸光度,每个试样做3个平行样,取平均值。以与药液同样浓度的抗坏血酸作为阳性对照。
2.4.3 羟自由基清除率[13]
取5支10 mL试管,分别加入0.4,0.8,2.0,4.0,8.0 mg/mL不同浓度的肉桂挥发油溶液,再依次向各试管中加入2 mL 6 mmol/L的FeSO4溶液、2 mL 6 mmol/L的H2O2溶液,摇匀后,室温静置10 min。再向各试管中加入2 mL 6 mmol/L的水杨酸-乙醇溶液,摇匀,置于50 ℃恒温水浴30 min,于510 nm波长下测定其吸光度,每个样品测3个平行样,取平均值。以与药液同样浓度的抗坏血酸作为阳性对照,并以抗坏血酸浓度和自由基清除率做标准曲线。样品结果以每克样品中所含抗坏血酸当量来表示。
羟自由基清除率=[1-(A1-A2)/A0]×100%。
式中:A0为95%乙醇溶液的吸光度;A1为抗坏血酸溶液或样品溶液的吸光度;A2为用95%乙醇代替水杨酸时样品溶液的吸光度。
3 结果与分析
3.1 单因素试验结果
3.1.1 料液比的确定
不同比例的料液比对肉桂挥发油提取率的影响见图1。

图1 不同料液比对肉桂挥发油提取率的影响Fig.1 Effect of different ratios of solid to liquid onthe extraction rate of volatile oil from cinnamon
由图1可知,料液比从1∶8到1∶14,挥发油提取率呈现先上升后下降的趋势,且当料液比为1∶12时,挥发油的得率最大。因此,选择料液比1∶10、1∶12、1∶14 3个水平进行正交试验。
3.1.2 粉碎粒度的确定
不同粉碎粒度对肉桂挥发油提取率的影响见图2。

图2 不同粉碎粒度对肉桂挥发油提取率的影响Fig.2 Effect of different crushing particle size on the extraction rate of volatile oil from cinnamon
由图2可知,在20,50,60,100目条件下,当粉碎粒度为50目时,挥发油得率最大。因此,选择20,50,60目3个水平进行正交试验。
3.1.3 浸泡时间的确定
挥发油提取过程中,浸泡与否及浸泡时间长短会影响挥发油的得率。不同浸泡时间对肉桂挥发油提取率的影响见图3。

图3 不同浸泡时间对肉桂挥发油提取率的影响Fig.3 Effect of different soaking time on the extraction rate of volatile oil from cinnamon
由图3可知,在浸泡时间分别为0,1,2,3 h时,挥发油提取率呈先平稳后上升再下降的趋势,且在浸泡时间为2 h时,挥发油得率最大。因此,选择1,2,3 h 3个水平进行正交试验。
3.1.4 蒸馏时间的确定
不同蒸馏时间对肉桂挥发油提取率的影响见图4。

图4 不同蒸馏时间对肉桂挥发油提取率的影响Fig.4 Effect of different distillation time on the extraction rate of volatile oil from cinnamon
由图4可知,当蒸馏时间为3,4,5,6 h时,肉桂挥发油提取率呈上升趋势,当蒸馏时间在5 h后,提取率变化不大,当蒸馏时间为6 h时,挥发油得率最大。因此,选择4,5,6 h 3个水平进行正交试验。
3.2 正交试验设计及结果
肉桂挥发油提取工艺因素水平见表1。

表1 肉桂挥发油提取工艺因素水平Table 1 Factors and levels of extraction process of volatile oil from cinnamon

表2 肉桂挥发油提取正交试验设计与结果分析Table 2 Orthogonal test design and results analysis of volatile oil extracted from cinnamon
以挥发油得率为指标,由表2可知,在肉桂挥发油提取过程中,各因素对挥发油得率的影响大小依次是B>A>D>C,即料液比>蒸馏时间>粉粹粒度>浸泡时间。正交试验结果表明,肉桂挥发油提取的最佳工艺条件是A3B2C1D3,即蒸馏时间为6 h,料液比为1∶12,浸泡时间为1 h,粉碎粒度为60目时结果最优。结合试验中的挥发油提取率结果,证实了在该组合条件下,挥发油得率为4.3734%,优于其他试验组合。
3.3 体外抗氧化活性测定结果
3.3.1 清除DPPH自由基和羟自由基的能力
通过测定肉桂挥发油对DPPH自由基和羟自由基的清除率,评价其体外抗氧化活性。研究结果表明,肉桂挥发油具有较好的体外抗氧化活性(见表3)。肉桂挥发油的抗氧化能力以Vc当量来表示,在0.4,0.8,2.0,4.0,8.0 mg/mL浓度下,肉桂挥发油对DPPH自由基清除率(DPPH法)用Vc当量分别为11.4,20.9,78.9,102.3,143.2 mg/g;对羟自由基清除率用Vc当量分别为715.0,396.9,363.9,443.8,485.7 mg/g。

表3 肉桂挥发油清除自由基能力Table 3 Free radical scavenging capacity of cinnamon volatile oil
3.3.2 总还原力的测定
总还原能力的测定是利用样品的抗氧化性,将赤血盐还原后,再与Fe3+作用,生成普鲁士蓝,以普鲁士蓝的生成量来表示样品的还原能力,并以吸光度值来表示,吸光度值越高,说明样品的还原能力越强[14]。
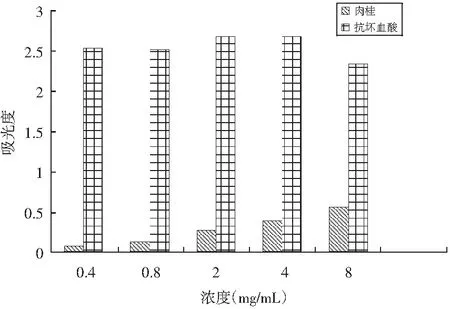
图5 肉桂挥发油与抗坏血酸总还原能力的比较Fig.5 Comparison of total reduction capacity ofcinnamon volatile oil and ascorbic acid
由图5可知,肉桂挥发油的还原能力与浓度呈正相关关系,浓度越高,还原能力越强。以抗坏血酸为阳性对照,以此来评价肉桂挥发油的总还原能力。
4 结论
通过单因素试验和正交试验优化水蒸气蒸馏法提取肉桂挥发油的提取工艺,最佳提取条件为:蒸馏时间为6 h,料液比为1∶12,浸泡时间为1 h,粉碎粒度为60目。在此条件下提取肉桂挥发油,出油率为4.3734%。并采用3种体外抗氧化活性检测方法(DPPH法、羟自由基清除率、总还原能力测定)评价肉桂挥发油的抗氧化活性,结果表明:肉桂挥发油具有一定的抗氧化性,且其浓度与抗氧化活性基本呈现正相关性。本研究通过优化肉桂挥发油的提取工艺,为肉桂挥发油的加工生产和科学合理利用提供一定的理论基础。同时,肉桂不管是作为常用中药还是日常调味品,都在人们的生活中占据重要地位。通过研究肉桂挥发油的体外抗氧化活性对于深入探究其药用价值具有重要的科学意义。
