肺癌诊断中CEA、CYFRA21- 1、NSE 联合检测价值分析
2019-12-18王博张宗超
王博,张宗超
阳谷县人民医院检验科,山东聊城 252300
原发性支气管肺癌简称为“肺癌”,是由支气管黏膜上皮病变引起的恶性肿瘤,分为小细胞、非小细胞肺癌两种[1]。由于肺癌早期无明显症状,许多患者就诊时已处于中、晚期,且症状与良性肺部病症较为相似,故易出现误诊或漏诊,错过最佳治疗时机,影响预后[2-3]。该院选入2017 年1 月—2018 年12 月收治的120 例肺癌患者设定研究对象, 观察血清癌胚抗原(CEA)、细胞角蛋白19 片段抗原(CYFRA21-1)、神经元特异性烯醇化酶(NSE)联合检测的效果,报道如下。
1 资料与方法
1.1 一般资料
该院临床资料采集收治120 例肺癌患者(设定观察组),选入标准:经病理检查确诊,患者、家属知晓研究,自愿参加,签订同意书。 排除标准:其他慢性肺部疾病、合并其他恶性肿瘤、心肝肾脏器病变、临床资料缺失、依从性差等患者。 男女比例64∶56;年龄33~84岁,平均(50.13±5.65)岁;体重指数19~24 kg/m2,平均(21.09±1.24)kg/m2。 同期选取该院体检中心的120 名健康者(设定对照组),男女比例61∶59,年龄30~85岁,平均(51.23±6.03)岁,体重指数19~25 kg/ m2,平均(22.43±1.32)kg/m2。 两组一般资料差异无统计意义意义(P>0.05),具比较性。 该院伦理会同意该项研究。
1.2 方法
取两组清晨空腹静脉血3 mL,3000 r/min, 离心处理10 min,取血清,保存在-20℃冰箱内待检。 选用希森美康HISCL-5000 全自动化学发光分析仪测定血清CEA 水平,选用罗氏cobas e 411 全自动电化学发光免疫分析仪测定NSE 水平,选用安图AutoLumo A2000 全自动化学发光分析仪测定CYFRA21-1 水平,严格遵照说明书操作。血清CEA正常值:0~5 ng/mL,CYFRA21-1 正常值:0~3.3ng/mL;NSE正常值:<25ng/mL。
1.3 观察指标
观察两组3 项肿瘤标志物水平,并比较不同病理类型、不同病理分期肺癌的肿瘤标志物水平。 并记录单项、联合检测诊断肺癌的效能。
1.4 统计方法
数据应用SPSS 18.0 统计学软件进行分析,计数资料(%)进行χ2检验,计量资料(±s)进行t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组肿瘤标志物水平
相较于对照组, 观察组血清CEA、CYFRA21-1、NSE 水平更高,差异有统计学意义(P<0.05),见表1。
表1 两组肿瘤标志物水平比较[(±s),ng/mL]
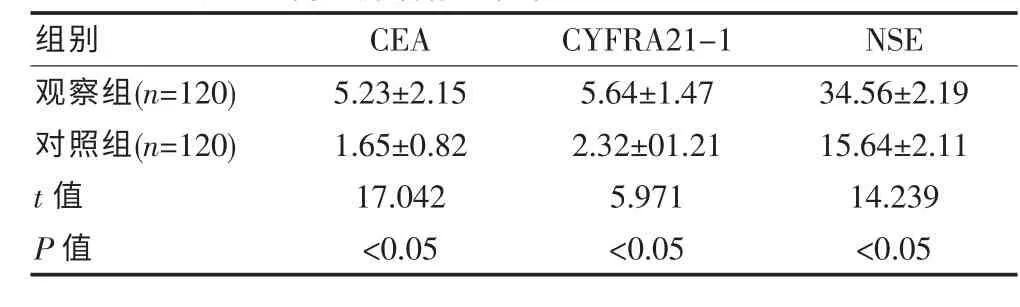
表1 两组肿瘤标志物水平比较[(±s),ng/mL]
组别 CEA CYFRA21-1 NSE观察组(n=120)对照组(n=120)t 值P 值5.23±2.151.65±0.8217.042<0.055.64±1.472.32±01.215.971<0.0534.56±2.1915.64±2.1114.239<0.05
2.2 不同病理类型肺癌肿瘤标志物水平
120 例肺癌患者中,与腺癌相比,鳞癌、小细胞肺癌的血清CEA、CYFRA21-1、NSE 水平均较高; 与鳞癌相比, 小细胞肺癌的血清CEA、CYFRA21-1、NSE水平较高,差异有统计学意义(P<0.05),见表2。
表2 不同病理类型肺癌肿瘤标志物水平比较[(±s),ng/mL]
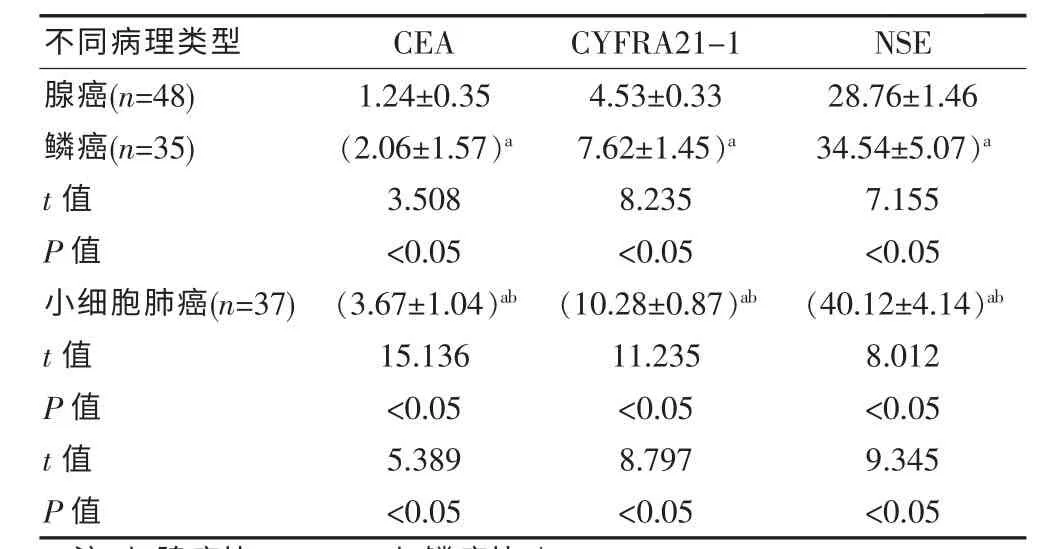
表2 不同病理类型肺癌肿瘤标志物水平比较[(±s),ng/mL]
注:与腺癌比,aP<0.05;与鳞癌比,bP<0.05
不同病理类型 CEA CYFRA21-1 NSE腺癌(n=48)鳞癌(n=35)t 值P 值小细胞肺癌(n=37)t 值P 值t 值P 值1.24±0.35(2.06±1.57)a 3.508<0.05(3.67±1.04)ab 15.136<0.055.389<0.054.53±0.337.62±1.45)a 8.235<0.05(10.28±0.87)ab 11.235<0.058.797<0.0528.76±1.4634.54±5.07)a 7.155<0.05(40.12±4.14)ab 8.012<0.059.345<0.05
2.3 不同病理分期肺癌肿瘤标志物水平
在120 例肺癌患者中,与Ⅰ期比,Ⅱ期、Ⅲ期、Ⅳ期的血清CEA、CYFRA21-1、NSE 水平更高, 差异有统计学意义(P<0.05);与Ⅱ期比,Ⅲ期、Ⅳ期的血清CEA、CYFRA21-1、NSE 水平更高,差异有统计学意义(P<0.05);与Ⅲ期比,Ⅳ期的血清CEA、CYFRA21-1、NSE 水平更高,差异有统计学意义(P<0.05),见表3。
表3 不同病理分期肺癌肿瘤标志物水平比较[(±s),ng/mL]
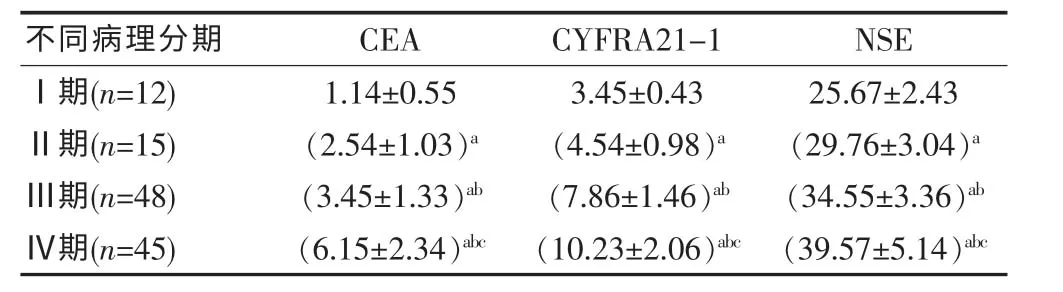
表3 不同病理分期肺癌肿瘤标志物水平比较[(±s),ng/mL]
注:与Ⅰ期比,aP<0.05;与Ⅱ期比,bP<0.05;与Ⅲ期比,cP<0.05
不同病理分期 CEA CYFRA21-1 NSEⅠ期(n=12)Ⅱ期(n=15)Ⅲ期(n=48)Ⅳ期(n=45)1.14±0.55(2.54±1.03)a(3.45±1.33)ab(6.15±2.34)abc 3.45±0.43(4.54±0.98)a(7.86±1.46)ab(10.23±2.06)abc 25.67±2.43(29.76±3.04)a(34.55±3.36)ab(39.57±5.14)abc
2.4 单项、联合检测诊断肺癌的效能
在120 例肺癌患者中,3 项指标联合检测诊断的准确性、 灵敏性及特异性分别为91.07%、82.68%、98.56%, 明显比CEA、CYFRA21-1、NSE 单项检测诊断更优,差异有统计学意义(P<0.05),见表4。
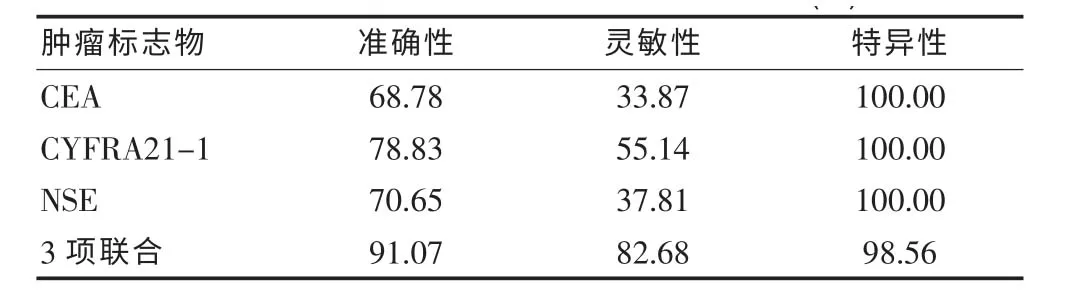
表4 单项、联合检测诊断肺癌的效能比较(%)
3 讨论
目前,肿瘤为全球恶性病症,严重危害人体健康。肿瘤的发生、发展与肿瘤细胞表层糖基化存在紧密关系,随着越来越多的肿瘤标志物被检测出,各大肿瘤疾病开始采取肿瘤标志物检测作为诊断辅助手段,该方法操作简单、微创且安全性高,被广大肿瘤患者接受,故称为肺癌诊断方式之一[4]。肿瘤标志物是经肿瘤细胞分泌或脱落至细胞外的一类物质, 主要分为酶、激素、蛋白质、癌基因产物几种,在体液、血液中均有分布, 这类物质可以体现出肿瘤细胞的发展状态,并与肿瘤转化存在密切关系, 当机体处于健康状态时,组织内所包含的肿瘤标志物极少[5-7]。 在该次研究中,该院对收治的120 例肺癌患者进行CEA、CYFRA21-1、NSE 联合检测, 结果显示: 观察组血清CEA (5.23±2.15)ng/mL、CYFRA21-1(5.64±1.47)ng/mL、NSE(34.56±2.19)ng/mL 相较于对照组水平均更高; 这与杨浩等[8]研究结果[肺癌组患者血清CEA(5.27±2.16)ng/mL、CYFRA21-1(3.55±1.46)ng/mL、NSE(16.83±5.46)ng/mL均明显高于健康对照组, 比较差异有统计学意义]相似,可见,CEA、CYFRA21-1、NSE 水平检测能用于肺癌诊断。 同时,该研究显示: 在120 例肺癌患者中,与腺癌相比,鳞癌、小细胞肺癌的血清CEA、CYFRA21-1、NSE 水平均较高;与鳞癌相比,小细胞肺癌的血清CEA、CYFRA21-1、NSE 水平较高;提示CEA、CYFRA21-1、NSE 联合检测能帮助判断肺癌的病理分型,这与董芸等[9]研究结果一致;另外,在120 例肺癌患者中,与Ⅰ期比,Ⅱ期、Ⅲ期、Ⅳ期的血清CEA、CYFRA21-1、NSE 水平更高; 说明CEA、CYFRA21-1、NSE 联合检测还能帮助判断肺癌的病理分期。分析上述结果的原因可能为:CEA 是一种蛋白多糖复合物,通常分布在肝、胰腺、正常胚胎肠道,在内胚叶引起的消化系统癌中分布极为广泛, 故诊断结直肠癌的灵敏性较高,而在正常机体血清内的水平极低[10]。CEA 为广谱性肿瘤标记物,可以反映各种肿瘤,尽管CAE 在良性肺部病症中有时表现出异常,但对于肺癌疑似患者,若CEA水平高于10 μg/mL 时, 提示腺癌或大细胞肺癌的可能性更高[11]。 CYFRA21-1 则是细胞角蛋白19 的某一片段,主要由食管癌、肺癌产生,通常在单层或复层上皮肿瘤细胞胞质内分布, 经肿瘤细胞溶解后流入血液,在肺癌组织内水平极高,故近几年开始用于肺癌诊断,能用于诊断、鉴别肺部良恶性疾病[12]。此外,NSE为一种烯醇化酶,主要参与糖酵解,在神经或神经内分泌组织中均有所分布, 脑组织细胞内的NSE 表达能力最强,而在神经分泌组织、外周神经中处于中等水平,血清、脊髓液及非神经组织内的水平较低,该物质是经神经内分泌组织引起的肿瘤研究所发现,在小细胞肺癌中被检测出大量NSE,故诊断小细胞肺癌的敏感性极高[13]。 另外,该研究显示3 项指标联合检测诊断肺癌的准确性91.07%、 灵敏性82.68%明显比CEA、CYFRA21-1、NSE 单项检测诊断更高;进一步表明多种肿瘤标志物联合检测能提升肺癌诊断的准确性。
综上所述, 肺癌采用CEA、CYFRA21-1、NSE 联合检测诊断的价值显著, 能提高肺癌诊断准确性,并有助于病理类型、病理分期的诊断,指导临床诊治,值得推广。
