白鲜皮联合紫草油治疗大鼠急性湿疹作用机制研究
2019-12-18翁雅芳罗模桂刘官智
杨 旭,翁雅芳,罗模桂,汪 瑜,刘官智△
1.四川省自贡市第四人民医院(自贡643000);2.四川省卫生康复职业学院(自贡643000);3.成都市癌症防治中心(成都市肿瘤质控中心)(成都 610041)
急性湿疹(Atopic eczema,AE)是最常见的皮肤病,每5个人中就有一个在一生中受到影响,最近的数据显示,其患病率仍在上升,特别是在低收入国家。其发病是一种复杂的慢性疾病,可导致各种令人痛苦的症状,如瘙痒、睡眠障碍以及皮肤外观改变等[1]。研究发现中药治疗湿疹具有独特优势,但治疗湿疹的中药方剂很多,最常见的有三黄止痒洗剂、消风散、除湿汤等。现阶段,在湿疹治疗中应用中药的研究已经有很多,但其具体作用机制还没有得到充分系统的研究,另外,在治疗效果上还需要进一步的提高[2-3]。白鲜皮是一种治疗皮肤病的抗炎药物,主要用于治疗湿疹、特应性皮炎和牛皮癣等皮肤病,其还具有杀虫、止痒、清热除湿等作用[4]。紫草油具有凉血、活血、解毒透疹、抗菌抗炎、抗过敏、抑制渗出及减少水肿等作用[5]。关于两者联合治疗湿疹的作用机制报道尚少,本研究通过白鲜皮联合紫草油治疗大鼠湿疹的研究,初步探索其可能的作用机制,为有效治疗湿疹提供科学理论依据。
材料和方法
1 材 料
1.1 试验动物及分组:40只健康SD大鼠购自成都达硕实验动物有限公司,雌雄各半,体质量180~220 g,使用许可证号:SYXK(川)2014-189。大鼠在条件为温度(22℃~25℃)和湿度(35%~75%),12 h昼夜光照交替,自由摄食饮水下养殖。大鼠被随机分为5组,分别为空白组、模型组、白鲜皮组、紫草油组、白鲜皮联合紫草油组,每组8只大鼠,大鼠每笼2只进行饲养。
1.2 大鼠湿疹模型制备:造模采用2,4-二硝基氯苯(DNCB)(成都科龙化工试剂厂)于大鼠背部皮肤造模[6]。具体方法为实验前1天大鼠背部去毛,面积约6 cm2,于第1天,用150 μl 1%DNCB溶解在丙酮:橄榄油混合物(3∶1v/v)中施用背部皮肤,于第5天,背部皮肤施用150 μl 0.2 %DNCB溶液[溶解在丙酮:橄榄油混合物(3∶1v/v)],每周3次,共4周(第5~33天)。空白组大鼠背部皮肤施用相同量的丙酮橄榄油混合物(3∶1v/v)。观察造模大鼠,如大鼠皮肤上出现瘙痒、红斑/出血、水肿、剥蚀/糜烂和鳞屑/干燥等湿疹样皮损表现,即为造模成功。
2 方 法
2.1 给药方法:造模成功后第2天起开始给药,空白组和模型组仅给予纯净水外洗,白鲜皮组:以浓度5 %的白鲜皮提取液(分别取白鲜皮药材50 g加入1300 ml冷水中浸泡30 min后,煎煮约30 min至1000 ml,制备5 %的提取液)用注射器反复外洗背部皮肤5 s左右,每天2次,每次5 ml。紫草油组:以浓度100 %的紫草油(80℃加热15~20 min,以紫草轻度变焦炭为度,待油冷却后过滤)于背部皮肤外涂治疗,2次/d。白鲜皮联合紫草油组:先用5 %的白鲜皮提取液反复外洗背部皮肤5 s左右,后以100 %的紫草油外涂背部皮肤治疗,2次/d。每组均连续治疗12 d。白鲜皮、紫草均来自四川省中医药研究院。
2.2 样本采集:末次给药24 h后经大鼠眼球取血2 ml,1500 r/min离心20 min,取出血清置于微量离心管内,-80℃冰箱保存备用;断颈处死实验大鼠,取大鼠造模区皮肤组织,分成两份,一份于4 %多聚甲醛固定,另一份于-80℃低温保存,用于后续检测。
2.3 观察指标
2.3.1 湿疹程度及严重度指数评分(Eczema area and severity index,EASI):评分方法参考《湿疹面积及严重度指数评分法》[7]。湿疹程度以水肿/丘疹、红斑、渗出/结痂、剥脱/抓痕、苔藓化为主要观察表现。以0~3分计分湿疹表现的严重度,0分为无(仔细观察后也不能确定),1分为轻(需仔细观察才能见到),2分为中(此体征可立即看到),3分为重(此体征非常明显),各种症状分值之间可记0.5分。
2.3.2 病理组织学观察:将固定的皮肤组织按常规方法制备石蜡切片,HE染色,镜检观察病理组织变化并拍照。
2.3.3 酶联免疫法:ELISA检测血清因子:采用ELISA试剂盒(上海茁彩)检测大鼠血清中IFN-γ(货号:ZC-36294)、IL-4(货号:ZC-36402)、IL-31(货号:ZC-32435)、LTB4(货号:ZC-36369)、LTC4(货号:ZC-36371)含量。
2.3.4 免疫组化检测皮肤组织CysLTR1、CysLTR2表达:取固定后的大鼠皮肤组织,进行洗涤、脱水、石蜡包埋,连续切片在含有2 %明胶的温水中漂浮,以防止样品脱落,加一抗、二抗孵育,并用3,3-二氨基联苯胺(DAB)为底物的Vectaain Elite ABC试剂盒(Vector)显影,光镜检查,选择阳性物质最明显处5个视野,放大400倍,采用Image-Pro Plus图像分析系统(Media Cybernetics,Inc.公司)半定量检测阳性物质的积分光密度(IOD),计算平均IOD。
2.3.5 WB检测皮肤组织中间丝聚合蛋白(FLG)、蛋白酶激活受体-2(PAR-2)、TRPV1含量:采用RIPA裂解液低温提取总蛋白,BCA法测定总蛋白量,蛋白质(10 μg)经SDS-聚丙烯酰胺凝胶电泳分解,转移到PVDF(聚偏氟乙烯)膜上。将膜封闭在5 %的脱脂牛奶中2 h,加入初级抗体孵育过夜:FLG、PAR-2、TRPV1(稀释1∶1000),用PBST洗涤膜,随后用辣根过氧化物酶结合的山羊抗兔抗体(1∶20000)在室温下孵育2 h,PBST清洗膜,采集图像并进行软件分析,以目标条带与内参条带A值的比值作为目的蛋白的表达含量。

结 果
1 不同处理组EASI评分 模型组大鼠较空白组EASI评分明显升高,差异有统计学意义(P<0.01);与模型组比较,白鲜皮组、紫草油组、白鲜皮联合紫草油组皮损评分明显下降,差异具有统计学意义(P<0.05),联合用药组EASI评分下降较单一用药组明显,表现红斑、丘疹、抓痕/剥脱均减轻的现象,见表1。
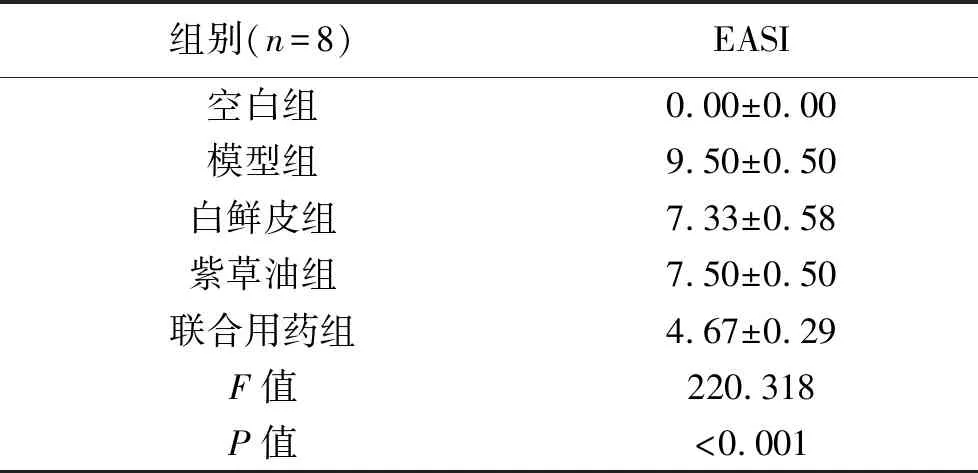
表1 不同处理组EASI评分(分)
2 皮肤病理组织学观察 空白组:组织结构清晰,无明显异常。模型组:病理组织改变明显,可见皮肤组织结构充血模糊、水肿及炎细胞浸润。白鲜皮组:可见组织结构较清晰、局部可见充血、水肿及炎细胞浸润。紫草油组:可见皮肤组织局部出现充血、水肿、局部结构呈现模糊,病理损伤较模型组减轻。白鲜皮联合紫草油组:组织结构清晰、水肿、充血及炎细胞浸润少见,病理损伤较模型组明显减轻,见图1。
3 不同处理组血清因子 ELISA结果显示,模型组较空白组IL-4、IL-31、LTB4、LTC4水平明显升高,IFN-γ水平明显降低,差异具有统计学意义(P<0.01);经不同处理治疗,仅白鲜皮联合紫草油组较模型组IL-4、IL-31、LTB4、LTC4水平明显降低,IFN-γ水平较明显升高,组间差异具有统计学意义(P<0.01),见表2。
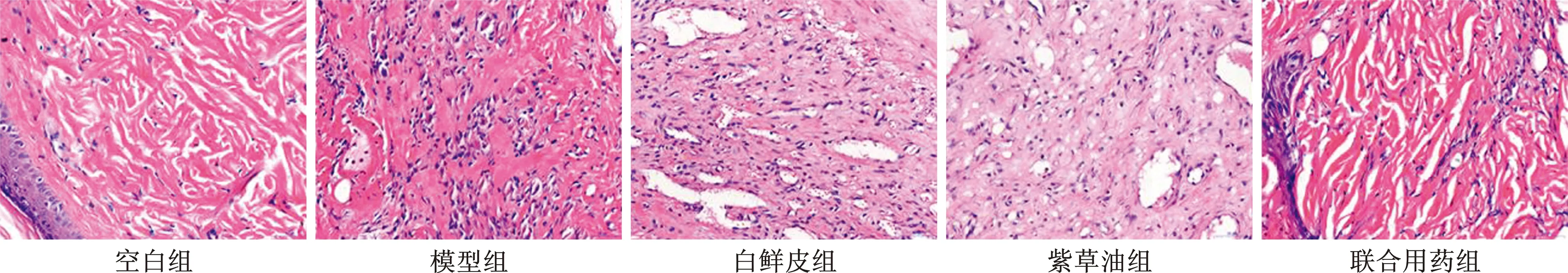
图1 不同处理组病理组织学观察(HE染色,×400)
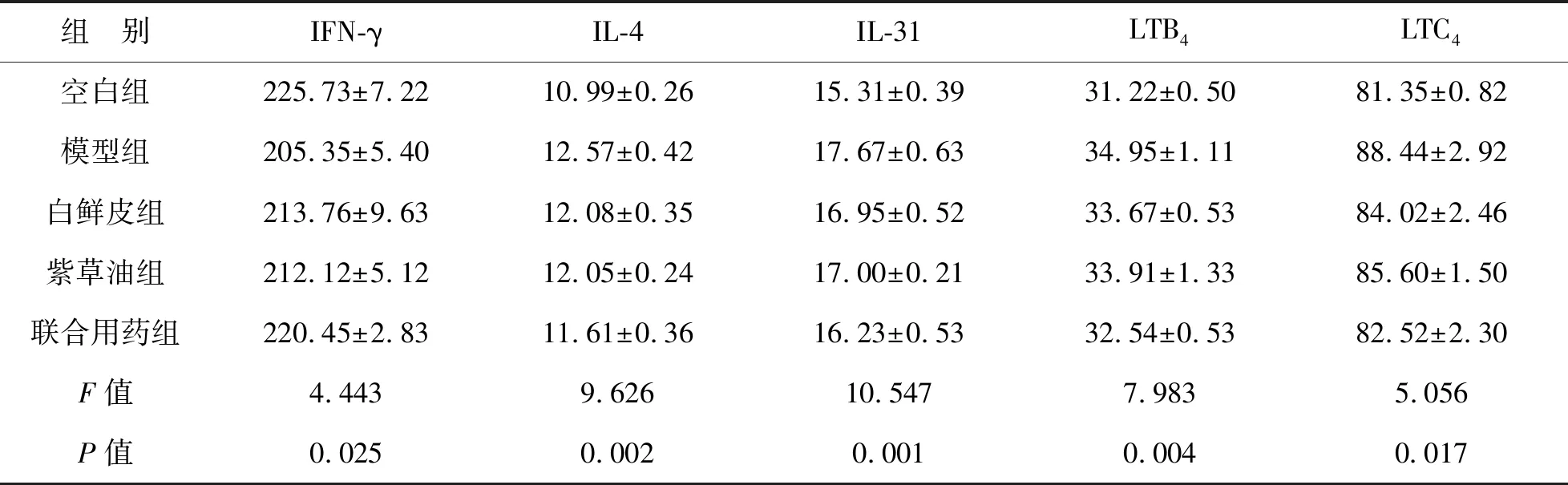
表2 不同处理组IFN-γ、IL-4、IL-31、LTB4、LTC4水平(pg/mg)
4 不同处理组皮肤组织CysLTR1、CysLTR2水平 与空白组比较模型组大鼠CysLTR1、CysLTR2水平明显升高,差异具有统计学意义(P<0.01);经不同处理治疗,仅白鲜皮联合紫草油组较模型组CysLTR1、CysLTR2水平明显降低,差异具有统计学意义(P<0.01),见表3,图2。
5 不同处理组皮肤组织FLG、PAR-2、TRPV1含量 WB结果显示,模型组较空白组PAR-2、TRPV1水平明显升高,FLG水平明显降低,差异具有统计学意义(P<0.05);经不同处理治疗,仅白鲜皮联合紫草油组较模型组PAR-2、TRPV1水平明显降低(P<0.05),FLG水平较模型组升高,但无统计学意义(P>0.05),图3。
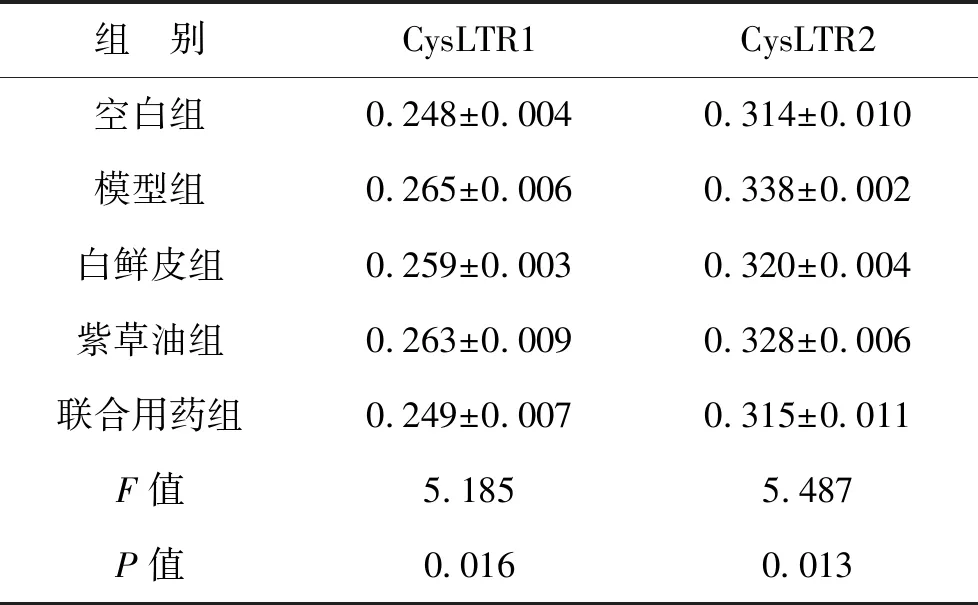
表3 不同处理组CysLTR1、CysLTR2水平(n=8)
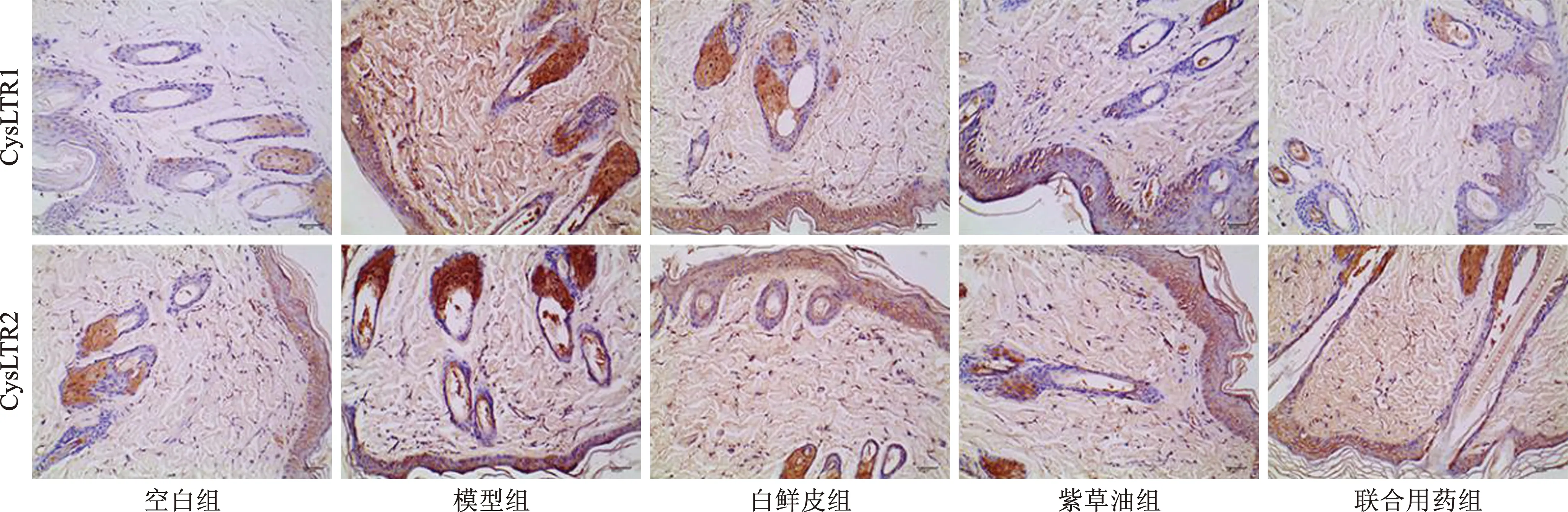
图2 免疫组化图(×400)
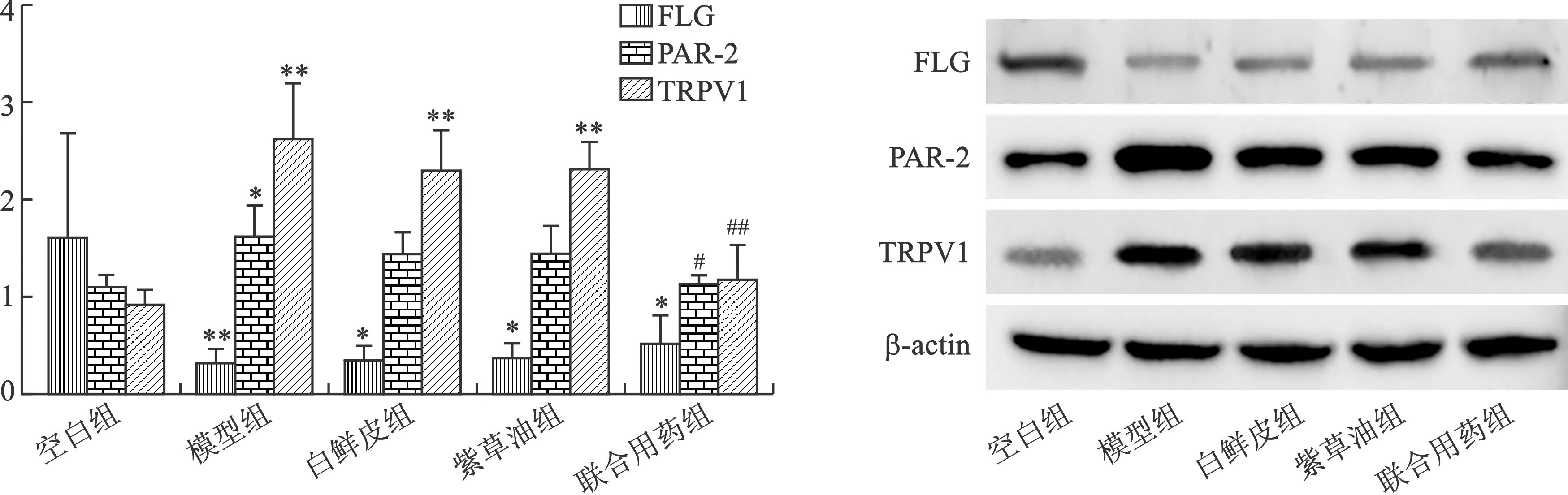
图3 不同处理组FLG、PAR-2、TRPV1含量
讨 论
AE是临床常见的表皮及真皮浅层的炎症性皮肤科常见病,典型表现为持续性瘙痒、红肿、浸润、增厚、粗糙等,发病时会严重影响患者的生活质量,其发病机制复杂,研究认为主要由代谢异常、内分泌失调、患者自身消化系统疾病、外部环境中的病毒和细菌以及温湿度和异物过敏原的刺激等因素引起[8],造成了一定程度的治疗困难。并且,糖皮质激素长期应用可出现皮肤萎缩、色素沉着、毛细血管扩张、系统吸收、快速抵抗等副作用,且停药易复发,因此限制了激素的长期应用和用量,目前如何提高临床疗效、抑制复发和预防发生不良反应等已经成为近年来临床治疗湿疹的热点。因此,以中药治疗湿疹为切入点,对中医药治疗湿疹的作用机理进行研究,为中医药在临床湿疹治疗中的应用指导提供新的思路。天然产物萜类化合物具有广泛的生物活性,包括抗炎、抗癌、抗血管生成、抗真菌和抗乙肝病毒活性,这使得对这类成分的植物化学或生物活性研究具有重要意义,白鲜皮根皮属于芸香科植物,是一种富含型半萜类的植物,作为一种传统中药,在中国几千年来,由于其止痒、清热和祛湿的能力,它被广泛用于治疗炎症、微生物感染、外阴瘙痒、湿疹、疥疮、癌症和其他疾病。此外,还能有效抑制高脂饮食引起的体重和脂肪含量增加,降低血液中甘油三酯(TG)和总胆固醇含量,减轻肥胖,并具有杀虫作用。
先前的研究表明,中药不仅可以治疗胃炎、胃溃疡、糖尿病、类风湿性关节炎等;中药在AE治疗方面具有治疗效果显著、治疗组分及靶标途径多的特点,在应用于AE治疗上已成为研究热点[9-11]。因此从这一点出发,建立急性湿疹大鼠模型,对急性湿疹进行中药治疗,以寻找更有效的中药治疗湿疹方法,并通过试验研究中药治疗湿疹的作用机制。白鲜皮性味苦、寒;归胃、脾、膀胱经,其具有祛风、清湿、解毒等功能,多用于风/湿疹、疮毒湿热、风湿热痹、疥癣疮癞、黄疸尿赤等,具有多重药效药理作用[12]。紫草性味咸、甘、寒,归肝、心两经,其具有活血、清热、透疹、解毒等功能。紫草素及其衍生物是紫草的主要化学成分,在抗炎、抗菌、免疫调节等方面具有较为广泛的生物活性,在各种皮肤病治疗中应用广泛,并取得了一定疗效[13]。
至今为止,湿疹的发病机制仍未完全明确,在免疫炎症性反应中,Th1/Th2亚群及其相互之间的平衡在免疫应答的调节中起着关键的作用。研究指出,当机体的免疫系统被激活,诱导Th2细胞转化为Th1细胞,其进一步产生的炎症因子对靶器官造成一定的损害,从而导致相关疾病的发生。除了Th1和Th2细胞外,其他T细胞亚型包括Th17和Th22细胞也在皮炎与湿疹的发病机制中具有重要作用[14]。细胞因子主要由Th1、Th2分泌,其分泌异常在AE的发病过程中起着重要作用[15]。研究发现IL-31、IFN-γ、IL-4、LTB4、LTC4水平与湿疹相关,IL-31水平在AE患者皮损处明显上调,可引起皮肤炎症细胞浸润、瘙痒[16]。LTB4、LTC4、CysLTR1、CysLTR2水平在AE患者中明显升高[17]。LTB4、LTC4可使白细胞趋化作用引起皮肤表现出红斑、肿胀、渗出,其引起的皮损表现,中医多辨证为湿热蕴肤证[18]。可见LTB4、LTC4、CysLTR1、CysLTR2水平升高参与AE皮损表现,而中医药治疗AE达到清热、燥湿、止痒的机制可能与抑制炎症细胞浸润及下调LTB4、LTC4水平及其受体的表达相关。AE所致的皮肤瘙痒常由内源性及外源性化学物质介导的多条信号通路共同传递。编码丝聚蛋白原的主要基因FLG减少可导致保湿因子的大量减少从而引起皮肤干燥、粗糙,最终致使皮肤受损引起皮肤屏障功能异常[19]。目前认为皮肤瘙痒发生的一条主要途径为非组胺依赖的PAR-2途径,其下游信号分子是TRPV1,是痒觉通路传递的枢纽,PAR-2广泛表达于人体皮肤上,AE发生时,PAR-2被活化可破坏皮肤屏障功能,PAR-2被激活后最后会致使下游TRPV1通道开放,增加TRPV1活性诱导产生痒觉[20]。因此,抑制PAR-2/TRPV1信号通路激活,对延缓AE发展具有重要意义。
本研究表明,白鲜皮联合紫草油可调节急性湿疹大鼠Th1/Th2细胞分泌,减少细胞因子IL-31、IL-4水平,抑制PAR-2、TRPV1表达,其机制可能是通过PAR-2/TRPV1信号通路来实现,发挥治疗急性湿疹瘙痒的作用。
