艾滋病合并肺弥漫大B细胞淋巴瘤1例并文献复习
2019-12-16朱艳梅邓莉平
朱艳梅 邓莉平 杨 炯
艾滋病 (acquired immunodeficiency syndrome,AIDS)是由于人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染而导致的慢性传染病,由于其免疫功能低下,容易并发各种严重的机会性感染和恶性肿瘤。在艾滋病感染患者中,淋巴瘤发病率高达3%~10%[1],仅次于卡波西肉瘤。本文报道1例我院收治的艾滋病合并肺弥漫大B细胞淋巴瘤的诊治过程,同时复习相关文献,旨在提高对本病的认识。
1 病例资料
1.1病史 患者,男,47岁,已婚,因“间断发热9个月”于2018年11月8日入院。患者2018年3月14日因发热1月余,胸闷伴喘息1周,当地HIV初筛阳性后转入我院,查 CD4+T淋巴细胞3个/μl,行胸部CT检查示双肺磨玻璃影,呈间质性改变(见图1A),考虑为卡氏肺孢子菌肺炎,艾滋病,予以复方磺胺甲噁唑片抗卡氏肺孢子菌肺炎,拉米夫定、替诺福韦、依非韦伦联合抗病毒治疗,后体温恢复正常。2018年3月29日再次因发热伴胸闷入院,复查胸部CT示双肺磨玻璃影较前吸收,呈间质性改变,予以抗感染(头孢噻利/美罗培南针+左氧氟沙星针)治疗11天体温无明显下降,于2018年4月10日予以诊断性抗结核治疗,4月16日体温降至正常,出院后继续抗HIV病毒(拉米夫定+替诺福韦+依非韦伦)、预防卡氏肺孢子菌肺炎(复方磺胺甲噁唑片)、抗结核治疗(异烟肼+利福平+乙胺丁醇+吡嗪酰胺强化治疗3个月,后改为利福平+异烟肼巩固治疗),出院后6个月余未来院复诊。2018年11月8日再次因发热1月余入院,每天下午及晚上发热,最高体温波动于38℃~38.5℃,第二天早上自行退热,外院抗感染治疗无效。既往慢性乙型病毒性肝炎病史2年,2型糖尿病病史8个月,现口服格列齐特缓释片降糖治疗。入院查体:T 37.6℃,P 100次/分,R 21次/分,BP 132/61 mmHg,舌面可见白斑,心肺腹查体未见明显异常。

图1 左下肺实变变化过程
1.2实验室检查 2018年11月入院后血常规:白细胞2.54×10-9/L、红细胞 2.84×10-12/L、血红蛋白94.1 g/L、中性粒细胞百分比 76.9%;CRP:30.6 mg/L;ESR:116 mm/h;真菌 D葡聚糖37.17 pg/mL;EB病毒 DNA:阳性(+),4.37E3;CD4+T淋巴细胞 15/μl;LDH:186 U/L;β2-MG:2944.4 mg/L。
1.3胸部CT 双侧胸廓对称,胸壁完整。纵膈居中,其内多发淋巴结影;双侧胸膜略增厚,胸腔未见积液征象。左肺下叶见肿块影,大小约62 mm×58 mm,双肺见片状密度增高影、纤维条索影及多发囊状无肺纹理区,左肺上叶前段见直径约为8 mm结节,周围见纤维条索影(见图1B)。胸部增强CT:左肺下叶肿块呈不均匀强化,边缘强化为主,内部未见明显强化;余未见明显异常强化(见图1C)。
1.4 骨穿 三系增生伴感染性改变。
1.5病理 肺组织穿刺活检:非霍奇金淋巴瘤伴坏死,考虑弥漫大B细胞淋巴瘤。免疫组化:CK(-),VIMENTIN(+),Ki-67阳性率约 60%,CD68(KPI)(+),TTF-1(+),ALK-1(-),LCA(+),CD138(-),SYN(-),CD3(-),CD20(+),CyclinD1(-),Bcl-2(+),CD10(+)(见封四图2)。
1.6PET-CT ①左肺下叶软组织肿块,代谢环形异常增高,符合恶性淋巴瘤浸润征象(见图3);②纵膈及左侧肺门区多发肿大淋巴结,代谢增高;左肺上叶前段小结节,代谢增高。与本院2018年4月2日CT比较无明显变化,考虑为炎性病变可能性大,建议随访;③全身其余探测部位未见明显恶性浸润征象;④双肺肺气肿;左肺上叶散在炎性增殖灶;⑤前列腺钙化灶;前列腺左叶多为生理性显影或炎症;⑥胸腰椎部分椎体退行性改变。
1.7治疗 患者入院后予以抗感染(头孢噻利针+左氧氟沙星针)、抗真菌(氟康唑口服)、继续巩固抗结核(异烟肼+利福平)、预防卡氏肺孢子菌肺炎(复方磺胺甲噁唑片)、抗HIV病毒(拉米夫定+替诺福韦+依非韦伦)治疗,仍持续低热,2018年11月12日行肺部CT示左肺下叶肿块,结合患者AIDS病史,容易合并各种机会性感染,考虑结核、真菌感染可能性大,继续抗结核治疗,同时将氟康唑口服改为针剂加强抗真菌治疗;11月15日患者胸部CT增强检查提示左肺下叶肿块轻度不均匀强化伴坏死,患者仍发热,每天体温最高达38℃,可自行降至正常,调整抗生素为利奈唑胺+美罗培南针,覆盖革兰阳性球菌、革兰阴性杆菌,同时将氟康唑针改为伏立康唑针加强抗真菌治疗;11月19日行经皮肺穿刺组织活检,11月24日病理结果提示肺弥漫大B细胞淋巴瘤;期间患者仍每天间断低热,11月25日停用利奈唑胺+美罗培南针,改为头孢曲松他唑巴坦+左氧氟沙星针;11月27日完善PET-CT检查,提示左肺下叶软组织肿块代谢呈环形增高,符合恶性淋巴瘤浸润征象,纵膈及肺门肿大淋巴结考虑炎性病变可能性大,诊断明确,考虑肺弥漫大B细胞淋巴瘤;本拟予以R-CHOP方案化疗,但患者因经济原因,于11月28日予以EPOCH(依托泊苷 40 mg/m2、泼尼松 75 mg/m2、表柔比星 75 mg/m2、环磷酰胺 750 mg/m2、长春地辛 1.4 mg/m2)方案化疗,同时调整抗HIV病毒药物为(多替拉韦+替诺福韦+拉米夫定);11月30日患者体温降至正常。12月8日复查胸部CT示左下肺肿块较前稍缩小,约65 mm×52 mm(vs前片73 mm×54 mm)(见图1D)。目前正在继续治疗中。
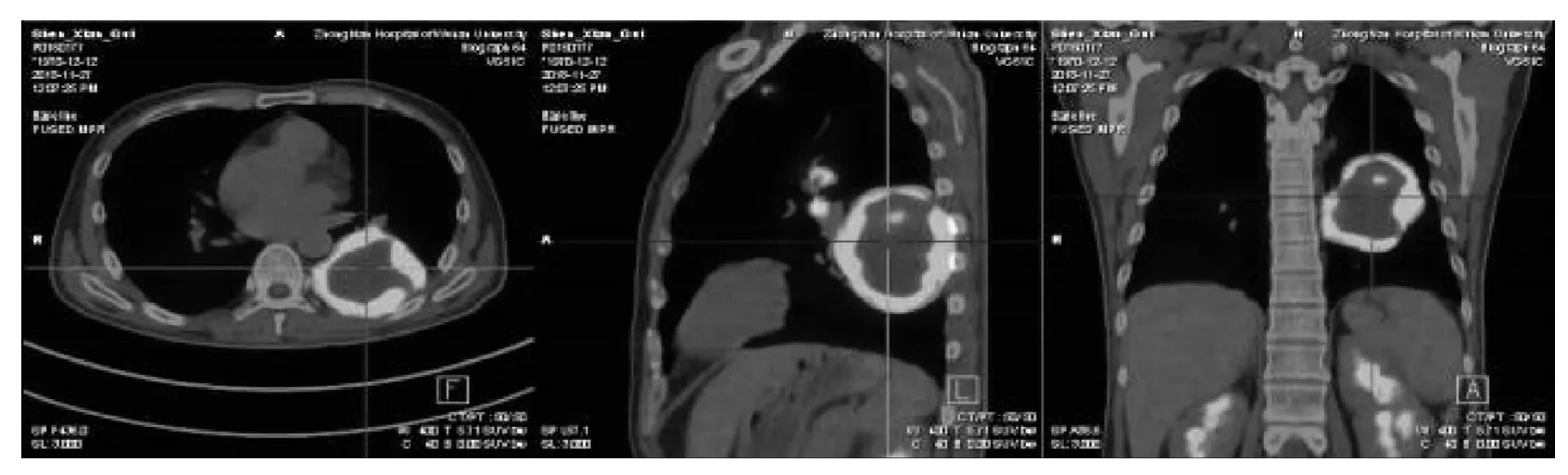
图3 PET-CT显示左肺下叶软组织肿块,代谢环形异常增高
2 讨论
艾滋病是全球范围内危害较大的传染病之一。艾滋病患者免疫功能低下,易并发机会性感染和肿瘤,艾滋病相关性淋巴瘤(AIDS-related lymphoma,ARL)是艾滋病患者常见的恶性肿瘤之一,其本质为免疫细胞的恶变,与普通人群相比,AIDS患者淋巴瘤的发病率比非HIV感染患者高200~600倍[2]。近年来,流行病学显示,ARL已逐渐取代卡波西肉瘤,成为最常见的AIDS相关恶性肿瘤,病理分型上以B细胞来源的淋巴瘤为主,占90%以上,而T细胞淋巴瘤仅占3%左右;常见的病理类型包括大细胞性免疫母细胞淋巴瘤、弥漫大B细胞淋巴瘤、浆母细胞淋巴瘤、Burkitt淋巴瘤等[3]。ARL可源于淋巴结内和结外器官,结外受累好发于胃肠道,尤其是小肠、胃、肛周,而肺淋巴瘤非常罕见,国内外少有报道,本文所报道的即为艾滋病合并肺弥漫大B细胞淋巴瘤。
ARL的发病机制至今不明,有报道提出,ARL本质为免疫细胞恶变,临床和生物学的多向性反映了其具有多种不同的发病途径,其中HIV感染后的免疫抑制、持续的B细胞抗原刺激释放IL-6、IL-10、CD23、CD30和CD44等细胞因子,MYC和BCL-6基因重排、p53突变缺失、RAS突变、遗传异常、细胞活素释放和失调、树突状细胞受损或(和)EB病毒、人疱疹病毒-8、丙型肝炎病毒等病毒感染是主要的致病因素,这些刺激引起免疫球蛋白变量基因重排,最终使AIDS患者发生ARL[4]。本例即合并慢性EBV感染。
艾滋病合并肺内淋巴瘤肺部表现缺乏特异性,与病变部位及侵袭程度有关,病变主要沿支气管粘膜下浸润生长,多不引起支气管堵塞,早期可无症状,仅体检发现,部分患者可表现为咳嗽、咳痰、呼吸困难、发热、消瘦、乏力、盗汗、咯血等非特异性症状。Agarwal等[5]报道的1例原发性肺弥漫大B细胞淋巴瘤,以反复发热、胸闷为首发表现。本例患者主要表现为反复午后及夜间发热,无明显咳嗽、咳痰、消瘦等症状,抗生素治疗无效,曾误诊为肺结核。
艾滋病合并肺内淋巴瘤肺内病变主要侵犯肺间质和支气管粘膜下淋巴组织,CT表现多种多样,无特异性,主要有以下几种形式:①结节肿块型:表现为肺内单发或多发结节、肿块,形态不规则,边界清楚,部分边缘可见磨玻璃影,主要分布于肺间质内、支气管旁、胸膜下,肿块内可见支气管征,较大时会出现坏死和空洞[6],CT增强扫描呈轻度不均匀强化,中间可有坏死,可能与淋巴瘤生长迅速,血供不足坏死有关。此型最多见,需与周围型肺癌、侵袭性肺曲霉菌病等鉴别,多发结节或肿块还需与转移瘤、弥漫结节型肺泡癌鉴别;②肺炎肺泡型:部分患者可表现为沿肺段或肺叶走行的实变影,病灶边缘清楚,也可模糊,其内可见支气管充气征。此型需与大叶性肺炎、干酪性肺炎等鉴别;③间质型:此型少见,表现为自肺门向外弥漫分布的细小或网状结节,需与间质性肺炎相鉴别;④纵隔及肺门淋巴结肿大、胸腔积液:部分患者合并纵膈及肺门淋巴结肿大,但不如非HIV感染者常见;肺内淋巴瘤伴胸腔积液虽然不具有特异性但很常见,部分只表现为胸腔、心包、腹腔积液而不伴有肿块的为原发渗出性淋巴瘤[7]。本例表现为肿块型,内可见支气管充气征及坏死,增强扫描呈轻度不均匀强化,纵膈及肺门可见肿大淋巴结,曾误诊为肺曲霉菌病、肺结核,予以抗真菌、抗结核治疗无效。
ARL治疗包括抗肿瘤化疗、抗病毒治疗及对症支持治疗。CHOP方案是治疗淋巴瘤的经典方案,也是合并HIV感染的淋巴瘤患者的首选方案。近年来,随着CD20单克隆抗体利妥昔单抗在非霍奇金淋巴瘤的治疗取得较好的疗效,利妥昔单抗联合化疗在AIDSDLBCL的治疗也取得一定的进展。高效抗反转录病毒治疗(highly active antiretroviral therapy,HAART)广泛应用后,使ARL患者免疫功能重建,机会性感染发生率下降,对化疗的耐受性提高,标准剂量或大剂量化疗得以安全有效的实施,患者寿命明显延长,较单用化疗的患者预后好,生存期与HIV阴性淋巴瘤患者接近,1年生存率可达66%,5年生存率可达55%[8],化疗联合HAART成为ARL的标准治疗。Ribera等[9]学者认为,R-CHOP治疗AIDS-DLBCL安全、可行、有效,影响预后的因素主要取决于淋巴瘤相关的因素和患者机体对HAART治疗的反应。
总之,艾滋病患者,由于免疫系统的缺陷,容易并发各种肺部疾病,如肺结核、真菌感染、细菌感染、卡波西肉瘤、淋巴瘤、肺癌等,这些疾病在临床及影像学表现上都有相似之处,对临床的诊疗带来一定的困难。艾滋病合并肺内淋巴瘤临床表现缺乏特异性,胸部CT也缺乏特异性影像特征,确诊主要依靠经皮肺穿刺活检术、胸腔镜或开胸手术获得病理学依据,临床上容易误诊及漏诊。这提示,在艾滋病患者的诊治过程中,要形成系统的临床诊断,对于特殊的或机会性感染难以解释的病例要考虑淋巴瘤的可能,若条件允许,应尽早行CT引导下肺穿刺活检或胸腔镜甚至开胸手术获取病理学依据,以免漏诊、误诊。
