吉氏巴贝斯虫多个GPI锚定蛋白基因的筛选与生物信息学分析
2019-12-16战雪燕赵阳楠罗晓莹李慕晓安晓梦敖阳思琦赵俊龙
战雪燕,聂 政,赵阳楠,罗晓莹,李慕晓,安晓梦,敖阳思琦,崔 杰,王 森,贺 兰,赵俊龙
(华中农业大学动物医学院,武汉430070)
吉氏巴贝斯虫是一种寄生于犬红细胞内的血液原虫,主要传播媒介是长角血蜱。犬感染后主要表现为贫血、发热,严重时会产生血红蛋白尿甚至死亡。吉氏巴贝斯虫的虫体在顶复门原虫中相对较小,大小约1μm×3 μm。虫体一般在红细胞边缘呈单个存在,也有多个同时存在的现象,其中多数呈环形[1]。自1910年吉氏巴贝斯虫首次在印度被发现后,随后在澳大利亚、亚洲甚至欧洲国家相继被报道[2,3]。研究表明,吉氏巴贝斯虫可以通过蜱虫传播、血液接触传播和胎盘传播[4,5]。
1985年,我国南京市首次报道犬感染巴贝斯虫[6,7]。目前,犬巴贝斯虫在我国呈广泛性流行。韦氏巴贝斯虫主要流行于浙江省、广东省和重庆市等地区,而犬巴贝斯虫和吉氏巴贝斯虫主要分布于江苏省、河南省和安徽省等地[8]。2017年贺兰等[9]报道了吉氏巴贝斯虫武汉株,并提供18s rRNA和ITS基因序列等分子生物学证据,从进化角度证实犬巴贝斯虫在武汉市的流行。
寄生虫的表面蛋白质是宿主-寄生虫相互作用中宿主免疫应答的主要靶标,是疫苗开发的理想候选者,寄生虫的表面抗原是亚单位疫苗的合理靶标。在顶复门原虫中,已经被鉴定的表面抗原包括多种糖基化磷脂酰肌醇(glycosylphosphatidylinositol,GPI)锚定相关蛋白,例如疟原虫的MSP家族[10,11]、弓形虫的SAG家族等[12]。巴贝斯科中也鉴定出多个GPI锚定蛋白,例如田鼠巴贝斯虫鉴定出19个GPI锚定蛋白,牛巴贝斯虫鉴定出17个GPI锚定蛋白[13,14],而犬巴贝斯虫同样存在GPI锚定蛋白如Bc28家族等[13]。GPI锚定蛋白序列的N端都有一个疏水的信号肽,指导蛋白共翻译并插入内质网,C端包含1个GPI锚定位点,指导GPI的附着作用,在共翻译插入内质网膜期间,C末端疏水区被转酰胺酶复合物识别,同时去除疏水区并用预先合成的GPI锚代替[15]。GPI的主要结构包括一个肌醇、N-乙酰氨基葡萄糖以及通常经由磷酸乙醇胺与蛋白质的C末端连接的3个甘露糖基团。GPI锚定蛋白的亲水性比较强,因此也是很好的疫苗候选因子和药物靶标。
吉氏巴贝斯虫对宠物的危害严重。国内外学者在病原学、流行病学、分子生物学以及诊断学等方面均对吉氏巴贝斯虫进行了大量的研究。研究表明有一类通过GPI锚定在吉氏巴贝斯虫表面的蛋白,这类蛋白暴露在虫体表面,可中和宿主体内的抗体,因此是很好的候选诊断标识疫苗因子。目前已报道的吉氏巴贝斯虫表面抗原包括BgP22、BgP32、BgP47、BgP50等,但仅限于ELISA检测应用。虽然BgP50具有免疫保护性作用,但是并未被深入研究[16-18]。
本研究通过对NCBI、PiroplasmaDB的搜索,获得吉氏巴贝斯虫GPI锚定相关蛋白基因序列,运用生物信息学的方法预测每个GPI锚定相关蛋白的性质,包括分子量、等电点、氨基酸残基组成、疏水性、跨膜区、亚细胞定位以及同源性分析等,为此相关研究提供理论依据,并为开发敏感性、特异性和高度自动化的吉氏巴贝斯虫病诊断方法提供潜在的检测标识。
1 材料与方法
1.1 吉氏巴贝斯虫GPI锚定相关蛋白基因的搜索以及确定运用NCBI(https://www.ncbi.nlm.nih.gov/)、Uniprot(http://www.uniprot.org/)以及PiroplasmaDB(http://piroplasmadb.org/piro/)等数据库,确定田鼠巴贝斯虫以及牛巴贝斯虫GPI锚定相关蛋白基因序列及其氨基酸序列,然后使用生物信息学的方法对吉氏巴贝斯虫的基因库进行搜索,从而确定吉氏巴贝斯虫GPI锚定相关蛋白的基因序列。将得到的蛋白序列使用bigPI(http://mendel.imp.ac.at/gpi/plant_server.htm),PredGPI(http://gpcr.biocomp.unibo.it/predgpi/),GPI-SOM(http://gpi.unibe.ch/)预测GP锚定位点,证实其确实是GPI锚定蛋白。
1.2 GPI锚定相关蛋白性质的预测分析利用ExPASy-PortParam (https://web.expasy.org/protparam/)网站对相关蛋白的分子量、氨基酸组成、等电点以及消光系数等基本理化性质进行分析;利用ExPASy-ProtScale (https://web.expasy.org/protscale/)选择Hphob./Kyte&Doolittle法对其疏水性进行分析;通过TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)网站分析其跨膜区;SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)网站可以预测其信号肽;使用TargetP (http://www.cbs.dtu.dk/services/TargetP/)对蛋白进行亚细胞定位;通过DNASTAR分析其B淋巴细胞抗原表位;使用motif scan网站对蛋白修饰位点进行预测。
2 结果
2.1 GPI锚定相关蛋白基因的检索以及序列分析首先在PiroplasmaDB网站中搜索到田鼠巴贝斯虫的19个GPI锚定蛋白以及牛巴贝斯虫的17个GPI锚定蛋白基因。分别使用不同的GPI锚定蛋白氨基酸序列与NCBI数据库上公布的吉氏巴贝斯虫蛋白质组数据库进行比对(表1),然后将其与武汉株吉氏巴贝斯虫基因组序列作比较,最终得到5个潜在GPI锚定相关蛋白基因序列,分别命名为BgP50-WH、BgP47-WH、BgP45-WH、BgP32-WH和BgP12-WH,经过网站预测证实为GPI锚定蛋白(表1、2),氨基酸序列如图1。
2.2 GPI锚定相关蛋白的理化性质(以BgP50-WH为例)
2.2.1 基本理化性质 通过ExPASy-PortParam工具发现,BgP50-WH共有471个氨基酸(图1),分子质量为50.616 kDa,等电点为8.92,富含丙氨酸Ala、Leu、Val、Lys等氨基酸,蛋白分子式为C2272H3590N596O678S16。在体外哺乳动物的网织红细胞内半衰期是30 h,而脂肪指数是80.62,不稳定系数为21.21,由此可视为稳定蛋白。平均亲水系数是-0.122,可视为亲水性蛋白质。

表1 NCBI数据库中吉氏巴贝斯虫GPI锚定蛋白Table 1 GPI-anchored protein of Babesia gibsoni in the NCBI database

表2 武汉株吉氏巴贝斯虫GPI锚定蛋白预测结果Table 2 Predicted GPI-anchored proteins of Babesia gibsoni from Wuhan
2.2.2 疏水性分析 通过ExPASy-ProtScale,选择Hphob./Kyte&Doolittle法对其疏水性进行分析,分析结果见图2,蛋白整体亲水性较强。
2.2.3 跨膜区分析 跨膜区指的是蛋白氨基酸序列中跨越细胞膜的区域,α-螺旋结构最为常见,约20~25个氨基酸残基。构成跨膜区的蛋白质氨基酸大部分是疏水性氨基酸。若蛋白质序列含有跨膜区,提示其作用可能为膜受体,也可视为在生物膜上的锚定蛋白或者离子通道蛋白。蛋白质跨膜区域的分析常采用TMHMM软件进行,它对于可溶性蛋白和膜蛋白的预测结果更为准确。经过预测,该蛋白有两个跨膜区。
2.2.4 信号肽预测 对蛋白质进行信号肽的预测通常使用SignalP 4.1 server,该网站主要针对革兰氏阳性菌、革兰氏阴性菌和真核生物,而吉氏巴贝斯虫属于真核生物,因此结果具有很大的可靠性。C-score为信号肽剪切位点分值,S-score为信号肽位点分值,Y-score为综合位点剪切分值。结果显示,C-score、S-score值、Y-score三值波动幅度较大,且三值均有突出值,其切割位点在第19个和第20个氨基酸之间,判断该蛋白有信号肽。

图1 吉氏巴贝斯虫GPI锚定蛋白氨基酸序列Fig.1 Amino acid sequence of GPI-anchored protein from Babesia gibsoni
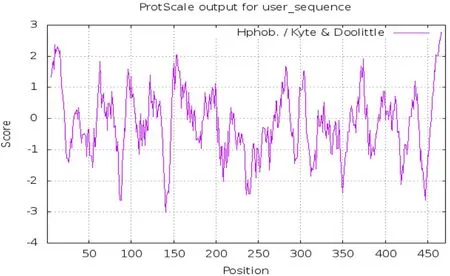
图2 BgP50亲水性/疏水性分析Fig.2 Hydrophilicity/Hydrophobicity analysis of BgP50-WH
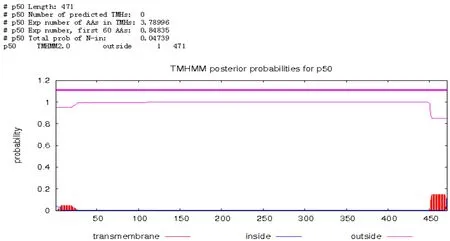
图3 BgP50-WH跨膜区分析Fig.3 Transmembrane region prediction of BgP50-WH

图4 BgP50-WH信号肽分析Fig. 4 Signal peptide prediction of BgP50-WH
2.2.5 亚细胞定位 预测真核蛋白亚细胞定位通常使用TargetP,经过预测,该蛋白的SP值为0.875,结果与信号肽预测一致,即可能分泌到细胞质或者细胞外。

图5 BgP50-WH亚细胞定位预测Fig. 5 Subcellular localization prediction of BgP50-WH

表3 BgP50-WH的B淋巴细胞抗原表位氨基酸序列Table 3 Position and sequences of potential B cell antigen epitopes
2.2.7 修饰性位点预测 蛋白修饰位点预测通常使用motif scan网站,将BgP50氨基酸输入网站后,结果显示BgP50氨基酸序列存在酪蛋白激酶2磷酸化位点10个,N-酰化位点5个,蛋白激酶c磷酸化位点6个,N-糖基化位点2个(表4)。
3 讨论
GPI锚定蛋白在顶复门原虫入侵及其在生物体内生存过程中具有重要的作用。GPI锚定蛋白最终被转运到细胞表面并且经常参与识别、粘附和转运过程[19]。在疟原虫中,GPI锚定蛋白主要为MSP家族,CSP蛋白和MSP-1、MSP-2蛋白是主要研究对象,它们具有高度变异性以及很好的免疫原性[10,11]。弓形虫中GPI锚定蛋白的主要研究对象为SAG家族,SAG1在虫体入侵前起黏附作用。研究表明带有SAGs基因的腺病毒免疫小鼠可抑制弓形虫入侵[12],运用SAG1建立的ELISA方法用于检测弓形虫感染在临床上取得了很好的效果[20,21]。牛巴贝斯虫中主要研究集中于VMSA家族基因,它在子孢子和裂殖子时期都有表达。魏金龙等[22]结合国内外研究总结出VMSA家族对虫体入侵红细胞具有重要作用。体外抑制试验发现,VMSA家族基因对牛巴贝斯虫入侵起到中和作用[13,23]。研究人员采用MSA-2c建立了ELISA方法,并成功用于临床检测[24]。对田鼠巴贝斯虫GPI锚定蛋白的研究发现,BmGPI12对其抗体具有高度亲和力,在所有田鼠巴贝斯虫GPI锚定蛋白中灵敏性和特异性最高,有望成为新的检测标识以及药物靶标[25]。犬巴贝斯虫(Babesia canins)Bc28多基因家族至少包含Bc28. 1和同源Bc28. 2基因,两个基因相对保守,作为裂殖子表面基因起着至关重要的作用[26-28]。由此可见,巴贝斯虫GPI锚定蛋白是巴贝斯虫入侵宿主红细胞重要分子之一,同样也是诊断抗原及疫苗研制的重要候选分子之一。目前对于吉氏巴贝斯虫尚未有相关GPI锚定蛋白的报道,但早在多年前P50便作为虫体表面蛋白被报道,是血清学诊断的重要分子之一,可以有效检测出实验犬感染后d8的IgG。吉氏巴贝斯虫面临的一个很重要的难题在于感染早期的虫体检测。临床上常采用血涂片对吉氏巴贝斯虫进行检测,但这种方法敏感性低,早期感染阶段无法检出。PCR、间接免疫荧光检测以及ELISA检测技术的特异性和灵敏性不稳定,适用范围有限。杨其清等[29]使用截短BgTRAP作为诊断抗原初步建立的ELISA,为研发相关试剂盒提供了一定的理论基础,但仍然需要开发通用的抗原进行早期IgM检测,达到早发现、早治疗的目的[9,30-33]。
目前关于巴贝斯虫GPI锚定蛋白的研究相对较少,不同巴贝斯虫GPI锚定蛋白不仅数量不同,并且没有相似的结构域,导致不同种属的巴贝斯虫GPI锚定蛋白命名混乱,给科研以及搜索造成了不同程度的困难。与传统方法相比,生物信息学具有高效、低成本的优点,在预测蛋白质结构、功能和其他生物学特性方面变得越来越重要。本研究使用多种生物信息学的方法对NCBI上吉氏巴贝斯虫基因进行筛选。最终确定5个GPI锚定相关蛋白,分别命名为BgP50-WH、BgP47-WH、BgP45-WH、BgP32-WH和BgP12-WH。这5个GPI锚定蛋白均含有信号肽、跨膜区以及含有较多的抗原表位。B淋巴细胞抗原表位预测在诱导GPI锚定蛋白获得免疫性应答中起到非常重要的作用。通过生物信息学技术预测未知蛋白的免疫原性,并鉴定适合于疫苗开发的抗原表位具有非常重要的应用价值。在后续研究中发现BgP47-WH,BgP50-WH与抗体亲和力较强,有望成为新的诊断标识。本研究确定的5个GPI锚定蛋白很有可能成为检测吉氏巴贝斯虫的特异性诊断抗原,并为阻止吉氏巴贝斯虫的入侵提供了药物靶标和疫苗候选因子。

图6 BgP50-WH抗原表位预测Fig. 6 Potential B cell antigen epitopes prediction of BgP50-WH

表4 BgP50-WH氨基酸序列修饰位点的预测结果Table 4 Post-translational modification (PTM) sites of the putative BgP50-WH
