绵羊MAVS基因的原核表达及多克隆抗体的制备
2019-12-16董丹丹缪秋红刘光清
董丹丹,刘 腾,缪秋红,朱 杰,刘光清
(中国农业科学院上海兽医研究所,上海200241)
MAVS(mitochondrial antiviral signaling protein)又称IPS-1(interferon-Β)[1]、VISA(virus-induced signaling adaptor)[2]、Cardif(CARD adaptor inducing interferon-Β)[3]。MAVS在天然免疫中至关重要,主要介导下游 NF-κB 等因子的激活以应对病毒感染。人源MAVS的mRNA含有两个剪接体,长度分别为3.4 kb和9.5 kb。MAVS含有540个氨基酸,可分为三部分:N端CARD样结构域(半胱天冬酶募集结构域caspase recruitment domain)、脯氨酸富集结构域和C端的跨膜结构域[4]。Seth等[5]2005年首次证实MAVS可以介导由病毒感染引起的NF-kappaB和IRF3的激活,从而诱导机体的免疫应答,并进一步证明NF-kappaB和 IRF 3的磷酸化需要MAVS。Moore等[6]2008年证实NLRX1可以拮抗MAVS介导的机体免疫应答。
小反刍兽疫病毒是由PPRV引起的一种急性、高传染性疾病,主要感染绵羊和山羊[7]。由于小反刍兽疫对养殖业产生了巨大的经济损失,现已成为全球根除目标之一[8]。为了进一步研究MAVS能否应对PPRV引起的病毒感染,本研究对绵羊MAVS基因进行克隆并构建原核表达载体,通过纯化蛋白并免疫小鼠制备抗MAVS基因的多抗,为进一步研究MAVS与PPRV之间的相互作用奠定基础。
1 材料和方法
1.1 质粒和菌株感受态细胞DH5α、BL21购自北京全式金生物技术有限公司;原核表达载体pET-32a、真核表达载体pCMV-myc及绵羊肺细胞由本实验室保存。
1.2 主要试剂LATaq聚合酶、胶回收试剂盒购自TaKaRa公司;pMD19T载体、SolutionⅠ连接酶、XhoⅠ和EcoR V限制性内切酶购自NEB公司;质粒小提试剂盒购自 AXYGEN 公司;抗His 标签鼠单克隆抗体购自北京康为世纪公司;ECL化学发光试剂盒购自 Thermo 公司;其余试剂均为分析纯。
1.3 羊MAVS基因的克隆根据NCBI数据库中MAVS基因序列(登录号:XM_015099722.1)设计PCR引物,上游引物MAVS-F:5'-GATATCATGACGTT TGCCGAGGACAGA-3'(下划线部分为EcoR V 酶切位点),下游引物MAVS-R:5'-CCGCTCGAGT CACTGGGGTAGGCGCCGCCGGTACAG-3'(下划线部分为XhoⅠ 酶切位点),产物长度为1569 bp,共编码523个氨基酸。引物由上海华津科技有限公司合成。
利用Trizol法提取绵羊肺细胞的总RNA,经反转录获得cDNA,以此为模板扩增MAVS基因。将扩增产物纯化后连接至pMD19-T 载体,将连接产物转化至DH5α感受态细胞,挑取阳性克隆测序。
PCR反应体系:模板 DNA(50 ng/ μL)2 μL,ExTaqMix 25 μL,上下游引物(10 mmol/L)各2 μL,补加灭菌蒸馏水至50 μL。PCR扩增条件:95℃预变性3 min;95℃变性30 s,56℃退火45 s,72℃延伸1 min 45 s,34 个循环;72℃再延伸5 min。
1.4 原核表达重组质粒的构建与鉴定将成功连接pMD19-T 载体并测序正确的菌液扩大培养,经质粒小提试剂盒提取质粒。将质粒进行双酶切后连接至原核表达载体pET-32a及真核表达载体pCMV-myc,菌液鉴定后送去测序。
1.5 重组质粒的原核表达将pET-32a-MAVS转化至BL21感受肽细胞,经抗性筛选后挑取单个菌落于氨苄抗性LB中,37℃ 220 r/min摇床培养至OD600为0.6~0.8,加入终浓度为1.0 mmol/L IPTG,然后置于16℃摇床继续震荡培养20 h。将菌液离心后,分别取上清和沉淀进行SDS-PAGE电泳。
1.6 目的蛋白的纯化扩大培养的菌液经IPTG诱导20 h后离心,弃上清液,用PBS洗涤沉淀,室温离心30 min后再次弃去上清,用PBS将沉淀重悬后-80℃反复冻融3次。将菌液进行超声破碎,工作电压为300 V,工作 5 s,间隔 9 s,超声至菌液不黏稠。将菌液反复冻融3次,离心后弃上清。用含2 mol/L尿素的Tris缓冲液(50 mmol/L Tris-HCL、10 mmol/L EDTA、100 mmol/L NaCL、0.5% Triton X-100,pH 8.0)洗涤包涵体,10 000×g离心30 min后弃上清,重复操作 2 次。洗涤沉淀,10 000×g离心30 min后弃上清,重复2次。用含8 mol/L尿素的Tris缓冲液溶解沉淀(4 mL/g),4℃过夜,次日12 000×g离心10 min,将上清加入透析袋中,分别用含6、5、4、3、2 mol/ L尿素进行梯度复性[9]。
1.7 羊MAVS多克隆抗体的制备用纯化的MAVS重组蛋白免疫6周龄BALB/ c SPF 雌鼠,首免时将弗氏完全佐剂与蛋白混匀后多点皮下注射小鼠背部,免疫剂量为50 μg/只。2周和4周后分别进行二免和三免,将弗氏不完全佐剂与蛋白混匀后多点皮下注射小鼠背部,免疫剂量同上。三免7 d后眼眶采血并分离血清。
1.8 多克隆抗体特异性检测将真核表达质粒 pCMV-myc-MAVS转染CV细胞,48 h后收集蛋白样品,100℃煮样10 min后进行SDS- PAGE 电泳,转印至PVDF膜上,然后用5%脱脂乳室温封闭2 h,以制备的多抗(1∶200)作为一抗,以HRP标记的山羊抗鼠IgG(1∶10000)作为二抗进行Western blot检测。
2 结果
2.1 MAVS基因的克隆提取绵羊肺细胞RNA并将其反转录后作为模板,成功扩增出MAVS基因,大小约1569 bp(图1),与预期条带大小相符,经测序后确认无碱基突变。
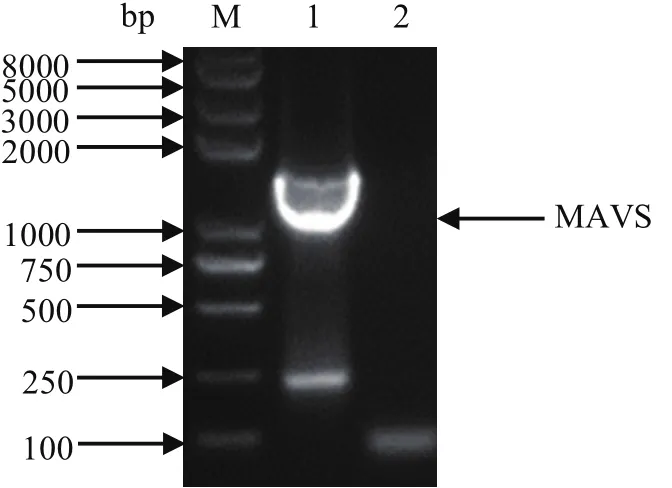
图1 MAVS基因的 PCR 扩增Fig.1 Amplification results of MAVS
2.2 重组表达质粒的鉴定pET-32a-MAVS 经EcoR V 和XhoⅠ双酶切,电泳结果显示有两条特异性条带,分别为载体和目的基因(图2),表明MAVS基因插入到原核表达载体pET-32a中,测序结果显示无碱基突变。
2.3 MAVS蛋白鉴定及可溶性分析SDS-PAGE电泳结果表明,重组质粒pET-32a -MAVS转化至BL21感受态细胞后,经IPTG诱导成功表达目的蛋白,MAVS融合蛋白大小为95 kDa(图 3A),与预期相符。未诱导的重组质粒及诱导的空载体质粒无目的蛋白表达。Western blot显示MAVS重组蛋白主要以包涵体形式表达(图 3B)。
2.4 重组MAVS蛋白多克隆抗体的 Western blot分析转染真核表达质粒pCMV-myc-MAVS,48 h后收取细胞裂解液进行Western blot,将制备的多克隆抗体作为一抗。结果显示95 kDa处出现目的条带,表明制备的抗体可与 MAVS蛋白反应,并具有良好的特异性(图4)。

图2 重组表达质粒 pET-32a-MAVS的双酶切鉴定Fig.2 Identification of recombinant plasmid pET-32a-MAVS digested with double enzymes

图3 MAVS 蛋白鉴定及可溶性分析Fig.3 Identification and soluble analysis of MAVS protein

图4 纯化的 MAVS重组蛋白分析Fig.4 Purified MAVS recombinant protein
3 讨论
MAVS是线粒体外膜上的一种接头蛋白,可激活天然免疫信号通路并诱导干扰素表达, 参与抗病毒免疫反应。当RNA病毒感染细胞后,胞质中的RIG I受体可识别并结合MAVS,促使其发生寡聚化,产生I型干扰素及促炎性细胞因子。虽然MAVS在抗病毒天然免疫中发挥至关重要的作用,但病毒也会形成各种各样的拮抗机制[10]。研究表明,汉坦病毒的糖蛋白片段能阻止IRF3磷酸化,进而抑制RIG I/MAVS/TBK1/TRAF3信号通路,通过减少IFNβ的产生使其在人内源细胞中成功复制[11]。丙肝病毒的NS3/4A可将MAVS切割,使其不能激活下游信号,从而阻断RLR介导的信号通路[12,13]。甲肝病毒3ABC(3Cpro 半胱氨酸蛋白酶的前体)及乙肝病毒X 蛋白HBX 也可裂解MAVS,从而阻断信号转导。由此可见,MAVS在抗病毒免疫反应中起着关键作用,深入研究MAVS的功能有助于了解宿主与病毒的相互作用机制。
本研究成功制备了反应良好的羊MAVS多克隆抗体,为研究其生物学功能及小反刍兽疫病毒的致病机制提供了平台,也为深入研究相关的免疫信号通路,以及小反刍兽疫病毒逃逸宿主天然免疫的机制研究打下基础。
