敲除RIG-I基因的PK-15细胞系的建立及RIG-I对猪圆环病毒2型感染的作用
2019-12-16黄立平邵玉乐夏德利曾为俊鲁国涛刘长明陈洪岩王金泉孟庆文
许 曼,黄立平,邵玉乐,夏德利,曾为俊,王 辉,鲁国涛,刘长明,陈洪岩,王金泉,孟庆文
(1.新疆农业大学动物医学学院,乌鲁木齐830052;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室 黑龙江省实验动物与比较医学重点实验室,哈尔滨 150069)
CRISPR/Cas9基因编辑技术操作简单,定位准确,已被广泛使用。相较于锌指核酶(zinc-finger nucleases,ZFN)技术、类转录激活因子效应物核酸酶(transcription activator-like effector nuclease,TALEN)技术,CRISPR/Cas9系统编辑效率更高,且靶基因限制仅要求于靶位点处有NGG碱基,更易于对基因组进行编辑操作。目前,CRISPR/Cas9系统在功能基因组学、遗传修饰动物模型揭示病原感染的天然免疫应答机制等领域取得了重要进展。
猪圆环病毒2型(Porcine circovirus type 2,PCV2)感染可造成宿主免疫系统损伤,导致机体免疫功能抑制和持续性感染,引发猪圆环病毒相关疾病(porcine circovirus disease,PCVAD)[1]。宿主通过特定模式识别病毒的入侵,激活相关信号通路,进而诱导干扰素(interferon,IFN)、炎症相关因子及趋化因子的生成,以发挥抗病毒作用。PCV2感染可激活TLR2、TLR3、TLR9等模式识别受体,启动天然免疫应答[2]。同时,PCV2也进化出多种策略来逃逸宿主的抗病毒天然免疫[3-5]。
视黄酸诱导基因I(retinoic acid-inducible gene-I,RIG-I)是细胞内病毒RNA传感器,能够识别多种病毒复制产生的双链RNA(doublestrand RNA,dsRNA)和5'-三磷酸基团的单链RNA(5'-ppp ssRNA),可通过多种途径发挥抗病毒作用[6]。Sato等[7]证明RIG-I可识别乙肝病毒(Hepatitis B Virus,HBV)前基因组RNA,诱导III型干扰素产生,抵消病毒聚合酶与前基因组RNA的相互作用,抑制病毒感染。单纯疱疹病毒(Herpes simplex virus,HSV-1)感染后,RIG-I上调表达STING促进IFN的持续表达来增强抗病毒状态[8]。作为DNA病毒的PCV2也能被RIG-I识别。Cheryl等[9]发现PCV2感染可增强RIG-I、IRF7信号途径相关基因的表达。RIG-I识别PCV2感染后通过何种途径发挥抗病毒作用还有待进一步研究。
本研究利用CRISPR/Cas9系统成功构建了1株稳定敲除RIG-I基因的PK-15细胞株,通过PCV2感染,分析RIG-I及其下游分子mRNA水平和病毒复制增殖水平,探讨RIG-I对PCV2感染的作用,为PCV2感染的致病机制和防控研究提供良好的细胞模型和研究方向。
1 材料与方法
1.1 病毒、细胞株和质粒PCV2/LG株(GenBank登录号:HM038034)由中国农业科学院哈尔滨兽医研究所分离和保存,病毒半数组织培养感染量为1×106.0TCID50/mL;PK-15细胞由本实验室保存;pCAG-Cas9-EGFP质粒、pUC19-sgRNA质粒由本实验室保存。
1.2 试剂ExTaqDNA聚合酶、DNA Marker、PrimeScriptTMRT Master Mix、SYBR Green Master Mix均购自TaKaRa公司;TaqMaster Mix购自abm公司;质粒提取试剂盒、DNA纯化及胶回收试剂盒、病毒DNA提取试剂盒购自OMEGA公司;各种限制性内切酶和T4 DNA连接酶购自New England Biolabs公司;DMEM培养基和胎牛血清购自Gibco公司;Poly JetTMReagent购自SignaGen公司;β-actin抗体、RIG-I抗体购自OmnimAbs公司;IRDye®标记的羊抗鼠IgG、羊抗兔IgG购自LI-COR公司;CCK-8试剂盒购自Biosharp公司。
1.3 构建敲除RIG-I基因的PK-15细胞系
1.3.1 sgRNA设计和寡核苷酸链合成 在GenBank中检索猪RIG-I基因的外显子序列,序列符合5'-GN19NGG-3',利用设计软件(http://crispr.mit.edu)在RIG-I基因第1外显子设计、合成2对sgRNA(表1)。在正义链模板5'端添加CCGG,可与BbsI酶切后形成的黏性末端互补;反义链模板5'端添加AAAC,与BbsI酶切后形成的黏性末端互补。

表1 RIG-I-sgRNA寡核苷酸序列Table 1 The oligo sequences of RIG-I-sgRNA
1.3.2 pUC19-RIG-I-sgRNA载体构建BbsI内切酶线性化pUC19-sgRNA质粒,按照Gel Extraction Kit说明书胶回收酶切产物,并与退火成双链的sgRNA连接、转化,测序正确后提取质粒,命名为pUC19-RIG-I-sgRNA1和pUC19-RIG-I-sgRNA2。
1.3.3 细胞培养和转染 按常规方法将PK-15细胞传代,当细胞密度达到70%~80%时,采用PolyJetTMReagent方法将pUC19-RIG-I-sgRNA1、pUC19-RIG-I-sgRNA与pCAG-Cas9-EGFP质粒共转染至PK-15细胞。
1.3.4 筛选敲除RIG-I基因的PK-15细胞株 转染后36~48 h,流式分选表达增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的单个细胞于96孔板中。1周后,取部分细胞,按照Tissue DNA Kit说明书提取基因组DNA进行PCR 鉴定,初步筛选敲除RIG-I基因的PK-15细胞。选择疑似敲除的细胞基因组DNA经测序引物(RIG-I-L)进行PCR扩增后,测序分析,引物序列见表2。提取细胞总蛋白,经SDS-PAGE电泳后转膜、封闭,分别与RIG-I(1∶800)和β-actin(1∶1000)抗体进行孵育,洗膜,孵育二抗(1∶15 000)后,红外荧光扫描仪扫膜,筛选稳定敲除RIG-I基因的PK-15细胞株。
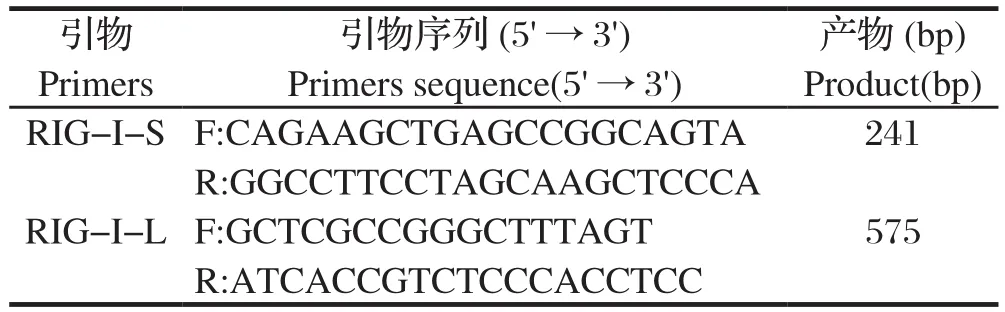
表2 靶位点鉴定引物Table 2 The primers to identify target site
1.3.5 敲除RIG-I基因的PK-15细胞生长曲线 将野生型(PK-15-WT)及敲除RIG-I基因的PK-15细胞(PK-15-RIG-I-/-)按2000个细胞/孔铺于96孔板中,并设立对照孔,放置于37℃,5% CO2条件下培养。利用CCK-8试剂盒检测,采用GraphPad Prisms软件绘制生长曲线。
1.4 病毒感染及相关因子的检测
1.4.1 接种PCV2 待细胞融合度为70%~80%,以接毒量为MOI=0.5,将PCV2分别接种于PK-15-RIG-I-/-和PK-15-WT细胞,37℃孵育2 h后,弃病毒液,PBS洗2遍,更换为含2%胎牛血清的培养基,继续于37℃、5% CO2的条件下培养。分别于感染后第6、12、24、48、72 h收集细胞,用于提取细胞总RNA与病毒DNA。
1.4.2 RIG-I、MAVS、STING、IFN-β、IRF3 mRNA水平的real-time PCR分析 提取细胞总RNA,将提取的RNA反转录成cDNA。RIG-I、MAVS、STING、IFN-β、IRF3引物见表3,以GAPDH 为内参基因进行real-time PCR检测,反应程序按照说明书设置。采用2-△△Ct分析方法计算基因的相对表达量。

表3 Real-time PCR引物Table 3 Primers of real-time PCR
1.4.2 IPMA方法检测病毒感染细胞数 分别于感染后第6、12、24、48、72 h收集细胞,用预冷的无水甲醇固定20 min,PBS洗3次;加入PCV2一抗阳性血清(1∶1000),37℃孵育1 h,PBS洗3次;加入PCV2二抗HRP标记的葡萄球菌A蛋白(1∶100),37 ℃避光孵育1 h,PBS洗3次;加入AEC显色液室温摇床避光显色20 min,PBS洗2次,倒置荧光显微镜观察,并计数感染的阳性细胞数。
1.4.3 TaqMan定量PCR检测病毒基因拷贝数 提取病毒DNA,根据PCV2基因组设计并合成引物和探针,引物序列:PVC2-F:5'-TGGGGCCACCTGG GTGTG-3',PVC2-R: 5'-GCCAAAAAAGGTA CAGTTCCACC-3';探针:6FAM-AGCAAATG GGCTGCTAATTTTGCAGAC-MRA,由南京金斯瑞生物科技公司合成。反应按说明书进行,以PCV2全基因组质粒pMD18-LG作为该TaqMan定量PCR方法的标准品,10倍梯度稀释并制备8个标准品(1.42×1010copies~1.42×103copies),荧光定量PCR仪扩增并分析结果。
1.5 统计学分析用Graphpad Prism 6统计学软件进行数据分析,*P<0.05表示差异具有显著性统计学意义,**P<0.01表示差异具有极显著统计学意义。
2 结果
2.1 pUC19-RIG-I-sgRNA载体的构建合成的sgRNA寡核苷酸单链通过退火形成双链,与线性化的pUC19-sgRNA质粒连接、转化,挑取单克隆送至吉林库美公司测序,测序结果表明pUC19-RIGI-sgRNA1和pUC19-RIG-I-sgRNA2载体构建成功(图1)。

图1 pUC19-RIG-I-sgRNA1、sgRNA2双质粒测序结果Fig.1 Sequencing results of pUC19-RIG-I-sgRNA1,sgRNA2 recombinant vector
2.2 pCAG-Cas9-EGFP和pUC19-RIG-I-sgRNA双质粒共转染PK-15细胞转染前12 ~24 h,铺六孔板,正常培养PK-15细胞至密度为70%~80%,将pCAGCas9-EGFP 和pUC19-RIG-I-sgRNA双质粒共转染PK-15细胞,24~48 h后在荧光显微镜下观察。与对照组相比,转染组的PK-15细胞表达绿色荧光(图2D),表明质粒转染PK-15细胞成功。
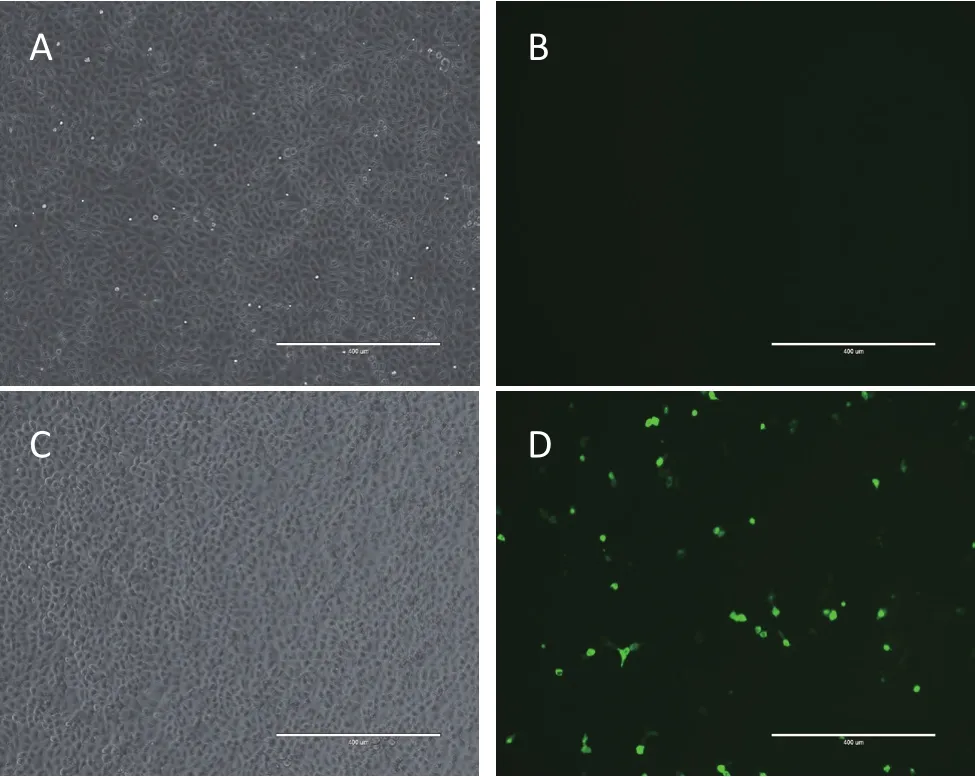
图2 pCAG-Cas9-EGFP、pUC19-RIG-I-sgRNA双质粒共转染PK-15细胞Fig.2 PK-15 cells co-transfected with pCAG-Cas9-EGFP and pUC19-RIG-I-sgRNA double plasmid
2.3 稳定敲除RIG-I基因的PK-15细胞株筛选采用流式细胞仪分选表达EGFP的单细胞至96孔板。1周后提取细胞基因组DNA,进行PCR扩增,非变性聚丙烯酰胺凝胶电泳检测扩增结果。结果显示6#为疑似敲除细胞(图3A)。通过克隆测序,确认6#细胞在sgRNA靶点处缺失37个碱基(图3B)。将6#细胞形成的细胞集落进行Western blot检测,筛选到1株不表达RIG-I蛋白的PK-15细胞(图3C),命名为PK-15-RIG-I-/-。
2.4 PK-15-RIG-I-/-细胞与PK-15-WT细胞增殖速度比较采用CCK-8法分别检测两种细胞的增殖速度,绘制生长曲线。结果显示,PK-15-RIG-I-/-细胞与PK-15-WT细胞的增殖速度之间的差异不具备显著统计学意义(图4)。
2.5 Real-Time PCR法检测RIG-I mRNA水平PCV2感染PK-15-WT细胞,提取细胞总 RNA,real-time PCR检测细胞中RIG-I mRNA水平。结果显示,与mock组相比,PCV2感染48 h和72 h后RIG-I mRNA表达水平上调(图5),表明PCV2感染可激活RIG-I。
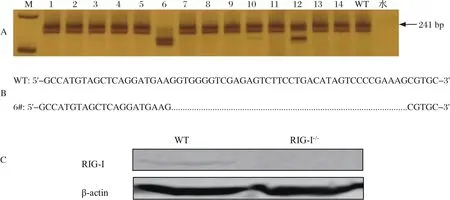
图3 敲除RIG-I基因的PK-15细胞鉴定结果Fig.3 Identification results of PK-15 cells with RIG-I gene knock-out

图4 PK-15-WT及PK-15-RIG-I-/-细胞生长曲线Fig.4 Grouth curve of PK-15-WT and PK-15-RIG-I-/- cells

图 5 PCV2 感染后 PK-15 细胞中 RIG-I 的 mRNA 变化Fig.5 mRNA levels of RIG-I in PK-15 cells after PCV2 infection
2.6 MAVS、STING、IRF3 、IFN-β mRNA水平在PCV2感染PK-15-RIG-I-/-细胞中的变化PCV2感染可诱导PK-15细胞上调RIG-I表达,检测PCV2感染 PK-15-WT、PK-15-RIG-I-/-细胞中MAVS、STING、IRF3、IFN-β mRNA水平,结果显示,与PK-15-WT细胞相比,在感染48 h后,PK-15-RIG-I-/-细胞中MAVS、STING、IRF3、IFN-β的mRNA水平均显著下调;感染72 h后,MAVS、STING、IFN-β的mRNA水平显著下调(图6)。结果表明敲除RIG-I阻断了RIG-I-IFN-β信号通路,提示RIG-I可能通过MAVS/STING-IRF3信号通路刺激IFN-β产生,参与PCV2感染。
2.7 IPMA及TaqMan定量PCR方法检测敲除RIG-I对PCV2复制增殖的影响PCV2 分别感染PK15-WT、PK-15-RIG-I-/-细胞6、12、24、48、72 h后,收集细胞进行IPMA及TaqMan定量PCR检测。结果显示,与WT组相比,PK-15-RIG-I-/-细胞在感染后48 h和72 h,PCV2感染阳性细胞数显著减少(图7),病毒基因拷贝数显著减少(图8),表明敲除RIG-I可抑制PCV2在PK-15细胞中的增殖。

图6 PCV2感染后PK-15细胞中MAVS、STING、IRF3、IFN-β的mRNA变化Fig.6 mRNA levels of MAVS, STING, IRF3, IFN-β in PK-15 cells after PCV2 infection
3 讨论
基因组编辑技术是研究基因功能的重要工具,CRISPR/Cas9系统是由Cas9核酸酶和特异的sgRNA构成的新型基因编辑技术,可实现目标基因位点敲除、敲入及定点突变等多种基因编辑。Cong等[10]和Mali等[11]利用CRISPR/Cas9系统分别在293T细胞、K562细胞和iPS细胞中实现了基因敲除。本研究利用CRISPR/Cas9系统构建1株PK-15-RIG-I-/-细胞株,其增殖速度与PK-15-WT无显著差异,可以用于RIG-I信号通路及病原微生物作用机制研究。
张新晨等[12]研究表明PCV2感染能上调RIG-I表达。PCV2是单链、环状DNA病毒,感染宿主后,可促进细胞内源性RNA的转录产物位移至细胞质,或在细胞内RNA聚合酶Ⅲ作用下合成5'-ppp dsRNA,这可能是PCV2激活RIG-I的途径[13-15]。PCV2感染PK-15 细胞48 h和72 h后,RIG-I mRNA水平升高,说明PCV2感染能够激活RIG-I。但在感染24 h内,RIG-I mRNA水平无显著变化,表明PCV2延迟了RIG-I激活。推测PCV2感染不同时间可能由不同的模式识别受体识别,DNA模式识别受体cGAS、IFI16、DAI等可能在感染前期发挥作用,而在感染后期,免疫刺激性RNA出现时可被RIG-I识别诱导天然免疫反应。
除经典的RIG-I-MAVS-IFN信号通路,RIG-I可激活定位于线粒体-内质网接触区的MAVS 和STING,诱导IFN产生发挥抗病毒作用[16]。已有研究证明PCV2通过多种信号途径诱导IFN-β的产生[17-19]。本研究敲除PK-15细胞RIG-I基因,PCV2感染后细胞内MAVS、STING、IRF3的表达受到抑制,下游IFN-β的产生显著降低,初步表明PCV2感染PK-15细胞可通过RIG-I-MAVS/STING-IRF3 信号途径诱导IFN-β 产生。

图7 IPMA法检测PCV2感染PK-15阳性细胞Fig.7 PK-15 cells detected by IPMA infected with PCV2
图8 PCV2感染野生型及RIG-I敲除PK-15细胞中病毒DNA拷贝数Fig.8 DNA copies of the PCV2 in WT PK-15 and RIG-I knock-out PK-15 cell
PCV2复制时需要先合成DNA合成前体,而体外添加IFN可增加PCV2复制时所需的DNA合成前体的产生,加强PCV2的复制[20]。分别敲低RIG-I、MDA5、STING可抑制内源性IFN-β产生,从而抑制PCV2在PK-15细胞中复制[18,19]。本研究中,敲除PK-15细胞RIG-I后,PCV2感染第48 h和72 h,病毒复制显著降低,可能由于敲除RIG-I,下游信号通路受阻导致IFN-β产生减少,表明PCV2感染后期RIG-I可能通过MAVS/STING-IRF3通路诱导IFN-β产生,促进PCV2在PK-15细胞中复制。
本研究通过CRISPR/Cas9系统构建1株PK-15-RIG-I-/-细胞,感染实验证明PCV2可能通过RIG-IMAVS/STING-IRF3信号途径诱导IFN-β产生,从而促进PCV2在PK-15细胞中的复制,但具体的作用机制仍需进行进一步探讨。
