339例非综合征型耳聋患者致病基因突变分析
2019-12-13李俎怡何蓉
李俎怡 何蓉
中国医科大学附属盛京医院临床遗传科
耳聋是最常见的感觉神经性疾病,也是常见的小儿出生缺陷之一。遗传性耳聋可分两类:非综合征型耳聋(nonsyndromic hearing loss,NSHL)和综合征型耳聋(syndromic hearing loss,SHL)。遗传性耳聋大约70%不伴有其它临床表现或疾病的为NSHL。另外大约30%伴有其它临床表现或疾病则为SHL[1]。耳聋病因复杂多变,可以由遗传基因突变引起,也可由环境因素所致,其中大约60%的耳聋与遗传因素有关[2]。耳聋病因复杂,影响因素多,且有200 余种目前已知的耳聋基因[3],虽然导致耳聋的基因多种多样,但是绝大多数遗传性耳聋只与少数几个基因突变有关。我国遗传性耳聋主要是由GJB2,SLC26A4,12SrRNA 和GJB3 耳聋基因引起[4]。经典的遗传学认为,生物的遗传信息储存在DNA 的碱基序列即一级结构中,一级结构的改变有时会导致生物产生可遗传变异。基因的遗传方式包括常染色体显性、常染色体隐性、X 隐性或者线粒体遗传[5],我国遗传性耳聋的主要致病基因中12SrRNA 基因的遗传方式为线粒体母系遗传,而GJB3 基因通常遵循常染色体显性遗传模式,而GJB2基因和SLC26A4基因确认是常染色体隐性遗传性NSHL的基础,这两种致病基因为纯合或复合突变时则被认为是由耳聋基因突变引起的NSHL,这两种致病基因为单杂合突变时则被认为是突变基因携带者。随着耳聋基因研究的深入及分子生物诊断技术的发展,遗传性聋的分子遗传学研究取得了飞速的发展,耳聋基因检测已逐渐成为常规的检测项目。
1 资料与方法
1.1 研究对象
本实验研究对象选自2013 年1 月至2018 年10月在中国医科大学附属盛京医院就诊的非综合征性耳聋患者339 例,患者大部分来自于东北地区。其中男176 例,女163 例,年龄范围从2 月-69岁,平均年龄15.42 岁,每个年龄层占比:<1 岁:1~10 岁: 10~20 岁: 20~30 岁: 30~40 岁: 40~50 岁: 50~60岁:~60岁的比例分别为62:119:27:66:48:4:6:7。经病史采集、体格检查、听力学以及影像学检查,均确诊为非综合征型感音神经性聋,均由本人或者监护人签署知情同意书。
1.2 研究方法
1.2.1 DNA提取方法
受检对象每人采集外周血5ml 备用,采用UPure Blood DNA PLUS Kit 血基因组DNA 提取试剂盒提取DNA。操作步骤如下:1.向15ml 离心管中加入5ml 全血,5mlBuffer LRBC。2.上下颠倒混匀5min,直至液体澄清透明;12000rpm 离心5min,弃上清。3.往沉淀中加入800ulBuffer LWB,用移液枪将细胞团吹打散开并全部移至另一新的2ml 离心管中。4.加入200ul BioBase Blood Beads,涡旋混匀,室温孵育10min,每2-3min涡旋混匀。5将离心管置于磁力架上静置1min后移除上清。将离心管从磁力架上取下,加入800ul Buffer LWB 清洗磁珠,涡旋混匀1min。6.重复三次步骤5 操作后,用移液器移除残留液体,将离心管置于室温处理5-10 分钟以晾干磁珠。7.将离心管从磁力架上取下,加入至少300ul 洗脱液(TE 或EL),涡旋混匀,65 度孵育10min。8.将离心管置于磁力架上,待液体彻底澄清后,将上清液转移致干净的离心管中。提取的RNA样应保存于-20度。
1.2.2 DNA测序检测
采用DNA测序技术,对4个热点耳聋基因进行检测,其中GJB2,GJB3 基因采用全基因组测序;SLC26A4,及线粒体12srRNA 基因则采用对其常见的热点突变位点SLC26A4(PDS)(IVS7-2A>G(919A>G),2168A>G),12SrRNA(A1555G,C1494T)。进行检测。按试剂盒说明书进行操作,用自带软件进行结果的判读。
2 结果
339 例患者中共检出发生耳聋相关基因突变患者114 例,总检出率为33.63%(114/339),其中66 例GJB2 基因突变(19.46%, 66/339);7 例GJB3基因突变(2.06%,7/339);39 例SLC26A4 基因突变(11.50%,39/339);4 例12srRNA 基因突变(0.88%, 4/339)。GJB2 基因检出14 个突变位点,SLC26A4 基因检出2个突变位点,GJB3基因检测出3个突变位点,12SrRNA基因检测出1个位点突变。一共有62例单杂合突变为携带耳聋致病基因的患者;30 例纯合突变,6例单杂合突变,16例复合突变,共52例为由致病基因突变致聋的患者(表1,2)。
2.1 由基因突变引起耳聋患者常见致病基因检测结果
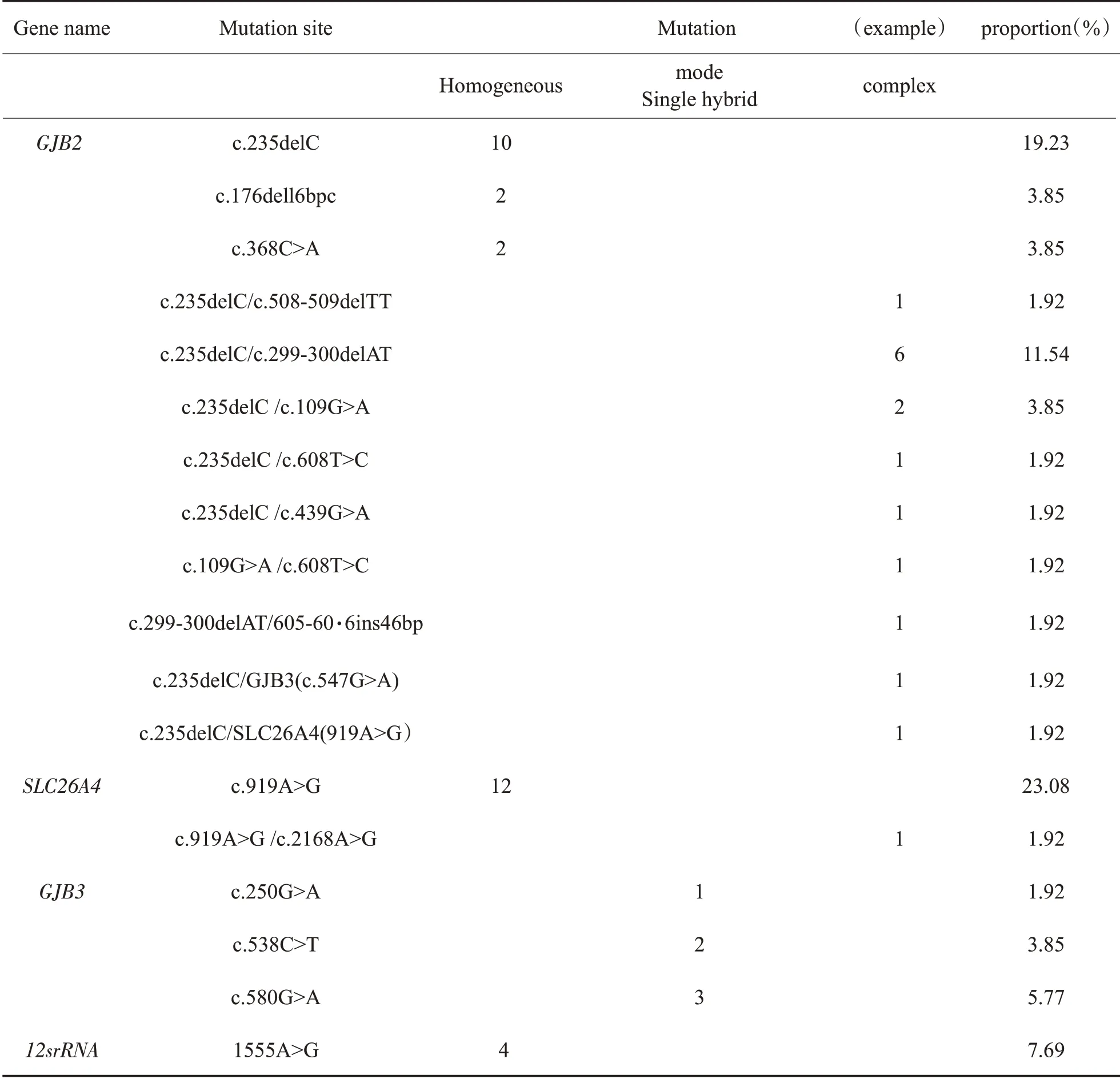
表1 52例由耳聋基因突变引起耳聋患者常见致病基因检测结果(阳性)Table 1 Detection results of common pathogenic genes in 52 patients with deafness caused by deafness gene mutation(positive)
如表1所示,339例患者中共检测出52例由基因突变引起非综合征型耳聋患者。其中29例测出由GJB2 基因突变引起的,其致病突变构成比为8.55%(29/339);13例由SLC26A4基因突变引起的,其致病突变构成比为3.83%(13/339);6 例由GJB3基因突变引起,其致病突变构成比为1.76%(6/339);4例由12SrRNA基因突变引起的,其致病突变构成比为1.18%(4/339)。在52例由基因突变引起非综合征性耳聋患者中,由GJB2 基因突变引起耳聋的比例为55.77%(29/52),由SLC26A4 基因突变引起耳聋的比例为25%(13/52),由GJB3 基因突变引起耳聋的比例为11.54%(6/52),由12SrRNA基因突变引起耳聋的比例为7.69%(4/52)。GJB2 基因包含2 种突变方式,其中纯合突变14 例,突变位点分别为c.235delC,c.176dell6bpc,c.368C>A,所占比例分别为23.08%(12/52),7.69%(4/52),7.69%(4/52);复合突变15例,突变位点为c.235delC/c.299-300delAT 6 例,所占比例为11.54%(6/52);c.235delC/c.109G>A 2例,所占比例为3.85%(2/52);突变位点为c.235delC/c.508-509delTT,c.235delC/c.608T>C,c.235delC/c.439G>A,c.109G>A/c.608T>C,c.299-300delAT/605-60·6ins46bp 均为1 例,所占比例均为1.92%(1/52);其中有两例为两个致病基因复合突变,其突变位点分 别 为GJB2(c.235delC)/GJB3(c.547G>A)1 例,所占比例均为1.92%(1/52),GJB2(c.235delC)/SLC26A4(919A>G 杂合),1 例,所占比例均为1.92%(1/52)。GJB3 基因仅有1 种突变方式,即单杂合突变,突变位点有3 个,其中由c.580G>A 突变位点引起突变的有3 例,所占比例5.57%(3/52);c.538C>T 突变位点2 例,所占比例3.85%(2/52);c.250G>A 突变位点1 例,所占比例1.92%(1/52)。SLC26A4基因包含2种突变方式,其中纯合突变12例,突变位点为c.919A>G,所占比例为23.08%(12/52);复合突变1 例,突变位点为c.919A>G/c.2168A>G 所 占 比 例 均 为1.92%(1/52)。12SrRNA 基因仅检测到1 种突变位点为1555A>G的纯合突变,所占比例均为7.69%(4/52)。

表2 62例携带耳聋致病基因患者常见致病基因检测结果(阳性)Table 2 Detection results of common pathogenic genes in 62 patients with deafness-causing gene(positive)
2.2 携带致病基因患者常见致病基因检测结果
如表2 所示,339 例非综合征型耳聋患者中共检测出62 例为携带致病基因的患者。其中携带GJB2 基因突变的有37 例,携带SLC26A4 基因突变的有25例。在62名携带致病基因突变的耳聋患者中,由GJB2 基因突变的患者的比例为59.68%(37/62),由SLC26A4 基因突变的患者的比例为40.32%(25/62)。所有所携带致病基因患者中的致病基因的突变方式均为单基因杂合突变。GJB2基因检测出的突变位点有10 个,其中在c.235delC 突变位点发生突变的有12 例,所占比例19.35%(12/62);c.299-300delAT突变位点7例,所占比例11.29%(7/62);c.109G>A 突变位点6 例,所占比例9.67%(6/62);c.608T>C 突变位点6 例,所占比例9.67%(6/62),其余突变位点为c.238C>A,c.19C>A,c.680T>C,c.35insG,c.368C>A,c.344T>G 均1 例,所占比例均为1.61%(1/62)。SLC26A4基因检测出的突变位点有2个,其中c.919A>G突变位点23例,所占比例37.1%(23/62);c.2168A>G突变位点2例,所占比例3.23%(2/62)。
3 讨论
耳聋基因在遗传性耳聋患者中具有较高的遗传异质性,不同地区和不同人群中耳聋基因的突变频率、突变方式和热点突变有很大差异,且不同地域、不同民族有其自身特点。根据国内学者流行病学研究结果,在遗传性感音神经性聋患者中,42.41%能够检测出相关耳聋基因突变[6]。国内聋病分子流行病学调查显示,21%的感音神经性聋患者携带GJB2基因突变,14.5%的患者携带SLC26A4基因突变,3.8%患者携带线粒体m.155A>G[7]。本研究中339 例非综合征型感音神经性耳聋患者通过DNA 测序共检出114 例患者发生耳聋相关基因突变,检出率为33.63%(114/339),其中66 例GJB2基因突变(19.47%, 66/339);7 例GJB3 基因突变(2.06%,7/339);39 例SLC26A4 基因突变(11.50%,39/339);4 例12srRNA 基因突变(0.88%, 4/339)。本研究中,非综合征性耳聋患者中GJB2 基因突变检出率和SLC26A4 基因突变检出率与全国平均水平大致相等;但4个常见耳聋致病基因突变总检出率和12srRNA基因突变检出率较全国平均水平稍低,其原因可能是因为样本量不够大,分布较广,尚不能集中说明东北的发病情况。
遗传性耳聋是临床上比较常见的遗传病之一,它的发生主要是由基因突变引起[8]。由基因突变引起的遗传性耳聋患者会将该致病基因突变稳定的遗传给后代,而耳聋致病基因携带者患者将该致病基因突变遗传给后代的几率则减少一半,因此查明遗传性耳聋是否由基因突变引起的,对于遗传性耳聋的诊断,防治具有重要的意义。本次研究纳入的339 例非综合征耳聋患者中52 例是由基因突变引起耳聋患者,62例为携带致病基因的患者,其占非综合征型耳聋患者的比例分别为15.33(52/339)和18.28%(62/339),其结果与田颖[9]报道的辽宁地区基因突变引起耳聋患者和携带致病基因患者,其占非综合征型耳聋患者的比例均为20.03%相比,本次研究携带致病基因的耳聋患者占比大致相等,而基因突变致聋患者占比减少。
GJB2基因是致聋的第一大耳聋基因。不同人群、不同地域间基因致病突变率及突变热点各异。本研究中GJB2 致病突变率为8.55%,与西北地区报道的GJB2致病突变率9.55%相比大致相等[10],但低于全国GJB2总体致病突变率12.88%[11]。东亚人群中以235delC 最为多见,而在白种人群和阿拉伯人群中则以235delG 为最常见的突变类型[12]。SLC26A4 基因是我国第二位高发的致聋基因。至今已报道有近200种SLC26A4基因的致病突变,其突变谱在不同的地区和种族中存在差异[13]。在亚洲,H723R 在日本人群中占有最高比例[14],而中国人群中以c.919-2A>G 最为常见[15]。在本次研究中不论是致病基因突变患者还是携带耳聋致病基因患者中GJB2 均是最常见的突变基因,其次为SLC26A4 基因,这与田颖[9]等报道的辽宁地区非综合征型耳聋患者常见耳聋基因突变分析结果一致,且235delC 为GJB2 基因最常见的突变类型,c.919-2A>G 为SLC26A4 基因最常见的突变类型。而在本次研究中GJB3基因突变只存在于6例携带耳聋致病基因的患者中,12sRNA 基因突变只存在于4 例由基因突变引起耳聋患者中,c.580G>A 为GJB3 基因突变主要形式,1555A>G 为12srRNA 基因突变主要形式。这两种基因突变率均高于田颖[9]等对于辽宁地区非综合征型耳聋患者GJB3基因突变和12sRNA基因突变率为0的报道。GJB2基因和SLC26A4基因遵循常染色体隐性遗传,常发生多态性改变。基因的多态性改变不与遗传性状共伴随,是指人群中个体的DNA 分子结构改变,但基因的表达形状及功能不改变。多态性改变单独出现均不引起病变[10]。GJB2 基因和SLC26A4 基因的单杂合突变并不能引起病变,只能明确患者携带此突变基因,是突变基因携带者。而这两个基因的纯合和复合突变则被认为具有致病性,此类患者则被认为是由耳聋基因突变引起的NSHL。因此,将致病基因检测结果分别在携带耳聋致病基因患者和耳聋基因突变引起耳聋患者中进行讨论,探讨耳聋基因的突变方式及突变位点对耳聋患者的致病性则对明确耳聋患者的病因,采取的治疗方案及预防后代遗传性耳聋的具有重要的意义。
DNA 测序技术是现代分子生物学和生物医学研究中常用的一种技术手段。具有高通量、低成本、高准确性、高敏感性及高特异性的优点,显著提高了耳聋基因的诊断率。目前用于测序的技术主要有Sanger 等发明的双脱氧链末端终止法和Maxam 及Gilbert 发明的化学降解法。运用最多的是Sanger测序法,即一代测序。现Sanger测序技术的测序长度可达1000bp,碱基的读取准确率达99.99%,已成为测序的金标准。尽管Sanger 测序技术已经提高了DNA 测序的速度,但是在费用和效率上仍有不足。高通量、成本低的下一代测序(next generation sequencing,NGS)技术的诞生这使耳聋基因研究和基因诊断步入一个新的高速发展阶段。NGS技术具有高通量和低单碱基成本的特点,但是测序读长相对较短是第二代测序技术的主要缺陷。为了更好地发掘DNA 信息,研究人员开发了新一代测序方法—单分子测序技术,即第三代基因测序技术,该技术不仅提高了读长,而且可以直接检测RNA 序列和甲基化序列。在此基础上,第四代测序技术—单分子纳米孔测序迅速成为基因测序技术的热点,与前三代技术相比较,代表性的纳米孔测序技术在成本和速度方面都得到大幅提升,仪器也更加小型化。尽管目前最为先进的纳米测序技术具有诸多进步,但仍面临很多挑战,且该技术目前尚处于实验室阶段[16]。基因测序技术作为人类探索生命奥秘的重要手段之一,对生命科学和生物医学等领域的发展起到了巨大的推动作用。本研究应用DNA一代测序技术对东北地区非综合征型耳聋患者常见耳聋基因进行检测,从群体层面研究耳聋基因,绘制耳聋人群的基因突变谱,发现耳聋人群中的热点突变,明确不同突变在人群中的贡献率,并分析其发病的特点及规律,以了解本地区人群聋病的遗传病因和特点,为东北地区的耳聋遗传咨询提供有益的指导。
