添加C10H 10Cl2Ti对6LiBH 4-CaH 2-3MgH 2体系储氢性能的影响
2019-12-11饶崇顺杨敬豪周轶凡
饶崇顺 张 欣 杨敬豪 刘 倩 周轶凡*,
(1河南省先进镁合金重点实验室,郑州大学材料科学与工程学院,郑州 450001)
(2硅材料国家重点实验室,浙江省电池新材料及应用技术重点实验室,浙江大学材料科学与工程学院,杭州 310027)
(3中国人民解放军陆军炮兵防空兵学院郑州校区教学科研处,郑州 450000)
0 引 言
能源危机和环境恶化促使人们加速开发和利用清洁可再生能源。氢能以来源广泛(水、有机物)、无污染和质量轻等优点,成为理想的二次能源[1]。因此,全球各国都非常重视氢能技术的研发与应用,并在国家能源战略中制定了氢能技术的发展和规划。美国政府将氢能确定为维系经济繁荣和国家安全至关重要的技术之一,财政年度拨款预算中也不断加大对氢能的研究投资;加拿大首先启用了一批氢能公交车,打造氢能利用的典范;日本以构建“氢能社会”为发展目标,采用政府主导的方式积极推动氢能源产业在本国的发展[2-3]。氢能的推广需解决3个主要的问题:廉价制取氢源、安全储氢和用氢。近几年制氢和用氢技术已经相对成熟,能够满足商业化需求,然而储氢技术尚不成熟,阻碍了实用化的发展。与气态和液态等储氢方法相比,固体材料储氢通过氢气与储氢材料发生物理吸附或者化学反应的方式进行储氢,具有较高的能量密度和安全方便等特点,得到了研究人员的广泛关注[4-6],因此开发固态储氢材料至关重要。
固态储氢材料主要包括稀土合金[7]、金属氢化物[8]和配位氢化物[9-10]等。其中,LiBH4以较高的质量储氢密度(质量分数18.5%)和体积储氢密度(121 kg·m-3),成为一种非常有潜力的配位氢化物储氢材料,但由于B-H共价键作用较强,导致动力学与热力学性能较差,需要在500℃以上才能实现完全吸放氢,极大限制了其产业化应用[11]。因此,近年来研究人员通过多种手段改善LiBH4的性能,主要有反应物去稳定性[12]、催化改性[13]、纳米限域[14]等。
反应物去稳定性是通过在样品中引入第二相,在加热过程中生成更稳定的产物,从而降低了体系的反应温度。Vajo等[15-16]将MgH2加入LiBH4中,在加热过程中生成了比B更稳定的MgB2,从而使整个体系的焓变降至46 kJ·mol-1,低于各自单相反应的焓变,进而降低了其吸放氢温度。在此基础上,研究者们又陆续发现,如CaH2[17]、SrH2[18]和CeH2[19]等类型的氢化物均表现出对LiBH4具有较好的去稳定性效果。
催化改性是改善储氢材料动力学性能的重要手段。Yu等[20]在LiBH4中加入不同的氧化物催化剂并发 现 其 催 化 活 性 顺 序 为:Fe2O3>V2O5>Nb2O5>TiO2>SiO2。Zhang等[21]按照LiBH4与MCl2(M=Fe、Co和Ni)的物质的量之比2∶1的比例混合,研究发现部分的卤化物与LiBH4首先反应生成Fe、Co和Ni对应的硼化物,随后新生成的硼化物继续催化剩余的LiBH4放氢。Deprez等[22-23]将异丙醇钛添加到2LiBH4-MgH2体系中,混合物在球磨过程中会生成钛的氧化物,能较好地改善体系吸放氢性能,但是反应过程中会生成Li2O和MgO,降低循环容量。Zhou等[24]在LiBH4-CaH2体系中引入MgH2,实现了第一步MgH2的自分解和第二步LiBH4-CaH2反应的相互催化,放氢动力学性能实现了协同改善,因而提高了储氢性能。
纳米限域是采用熔融渗入或溶剂浸渍的方法将LiBH4装载于多孔材料中。Surrey等[25]将LiBH4熔渗到多孔气凝胶状碳中,其样品起始放氢温度为200℃,峰值温度为310℃,相比原始样品分别降低了150和90℃,但由于多孔材料和氧化硼的存在,样品在第二个循环时的放氢量(质量分数,下同)仅为4.5%。
综上所述,添加催化剂和反应物去稳定性,能够在维持较高储氢容量的基础上,改善LiBH4的吸放氢性能。因此我们在前期工作的基础上,选取6LiBH4-CaH2-3MgH2复合体系为研究对象,选取不含O元素的含钛有机物C10H10Cl2Ti为催化剂前驱体,系统研究了添加C10H10Cl2Ti对6LiBH4-CaH2-3MgH2复合体系可逆储氢性能的影响。结果显示,添加质量分数5%C10H10Cl2Ti的样品放氢量为8.4%,5次循环之后仍有97%容量保持率,首次和二次等温放氢速率比未添加样品分别提高了178%和40%。结构研究表明,C10H10Cl2Ti在吸放氢反应过程中生成了多价态Ti的化合物,该化合物能够显著改善6LiBH4-CaH2-3MgH2复合材料的动力学性能
1 实验部分
1.1 样品制备
LiBH4(纯度95%)和CaH2(纯度97%)购于Sigma Aldrich,C10H10Cl2Ti(纯度97%)购于阿拉丁北京兴荣源。实验用MgH2由Mg粉(Macklin,纯度99%)在340℃和2 MPa氢压下经20 h保温氢化制得。将LiBH4、CaH2、MgH2和C10H10Cl2Ti按照一定配比,以500 r·min-1转速混合球磨24 h,制备成6LiBH4-CaH2-3MgH2-x%C10H10Cl2Ti样品(x%为质量分数,x=0、1、3、5、7、9),样品分别记为S0、S1、S3、S5、S7、S9。实验室所用样品大部分都比较活泼,容易与空气中的H2O和O2等反应,因此样品在转移和处理等操作时均在高纯氩气的MBRAUN手套箱或者在特制密闭反应器中进行,其中MBRAUN手套箱水、氧含量均小于1.0×10-6(V/V)。
1.2 成分、结构和形貌表征
材料的物相组成在X射线衍射仪(XRD,MiniFlex 600 Rigaku,Rigaka)上进行分析,测试过程中采用的是Cu Kα射线(λ=0.154 nm),电压40 kV,电流40 mA,扫描角度范围为2θ=5°~90°,步长为0.05°;材料中各元素的价态利用X射线光电子能谱仪(XPS,ESCALAB 250 Xi,Thermo Fisher Scientific)进行分析;材料中所含化学键由傅里叶变化红外光谱(FTIR,TENSOR 27,Bruker)进行表征;材料的微观形貌和粒径尺寸在扫描电子显微镜(SEM,S4800,Hitachi)上进行观察,仪器加速电压为30 kV,样品室真空度为7×10-4Pa;Mg、Ca和Ti元素的分布采用能量色散X射线谱仪(EDS)进行表征。
1.3 吸放氢性能测试
样品的吸放氢性能测试在自制的Sieverts型装置上进行。放氢测试时,从室温真空状态下开始,样品量为70~90 mg。随温放氢升温速率为2℃·min-1;等温放氢测试则是以10℃·min-1的升温速率将样品快速加热至预设温度然后进行保温。吸氢测试时,将体系抽至真空后充入氢气使压力为1×104kPa,样品质量为150~200 mg。随温和等温吸氢升温速率分别为1℃·min-1和10℃·min-1。采用自制的程序升温脱附系统 (temperature programmed desorption,TPD)对样品放氢过程进行定性分析。测试过程采用氩气作为载气,流速控制在20 mL·min-1,样品的质量约为20 mg,升温速率为1~10℃·min-1。
2 结果与讨论
2.1 6LiBH 4-CaH 2-3MgH 2-x%C10H 10Cl2Ti结构和放氢性能
图1所示为球磨后6LiBH4-CaH2-3MgH2-x%C10H10Cl2Ti样品的X射线衍射图和傅里叶红外光谱图。如图1a所示,添加C10H10Cl2Ti后可以观察到对应于LiBH4(17.9°、24°、24.9°、27°、44.8°)、MgH2(27.9°、35.6°、39.8°、54.5°)和CaH2(30°、31.8°、41.4°、60°)的特征衍射峰,与原始纯MgH2、CaH2和LiBH4相比峰强度减弱,FTIR测试(如图1b)可以观测到位于2 384、2 288、2 221和1 125 cm-1处LiBH4的[BH4]-中B-H键的伸缩和弯曲振动吸收峰,证明了球磨之后样品中LiBH4的存在。由此可见,球磨之后样品主要由LiBH4、MgH2、CaH2组成。

图1 6LiBH4-CaH2-3MgH2-x%C10H10Cl2Ti样品的XRD图(a)和FTIR谱图(b)Fig.1 XRD patterns(a)and FTIR spectra(b)of 6LiBH4-CaH2-3MgH2-x%C10H10Cl2Ti samples
图2 a为球磨后6LiBH4-CaH2-3MgH2-x%C10H10Cl2Ti(x=0、1、3、5、7、9)的TPD曲线。由图可知,S0样品在260℃开始放氢,最终在410℃结束放氢,第一步和第二步放氢峰值温度分别为287和394℃。C10H10Cl2Ti添加后样品放氢过程仍然是两步反应,并没有影响S0样品反应过程。随着C10H10Cl2Ti添加量的增加,样品的起始放氢和放氢峰值温度也逐渐降低。当C10H10Cl2Ti的含量增加至5%时,TPD曲线主要有2个放氢峰,起始和终止放氢温度分别约为220和390℃,第一步和第二步放氢峰值温度分别约为260和370℃,相对于S0样品均降低约25℃。进一步增加C10H10Cl2Ti的含量,两步反应的温度没有明显降低。体积放氢测试(图2b)表明,C10H10Cl2Ti的添加使样品的放氢量逐步降低,当温度加热到400℃时,S5样品的放氢量约为8.4%。综合考虑操作温度和放氢容量,可认为S5样品是最优配比,之后系统的性能研究和机理研究主要针对S5样品展开。
为了更好的表征各元素分布情况,将C10H10Cl2Ti的含量提高到20%,制备6LiBH4-CaH2-3MgH2-20%C10H10Cl2Ti(S20)样品。图3为球磨S20样品的SEM照片和Mg、Ti、Ca元素分布图。由图可知球磨后S20样品颗粒大小在0.2~0.3μm之间,颗粒表面较为光滑圆润,同时球磨样品中Ca、Ti和Mg元素并没有出现单相聚集区,表现出良好的分散性。

图2 6LiBH4-CaH2-3MgH2-x%C10H10Cl2Ti样品的TPD(a)和体积放氢(b)曲线Fig.2 TPD(a)and volumetric release(b)curves of 6LiBH4-CaH2-3MgH2-x%C10H10Cl2Ti samples

图3 球磨S20样品的SEM照片(a)以及相对应的Ca、Ti和Mg元素分布图(b)Fig.3 SEM images(a)and EDSmapping results(Ca,Ti and Mg elements)(b)of S20 sample
2.2 6LiBH 4-CaH 2-3MgH 2-5%C10H 10Cl2Ti可逆吸放氢反应
为了解S5样品所放氢气的纯度,对其在热分解过程中产生的气体进行MS分析(图4a)。结果表明,分解过程中并没有B2H6和CH4副产物气体的释放,其氢气释放曲线和TPD曲线一致(图2a);为了进一步确定C10H10Cl2Ti的添加是否会引发某些副反应,对S20样品也进行MS测试(图4b),仍未有CH4和B2H6气体生成。这表明,C10H10Cl2Ti的添加不改变S0样品的反应路径,热分解过程是单一的放氢反应过程。
图5为S5样品在不同温度下放氢产物的XRD图和FTIR谱图。如图5a所示,制备的S5样品主要由LiBH4、CaH2和MgH2组成。当加热到210℃时,可以观察到样品的衍射峰相比球磨后没有发生明显变化。当温度升高至260℃时,可以观测到MgH2的衍射峰强度降低,同时出现了Mg的衍射峰。继续加热到300℃,Mg的衍射峰强度明显增加,而MgH2的衍射峰完全消失。由此可见在210~300℃之间的第一步反应是MgH2自分解。继续升温至380℃时,LiBH4和CaH2的衍射峰变弱,与此同时FTIR谱图表明样品升温至380℃时,[BH4]-中的B-H振动吸收峰明显弱化,这意味着LiBH4和CaH2逐渐被消耗,生成了新相LiH和CaB6。当加热至430℃时,LiBH4和CaH2的衍射峰彻底消失,同时样品的FTIR谱图也无法观察到B-H键吸收峰,由此可见LiBH4此时已完全分解。因此,该体系的放氢过程可分为2个阶段,第一步主要是MgH2的分解,第二步主要是LiBH4与CaH2反应生成LiH和CaB6。

图4 S5(a)和S20(b)样品热分解过程H2、CH4和B2H6质谱信号曲线Fig.4 MSspectra curves of H2,CH4 and B2H6 during desorption of the S5(a)and S20(b)samples
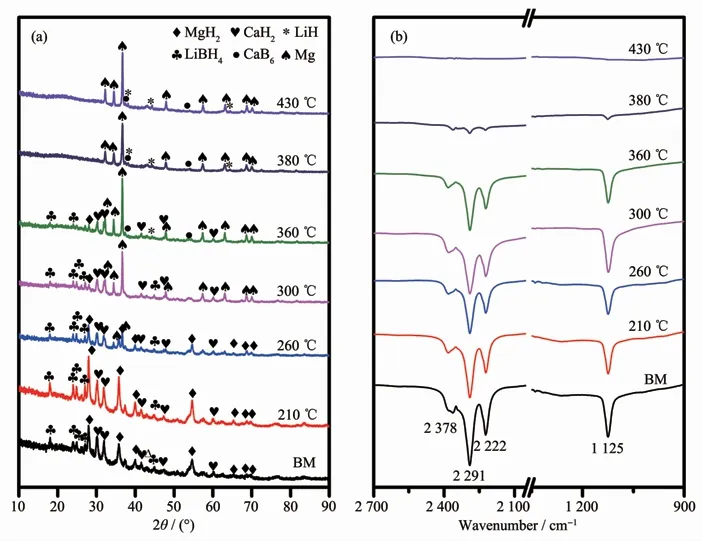
图5 S5样品在不同温度放氢后的XRD(a)和FTIR(b)谱图Fig.5 XRD patterns(a)and FTIR spectra(b)of the dehydrogenated S5 sample at different temperatures
为了确定高温放氢是否会引起催化剂发生团聚失活,将催化剂的添加量增加至20%,以便对催化剂所含元素进行检测。图6所示为添加20%催化剂的随温放氢曲线,从图中可以看出,添加20%的C10H10Cl2Ti后并没有改变样品的放氢行为,放氢曲线与添加5%的C10H10Cl2Ti的样品一致,这表明随着催化剂添加量的增加,催化剂所起的效果没有发生改变,催化剂中各元素的状态也应保持一致,因此本文针对催化剂含量较高的样品进行深入研究,揭示催化剂中各元素在放氢过程中的变化。
对S20样品吸放氢之后的样品进行能谱分析,结果如图7和8所示。Ca、Ti、Mg和Cl元素仍然均匀的分布,并没有出现团聚的现象,说明C10H10Cl2Ti在吸放氢过程中仍然均匀地分散在体系中。
S5样品的随温吸氢曲线如图9a所示。由图可知,与放氢过程类似,S5样品吸氢过程也明显分为2步,从80℃开始吸氢到390℃结束,吸氢量约为8.3%,与其放氢量几乎一致,说明S5样品具有良好的吸放氢可逆性。取吸氢至不同阶段的样品进行XRD和FTIR分析发现(图9b、c),230℃的吸氢产物中可以观察到MgH2、CaB6和LiH的衍射峰,相应的FTIR谱图没有观察到B-H键振动吸收峰,证明样品的氢化过程第一步是Mg与H2反应生成MgH2。在470℃吸氢产物的XRD图中,MgH2的衍射峰基本保持不变,CaB6和LiH衍射峰完全消失,出现了LiBH4的衍射峰,但是始终没有观察到CaH2的衍射峰,取而代之的是MgCaH4的衍射峰,由此可见样品在氢化过程中部分的MgH2与CaH2反应生成了MgCaH4,相应的FTIR谱图中明显观察到B-H键振动吸收峰。因此,S5样品第二步氢化反应是MgH2、CaB6、LiH和H2反应生成MgCaH4与LiBH4的过程。综上所述,C10H10Cl2Ti的添加并没有改变S0样品自身的吸放氢反应路径[24]。

图6 S5和S20样品的TPD(a)和体积放氢(b)曲线Fig.6 TPD(a)and volumetric release(b)curves of S5 and S20 samples

图7 S20样品放氢后的SEM照片(a)以及相对应的Ca、Ti、Mg和Cl元素分布图Fig.7 SEM images and EDSmapping results(Ca,Ti,Mg and Cl elements)of dehydrogenated S20 sample

图8 S20样品氢化后的SEM照片(a)以及相对应的Ca、Ti、Mg和Cl元素分布图Fig.8 SEM images and EDSmapping results(Ca,Ti,Mg and Cl elements)of hydrogenated S20 sample
进一步分析C10H10Cl2Ti的添加对S0样品循环稳定性的影响,其放氢循环曲线如图10所示。S5样品二次放氢量约为8.3%,与一次放氢量基本一致,循环5次之后样品的储氢容量(质量分数)仍高达8.1%,但随着循环的进行,体系放氢操作温度明显升高,表明样品的动力学性能有一定的衰退。S5样品经过5次循环之后仍然有较高的氢气储存量(图10b),所以添加C10H10Cl2Ti有助于提高S0样品的循环稳定性。
图11为S20样品球磨、脱氢和吸氢的SEM照片,图中放氢产物的颗粒尺寸明显变大,可能由于放氢过程中颗粒的聚集和生长所致。氢化之后颗粒尺寸比球磨样品明显变大,在循环过程中进一步阻碍了氢气释放,导致放氢温度升高,这是循环放氢温度往高温区转移的原因之一。
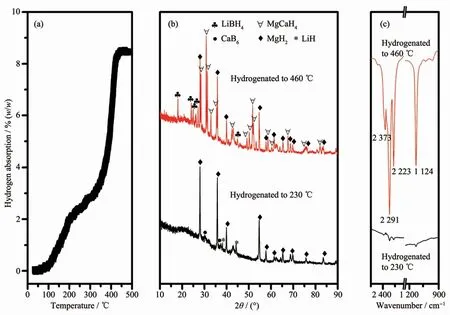
图9 S5样品的随温氢化曲线(a)和不同温度氢化后的XRD图(b)和FTIR谱图(c)Fig.9 Hydrogenation curve(a)of dehydrogenated S5 sample,and XRD patterns(b),FTIR spectra(c)of dehydrogenated S5 sample at different hydrogenation stages

图10 S5样品随温放氢(a)和可逆循环容量(b)的曲线Fig.10 Non-isothermal(a)and capacity retention(b)curves of S5 sample

图11 S20样品在球磨(a)、脱氢(b)和氢化(c)状态下的SEM图像Fig.11 SEM images of ball milling(a),dehydrogenation(b)and hydrogenation(c)of S20 sample
2.3 6LiBH 4-CaH 2-3MgH 2-5%C10H 10Cl2Ti动力学性能
为进一步研究添加C10H10Cl2Ti对体系放氢动力学性能的影响,测试了S0和S5样品在360℃的等温放氢曲线(图12a)。研究发现,与原始样品S0相比,S5样品的放氢动力学性能得到明显改善。在360℃时,S5样品在92 min可完成理论容量97%的放氢,而此时原始样品仅能释放出理论容量62%的氢气,S5样品的放氢速率提高了178%。由第二个循环的等温放氢曲线可知S0和S5样品放氢速率减缓,但是相比原始样品的放氢速率,S5样品二次放氢仍然有40%的提高。采用Kissinger方程分别计算出S0和S5体系放氢反应表观活化能Ea(图12b和c)。S5样品的第一步和第二步放氢反应表观活化能分别为(131±4.51)kJ·mol-1和(138±4.84)kJ·mol-1,相比S0样品,表观活化能分别降低了约18.6%和15.8%。因此,C10H10Cl2Ti的添加降低了S0样品的放氢反应能垒,使体系放氢温度降低,动力学性能提高。

图12 S0和S5样品在360℃的等温放氢曲线(a);S0(b)和S5(c)样品的Kissinger图Fig.12 Isothermal dehydrogenation curves of S0 and S5 samples at 360℃(a);Kissinger plots of S0(b)and S5(c)samples
2.4 添加C10H 10Cl2Ti在吸放氢过程中的作用机理
为了揭示催化添加剂C10H10Cl2Ti在样品放氢过程中的变化,选取催化添加剂含量较高的S20样品为研究对象,以观察各元素的化学状态。
从图13a可知,球磨后样品主要由LiBH4、MgH2和CaH2组成。此外,还观测到明显的LiCl的衍射峰,表明球磨过程中催化添加剂与储氢活性物质之间发生了副反应;在样品的FTIR谱图中可以观察到B-H键振动吸收峰,说明有LiBH4存在;随后对S20样品球磨罐内气体进行质谱检测,发现除Ar气外没有其他气体生成。在S20样品热分解产物的XRD图中可观测到明显的LiCl衍射峰,FTIR谱图也未出现B-H键振动吸收峰,这表明样品中LiBH4完全消耗。在放氢产物氢化后的XRD和FTIR中观察到对应于LiBH4的相关信号,同时也观测到了Ca4Mg3H14的生成,说明C10H10Cl2Ti量的增多,促使生成一种新的三元化合物。LiCl的特征衍射峰依然存在,故Cl元素以LiCl的形式存在。
选取S20样品为研究对象,借助XPS对添加剂中的Ti元素化学状态进行表征(图14)。由图可知,C10H10Cl2Ti球磨前后可以观察到Ti2p在457.1和462.7 eV的Ti2p3/2和Ti2p1/2自旋双重轨道峰,与Ti3+的结合能457.1和462.7 eV相一致。在室温至270℃的区间内,Ti元素的状态没有发生改变。提高放氢温度至370℃时,产物中的Ti2p图谱可以拟合为2组Ti2p3/2和Ti2p1/2自旋轨道双峰,一组位于457.1和462.7 eV,另一组位于453.8和459.7 eV,这与Ti0的结合能453.8和459.9 eV相一致[26]。当温度升高到420℃时,对应于金属Ti的轨道峰的强度增加,对应于Ti3+的轨道峰的强度减弱,这表明样品中的Ti3+在反应过程中被还原成金属钛。氢化后样品中金属Ti和Ti3+的峰仍然存在(图14h),但Ti3+的峰强度弱于球磨后的样品(图14b)。因此,我们认为Ti3+在反应中起催化作用,从Ti3+转变为Ti0。
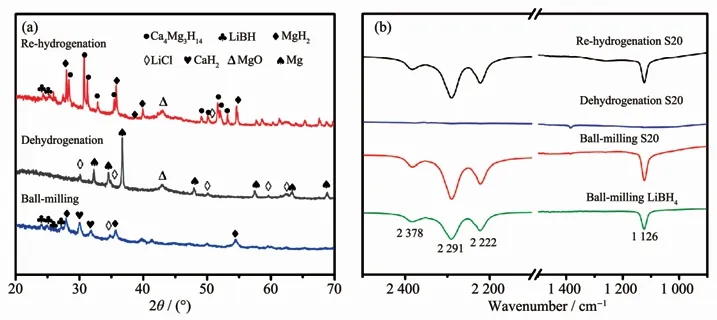
图13 C10H10Cl2Ti和S20样品的XRD图(a)和FTIR谱图(b)Fig.13 XRD patterns(a)and FTIR spectra(b)of C10H10Cl2Ti and S20 samples

图14 球磨C10H10Cl2Ti和S20在不同阶段的Ti2p轨道的XPS谱图Fig.14 Ti2p XPSspectra of ball-milling C10H10Cl2Ti and S20 at different stages
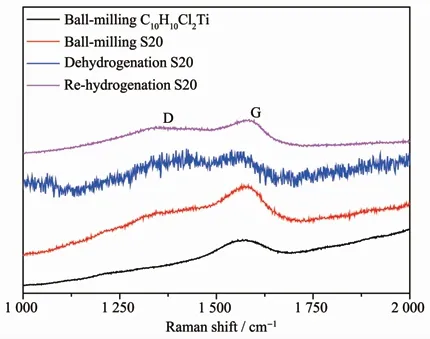
图15 球磨C10H10Cl2Ti、球磨S20和S20样品吸放氢产物的拉曼光谱Fig.15 Raman spectra of ball-milling C10H10Cl2Ti,ball-milling S20,dehydrogenated and re-hydrogenated product of S20
利用拉曼光谱可以表征碳元素在反应过程中的状态变化。由图15可知,球磨后C10H10Cl2Ti样品中碳仅在1 580 cm-1处显示出G峰,这表明碳在C10H10Cl2Ti中具有较好的结晶度。球磨S20样品中的碳除G峰外还出现了微弱的D峰(D模式强度被认为是缺陷的量度,其值越大,表示C原子晶体的缺陷越多)[27],这表明在球磨过程中少量的C10H10Cl2Ti与LiBH4发生了反应。在热分解之后,S20样品中碳的D峰变得逐渐明显,证明在热分解之后体系中的碳主要以无定形碳的形式存在。氢化后样品拉曼谱图中D峰和G峰仍然存在,这表明C元素在体系中仍然以无定形碳的形式存在。
综上所述,在热分解过程中C10H10Cl2Ti与S0样品发生氧化还原反应,Ti3+得电子被还原成Ti单质,同时样品释放出H2,而碳元素在放氢过程中逐渐转变为无定形碳,生成的Ti进一步降低了氢分子的离解能,从而降低了S0样品的吸放氢温度。由于原位生成的Ti和C分散在样品颗粒中,为氢气的扩散提供了路径,提高了氢的吸收和扩散速率,从而提升了样品的吸放氢速率,改善了体系的动力学性能。
3 结 论
本文研究了C10H10Cl2Ti的添加对6LiBH4-CaH2-3MgH2样品吸放氢性能的影响,其中添加5%的C10H10Cl2Ti时催化效果最佳,起始和终止放氢温度分别约为220和390℃,比原始样品分别降低约30和25℃,放氢量为8.4%,5次循环之后仍然有约8.1%的储氢容量,具有97%的容量保持率。在360℃等温放氢时,虽然6LiBH4-CaH2-3MgH2和6LiBH4-CaH2-3MgH2-5%C10H10Cl2Ti样品的放氢速率都有减缓的趋势,但是添加C10H10Cl2Ti的样品一次等温放氢速率比原始样品提高了178%,二次放氢速率仍然有40%的提高。Kissinger法计算结果表明,第一步和第二步表观活化能相比原始样品分别降低了约18.6%和15.8%。由机理分析可知,C10H10Cl2Ti与6LiBH4-CaH2-3MgH2样品在热分解过程中发生氧化还原反应,Ti3+在反应过程中起到催化作用且生成了Ti单质,还有无定形碳的生成,两者协同改善使反应的活化能进一步降低,同时也为氢气的扩散提供了路径。
