发酵猕猴桃果醋用醋酸菌的筛选与鉴定
2019-12-09邓丽丽刘亚男喻道军邓志平
邓丽丽,刘亚男,喻道军,邓志平*
(1.沈阳医学院公共卫生学院实验教学中心,辽宁 沈阳100034;2.卫生检验教研室)
果醋含有丰富的有机酸、氨基酸、维生素及矿物质,具有食疗保健、美白护肤、抗病、抗衰老等功能,被誉为“21世纪的食品”[1]。随着生活水平的提高,果醋越来越受到人们的广泛关注。大量研究表明,醋酸菌是影响果醋酿造质量和产量的关键因素[2-4],我国目前酿醋用的菌种存在产酸不理想、耐酒精能力不高、风味欠佳等问题,因此培育和筛选适合果醋生产的优质醋酸菌对于果醋酿造工业的发展具有重大意义。
猕猴桃被誉为“水果之王”、“维C之冠”,近年来其保健功能和药用价值越来越受到关注[5-6],但猕猴桃属于后熟果实,加工运输和果实储藏方面仍存在不少问题,而对猕猴桃进行深加工,制作果醋,既能充分利用其中的营养价值,又能有效减少猕猴桃因储藏期短而造成的经济损失。有研究显示,醋酸菌是一种常见细菌,广泛分布于苹果、葡萄、红枣等新鲜水果中[7-8]。因此,本文拟从猕猴桃中分离和筛选出优质醋酸菌,以期用于猕猴桃果醋的生产酿造工业中,从而为生产高质量、风味佳的猕猴桃果醋提供优质的菌种来源。
1 材料与方法
1.1 材料 超市挑选色泽均匀、果实饱满、无破碎伤口新鲜猕猴桃(四川省苍溪县中华猕猴桃)。
1.2 培养基[9](1)增殖培养基:葡萄糖1%,酵母浸粉1%,KH2PO40.5%,pH 5.5,115℃灭菌30 min,灭菌后冷却至70℃时,加入3%无水乙醇。(2)基础液体培养基:葡萄糖1%,酵母浸粉1%,pH 5.5,115℃灭菌30 min,灭菌后冷却至70℃时,加入3%无水乙醇。(3)钙平板分离培养基(固体培养基):葡萄糖1%,酵母浸粉1%,CaCO31%,琼脂1.5%,115℃灭菌30 min,灭菌后冷却至70℃,加入3%无水乙醇。(4)1#发酵培养基:葡萄糖1%,酵母浸粉0.5%,KH2PO40.06%,硫酸镁0.04%,pH 5.5,115℃灭菌30 min。(5)2#发酵培养基:葡萄糖1%,酵母浸粉0.5%,KH2PO40.06%,硫酸镁0.04%,pH 5.5,115℃灭菌30 min,灭菌后冷却至70℃,加入3%无水乙醇。(6)产酸试验培养基:葡萄糖1%,酵母浸粉0.5%,KH2PO40.06%,硫酸镁0.04%,pH 5.5,115℃灭菌30 min,灭菌后冷却至70℃,加入3%无水乙醇。
1.3 试剂 酵母粉、琼脂购自青岛高科园海博生物技术有限公司;无水乙醇、碳酸钙、磷酸二氢钾、硫酸镁、葡萄糖、冰醋酸、氢氧化钠、氯化铁、甘油等购自国药集团化学试剂有限公司;酚酞购自西陇科学股份有限公司;革兰染液购自青岛海博生物。
1.4 仪器与设备 高速离心机HC-3014(科大创新中佳公司);超低温冰箱MDF-U53V(日本PANASONIC公司);pH计(上海精密科学仪器有限公司);SX-500压力蒸汽灭菌器(日本东京TOMY公司);振荡培养箱ZDP-150(上海精宏实验设备有限公司);OLYMPUS CX21FS1生物显微镜(日本OLYMPUS公司)。
1.5 实验方法
1.5.1 样品制备 挑选色泽均匀、果实饱满、无破碎伤口的猕猴桃200 g(无需去皮),将其榨汁后用干净纱布进行过滤,除去果皮、果肉等固型颗粒物。取20 ml装入50 ml的三角瓶中,密封,30℃静置1周,待醋酸味浓郁时放入4℃冰箱中冷藏备用。
1.5.2 增殖培养 取5 ml猕猴桃汁加入含有50 ml增殖培养基的100 ml三角瓶中,混匀,30℃,120 r/min摇床上培养2 d。
1.5.3 分离、纯化及初筛 取上述增殖培养基1 ml,加入9 ml无菌生理盐水中,依次进行10倍浓度梯度稀释,制成浓度为10-1~10-7的稀释液,取10-5、10-6、10-7稀释液0.2 ml在钙平板分离培养基上进行涂布,每种稀释液3个平行样本,30℃的恒温培养箱中倒置培养2~4 d。部分菌落能够产生透明圈,说明该菌能够产酸并降解CaCO3,可能是醋酸菌。挑取菌落形态一致,透明圈直径与菌落直径之比(HC值)[10]较大的单菌落,平板划线法接种于钙平板分离培养基中,30℃培养2~4 d,进一步分离纯化[11]。
1.5.4 产酸定性鉴定 将初筛选出的菌株接种于含5 ml基础液体培养基中,30℃,120 r/min摇床上培养2~3 d,然后吸取4.5 ml于离心管中,5 000 r/min离心5 min去除菌体细胞,再吸取4 ml上清液于小烧杯中,用0.1 mol/L的NaOH溶液中和至pH为7.0。将其移入试管后,并滴加5滴配制好的5%FeCl3溶液,放入沸水浴中加热,观察是否形成红褐色沉淀[12],若形成红褐色沉淀,则初步鉴定为醋酸菌。
1.5.5 产酸量测定[13]将初筛得到的菌株,分别挑取一环接种于含20 ml产酸试验培养基的50 ml三角瓶中,每组3个平行样本,在恒温震荡摇床上,120 r/min培养2 d后,取2 ml发酵液,加入含50 ml蒸馏水的100 ml三角瓶中,滴加3~5滴酚酞指示剂,用标定的0.1 mol/L的NaOH溶液滴定至浅粉色。记录每个菌株所消耗的NaOH溶液体积。消耗NaOH溶液最多的菌株即为产酸量最高的菌株,根据以下方法计算出其产酸量:产酸量(g/L)=(V-V0)×CNaOH×60/L[11],式中:V为发酵液样品滴定耗用的NaOH毫升数;V0为以空白培养基为对照滴定耗用的NaOH毫升数;CNaOH为NaOH溶液的浓度(mol/L);L为样品的毫升数;60为醋酸的分子量。
1.5.6 耐乙醇性能检验 将复筛中选出的产酸性能最好的菌株L2,接种于含50 ml液体培养基的100 ml三角瓶中,在30℃120 r/min摇床上培养2 d后,获得种子液。然后用平板菌落计数法测定菌液浓度作为初始浓度对照。然后将种子液按10%接种量转接入乙醇含量分别为3%、5%、7%、9%、11%的1#发酵培养基中30℃静置培养3 d后,分别用平板菌落计数法测定菌液浓度。平板菌落计数法:从10-1梯度稀释至10-6,均取0.1 ml菌液进行均匀涂布。每个乙醇稀释梯度取10-3、10-4、10-5三个梯度,每个梯度3个重复,30℃恒温培养箱中培养2~3 d,观察并记录其菌落数。
1.5.7 耐醋酸性能检验 将复筛中选出的产酸性能最好的菌株L2,进行种子液培养,做空白对照。将种子液按10%接种量接种于醋酸含量分别为10、20、30、40、50 g/L的2#发酵培养基中,每个醋酸浓度3个平行样本。30℃静置培养3 d后分别用平板菌落计数法测定其耐醋酸性能。
1.5.8 醋酸菌菌株鉴定[14]形态特征观察:观察菌株的钙平板分离培养基菌落形态,对筛选到的菌株进行革兰染色,在油镜下观察菌体细胞的形态特征。
基因组DNA的提取采用细菌基因组总DNA提取试剂盒(大连宝生物公司),使用通用引物27F(5′-AGAGTTTGATCCTGGCAG-3′)和1492R(5′-GGCTACCTTGTTACGACTT-3′)扩增16S rDNA,1%琼脂糖凝胶电泳检测无误后,PCR产物送交上海生工生物工程技术服务有限公司进行纯化、测序。
1.5.9 醋酸菌菌株系统发育树的构建 将菌株序列在Genbank数据库中进行BLAST同源性比对分析,利用Mega 7.0软件构建系统发育树[15],进而确定其种属地位。
1.5.10 菌种保藏 取菌液0.5 ml和30%的甘油溶液以1∶1比例混合后置于-80℃后进行保藏。
2 结果与分析
2.1 菌株的分离、纯化及初筛 共筛选到5株HC值较大的细菌,对其编号L0-L4。并对其进行分离、纯化初筛,透明圈结果及纯化筛选菌落见图1。
经初筛共获得3株透明圈较大(HC>2)的醋酸菌L0、L2、L3。菌株淡黄色,表面隆起边缘整齐,均呈椭圆到短杆状,(0.8~1.2)μm×(1.5~2.5)μm,单生、成对偶尔成短链状分布,细胞端尖或平。通过革兰染色均为革兰阴性菌,见图2。
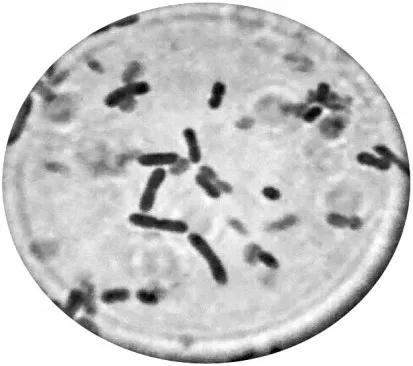
图2 油镜下观察醋酸菌株L2革兰染色
2.2 产酸定性鉴定 将初筛得到的5株菌活化并离心之后,进行FeCl3滴定实验,菌株L0、L2、L3产生了红褐色沉淀,表明这几株菌为醋酸菌,菌株L1、L4未产生红褐色沉淀,表明其不能产生醋酸,见图3。

图3 分离菌株产酸定性鉴定
2.3 产酸量测定 将L0、L2、L3 3株菌株进行发酵培养后,对其进行滴定,测定其产酸量,结果L2消耗NaOH溶液最多,产酸量最高,产酸量为3.6 g/L。测出3株菌株的产酸量结果见表1。
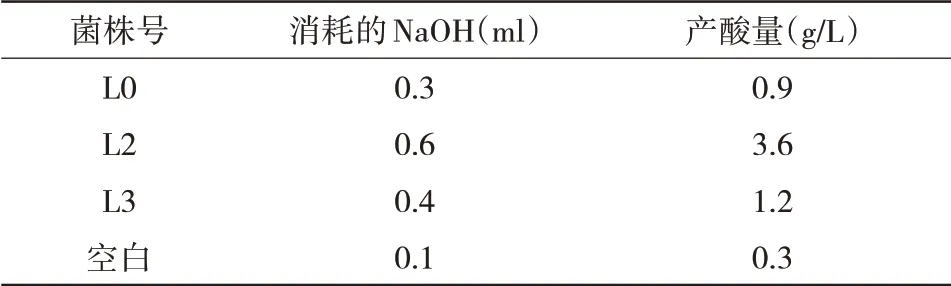
表1 L0、L2、L3 3株菌株产酸量测定结果
2.4 耐乙醇性能检验 当乙醇浓度为3%时,菌株L2的菌落总数达到最大值,为1.5×107CFU/ml;当乙醇浓度为5%时,菌株L2的菌落总数高于初始浓度菌落总数;当乙醇浓度为7%时,菌株L2的菌落总数低于初始浓度菌落总数,说明该乙醇浓度抑制了菌株生长;当乙醇浓度为11%时,大多数菌落无法在此浓度下生长。结果显示菌株L2对乙醇的耐受性为5%。
2.5 耐醋酸性能检验 当醋酸浓度为1%时,菌株L2的菌落总数达到最大值,为9.5×106CFU/ml;当醋酸浓度为2%时,菌株L2的菌落总数开始低于初始浓度菌落总数,说明此醋酸浓度影响菌体生长;当醋酸浓度为5%时,大多数菌体无法正常生长。结果显示菌株L2对醋酸的耐受性为1%。
2.6 分离菌株的分子生物学鉴定 提取菌株L0、L2、L3的全基因组,使用通用引物27F和1492R扩增其16S rDNA序列,对全基因组DNA和PCR扩增的16S rDNA进行琼脂糖凝胶电泳检测,结果见图4。
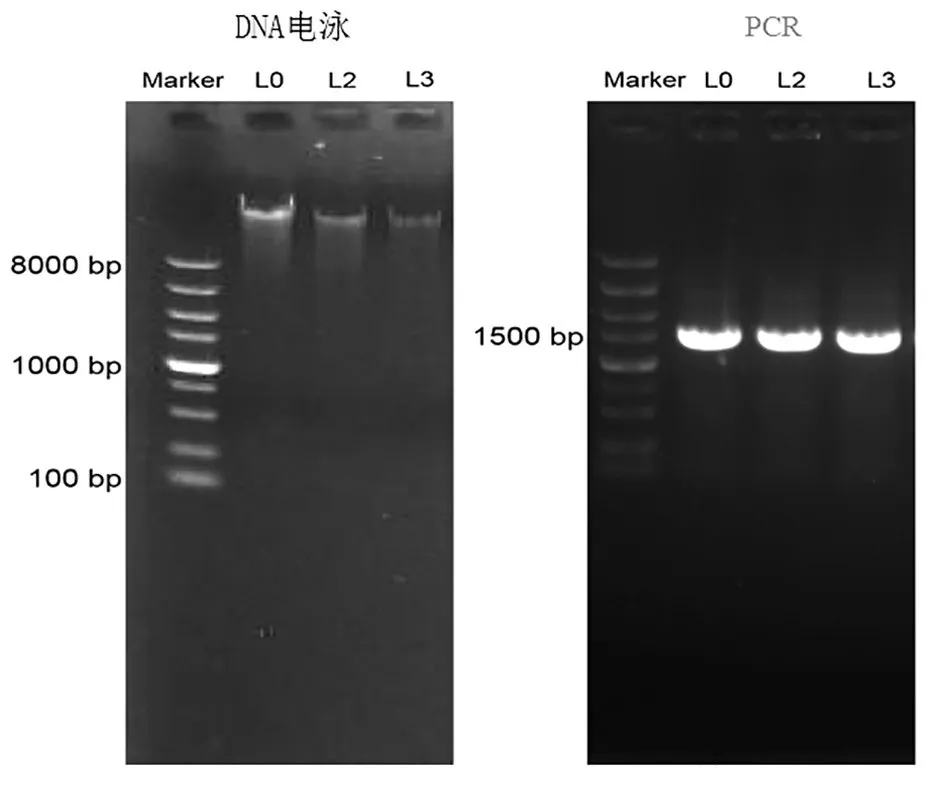
图4 菌株基因组总DNA及16S rDNA PCR扩增产物电泳结果
2.7 分离菌株的系统发育树构建 在NCBI上将3株菌株的16S rDNA序列进行BLAST同源序列比对,利用Mega 7.0软件构建菌株系统发育树。见图5。分离得到的3株醋酸菌按照亲缘关系分属于三个种:苹果醋杆菌(Acetobacter malorum):L0;桃醋酸杆菌(Acetob act er per sici):L2;芝庇侬醋杆菌(Acetobacter cibinon gens is):L3。
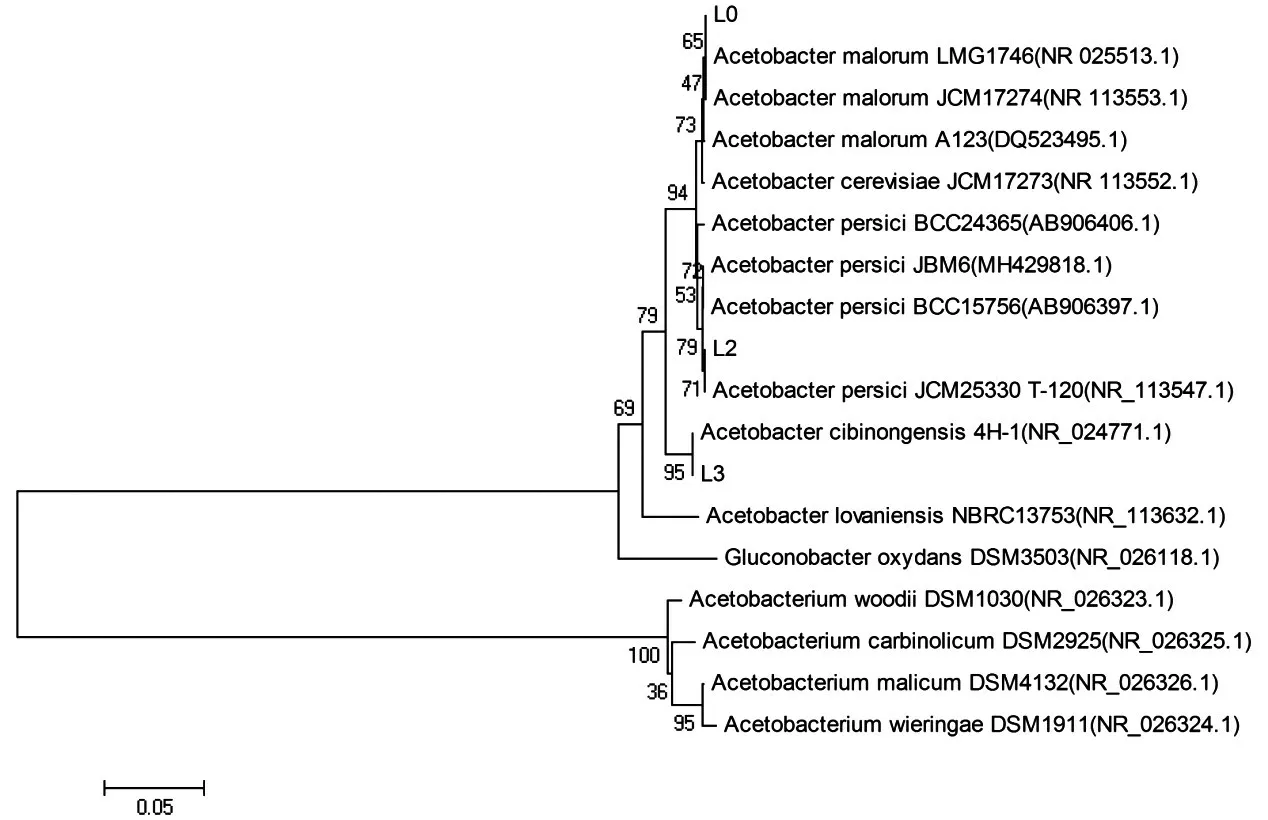
图5 系统发育树
3 结论与讨论
本研究通过富集培养和分离纯化,从猕猴桃中筛选出了5株HC值较大的菌;然后对这5株菌进行分段划线,初步筛选出3株优势纯菌株;对筛选出的菌株进行产酸定性鉴定,其中菌株L0、L2、L3产生了红褐色沉淀,说明这三株菌均为醋酸菌;并对其进行革兰染色和形态特征观察,其中L0、L2、L3为球杆状革兰阴性菌;将筛选出的3株醋酸菌进行产酸性能测定,发现菌株L2的产酸量最高,达到了3.6 g/L;再对菌株L2进行耐乙醇、耐醋酸性能测定,得到菌株L2对乙醇的耐受性为5%,对醋酸的耐受性为1%。通过对这3株菌进行分子生物学鉴定,发现分离得到的3株醋酸菌分属于3个种:苹果醋杆菌(Acetobacter malorum):L0;桃醋酸杆菌(Acetob acter persici):L2;芝庇侬醋杆菌(Acetob act er cibinon gens is):L3。优良的醋酸菌菌种是影响果醋品质的关键因素,本实验从猕猴桃中筛选鉴定了3株醋酸菌,丰富了猕猴桃果醋制作工艺中醋酸菌来源,不过与苹果、葡萄等果醋醋食品生产标准菌比较,本实验分离得到的猕猴桃醋酸菌产酸能力有待提高,但作为果醋生产的重要来源,有必要进行更进一步培养发酵条件的探索,或者遗传诱变选育,以获得更适合用于猕猴桃果醋生产加工的醋酸菌。
