培养条件对保加利亚乳杆菌中胞外肽酶PrtB基因表达的影响
2019-12-03卢佳音李东飞赵悦含侯俊财
卢佳音 李东飞 赵悦含 侯俊财
(东北农业大学食品学院 哈尔滨150030)
乳酸菌菌体在生长过程中,培养环境中的肽和游离氨基酸很快被消耗[1]。当乳酸菌在发酵与生长时,通常存在许多大分子蛋白质及一些无机氮源,然而这些都不能被乳酸菌直接利用,通常情况下,乳酸菌将这些大分子的蛋白质分解掉,补充其自身生长所需的氨基酸[2]。通常由3 部分构成乳酸菌的水解体系:将细胞外的蛋白质水解成多肽的胞外蛋白酶;转移系统将胞外水解产物转运至胞内;胞内肽酶将转运到细胞的水解产物进一步水解为游离氨基酸,在细胞内的一些物质代谢与蛋白质的合成反应中,都会有它们的参与[3]。根据研究显示,有3 种基因是乳酸菌常见的,分别为PrtB、PrtP 和PrtS,而保加利亚乳杆菌为PrtB,乳酸乳球菌为PrtP,嗜热链球菌为PrtS[4]。相对于其它乳酸菌,有关保加利亚乳杆菌的蛋白水解酶的基因表达研究相对较少[5],尤其国内少有报道。以RT-PCR 技术作为主要的检测方法,通过设置不同培养条件,探究保加利亚乳杆菌中PrtB 基因的表达变化规律。
1 材料与方法
1.1 菌株和试剂
菌株:德氏乳杆菌保加利亚亚种(Lactobacillus debreuckii ssp.bulgaricus)LB08006、LB08007、LB08012、LB08014、LB08015、LB08016、LB08017,由东北农业大学乳品科学教育部重点试验室分离保存。
主要试剂:EDTA·2Na,Amresco;DEPC,科尔生物有限公司;RNAprep pure 培养细菌总RNA提取试剂盒,天根生化科技北京有限公司;Primer-ScriptRRT 反转录试剂盒,宝生物大连工程有限公司;SYBRRPremix Ex TaqTM试剂盒,宝生物大连工程有限公司。
1.2 菌株生长曲线的测定
将菌株活化后连续传代培养,在42 ℃培养条件下,每2 h 取出2 mL 培养液,调节波长为OD600,测定其吸光值[6]。
1.3 基因表达的检测方法
根据课题目的(在转录水平上探讨乳酸菌不同样本之间关键酶PrtB 基因的表达变化规律),主要采用RT-PCR 手段进行研究。
1.4 关键酶基因及管家基因的确定
根据参考文献[7]至[11]中所示方法确关键酶基因及管家基因定。
其目的基因见表1。

表1 实时定量PCR 的目的基因Table 1 Target genes for real-time qPCR
1.5 实时荧光定量PCR 引物设计与合成
用16s rRNA 作管家基因[12],根据GenBank提供的德氏乳杆菌保加利亚亚种ATCC 11842 的DNA 序列(GenBank accession number:NC_ 008054.1)中相应基因的序列,采用primer5.0 软件设计基因引物,如表2所示。

表2 实时荧光定量PCR 引物Table 2 The primer of real-time RT-PCR
1.6 RNA 的提取
根据RNAprep pure 试剂盒法,其提取步骤按照说明书。
1.7 反转录合成cDNA
反转录合成cDNA 参照杜越欧等[13]的方法,利用PrimerScriptR RT 反转录试剂盒 (日本Takara Biotechnology),其提取步骤按照说明书。
1.8 实时荧光定量PCR
使用Takara 公司的SYBRRPremix Ex TaqTM试剂盒配制PCR 反应液,反应体系为:SYBRRPremix Ex TaqTM(2×)10 μL;上、下游引物(10 μmol/L)各0.4 μL;ROX Reference Dye II(50×)0.4 μL;dH2O(灭菌蒸馏水)6.8 μL,稀释cDNA 为原样品的10 倍,取样品2 μL;总体系为20 μL[13]。
使用ABI 7500 实时荧光定量PCR 仪进行实时荧光定量PCR 试验,不同反应体系样品做3 个重复。通过两步法PCR 扩增标准程序:预变性的条件:95 ℃30 s;PCR 反应:95 ℃5 s,60 ℃34 s,40 循环。
1.9 试验设计方案
1.9.1 不同生长阶段对胞外肽酶PrtB 基因表达的影响 活化好试验用菌,通过测定其生长曲线来选择本试验用菌种。分别在6,12,18 h 与24 h提取发酵液,再提取菌体RNA。
1.9.2 不同氮源对胞外肽酶PrtB 基因表达的影响 采用液体MRS 培养基、无氮液体MRS 培养基与含酪蛋白胨液体MRS 培养基,将试验用菌接入其中,调整pH 6.2,42 ℃,12 h。
1.9.3 不同初始pH 对胞外肽酶PrtB 基因表达的影响 7 株保加利亚乳杆菌经活化分别接种于初始pH 5.6,5.9,6.2,6.5 的液体MRS 培养基中,42℃,12 h。
1.9.4 不同温度对胞外肽酶PrtB 基因表达的影响 将恒温水浴锅温度的设置为30,37,42 ℃和45 ℃,在pH 6.2 条件下发酵12 h。
首先提取RNA,随后测定其浓度与完整性,再将其反转录为cDNA,最后通过RT-PCR 检测。
1.10 实时荧光定量PCR 数据处理分析
分析基因CT 值,求得标化后的-△△CT 值,通过2-△△CT 法评估目的基因的相对表达量[14]。用SPSS(11.5)软件进行方差和双因素试验分析。
2 结果与分析
相对于其它方法,RT-PCR 具有更高的灵敏性与准确性,鉴别乳酸菌的菌种与其基因差异更加普遍[7,15-16]。
2.1 RNA 的数量和质量
RNA 的数量与质量决定了后续试验能否成功,其中,总RNA 的数量是反转率效率的关键点。图1中,23S 与16S 均能被清晰观察到,此结果说明RNA 有很小程度的降解。
基因组DNA 可被试剂盒提供的DNA 酶(DNase I) 高效提取。在这种条件下能有效预防RNA 样品被基因组DNA 污染,发生非特异性扩增,导致RNA 的表达量高于实际量。本试验提取的RNA 样品经检测,可用于后续实时荧光定量PCR 试验。
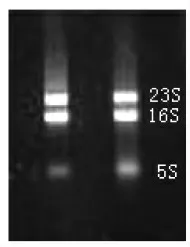
图1 RNA 样品电泳图Fig.1 Electrophoresis of RNA
利用反转录法将得到的RNA 转变为cDNA,通过PCR 试验,根据条带的大小与目的基因作对比,由此可以确定二者的相似度。若没有出现杂条带,且在适宜的亮度区间内,则证明通过反转率合成的cDNA 无污染现象,引物具有良好的特异性。
2.2 实时荧光定量PCR 结果
如图2所示,在熔解曲线中,只出现单一峰,由此可以排除形成的引物二聚体和非特异产物对试验结果的影响,说明引物具有非常好的特异性。
通过扩增曲线图3发现,管家基因与目的基因PrtB 不仅扩增效率极好,而且稳定性也非常好,CT 值的重复性非常好。

图2 管家基因和目的基因PCR 产物的熔解曲线Fig.2 The melt curves of PCR products of endogenous reference gene and target gene

图3 管家基因和目的基因PCR 产物的扩增曲线Fig.3 The amplification curves of PCR products of endogenous reference gene and target gene
2.3 不同生长阶段胞外肽酶PrtB 基因表达情况分析
2.3.1 保加利亚乳杆菌生长曲线 为探究保加利亚乳杆菌生长的对数期与稳定期,提取RNA。本研究筛选出7 株菌,其中LB08012、LB08014 和LB08016 生长状况最好。如图4所示,在确保培养条件一致的情况下,当培养时间为2 h 时3 株菌达到对数生长期;培养时间16 h 达到稳定期。LB08014 活力最强,LB08012 活力最弱。
2.3.2 PrtB 在菌株不同生长阶段的表达情况分析 由菌体生长曲线可见,2~16 h,3 株菌株达到生长对数期,稳定期在18~24 h。将6,12,18,24 h 为设置为目的时间。
如图5所示,选取的3 株菌在生长过程中,目的基因PrtB 在对数初期与稳定期的表达量都显著下降。选取的4 个时间点中,培养时间为6 h 时PrtB 基因的表达量最大。培养时间12 h 时菌株LB08012 中的PrtB 基因表达量明显下降(P<0.01)。LB08014 中,目的基因PrtB 在培养时间12 h 时的表达量下降幅度最小,下降2.5 倍。到达对数末期时,其趋于稳定。稳定期时,不发生显著改变,与对数初期相比有极显著的差异(P<0.01)。
为探究PrtB 基因受菌株、培养时间与二者因素对相对表达量的影响采用双因素试验的方法。通过表3可以发现,PrtB 基因受到菌株与培养时间的影响显著(P<0.001),不仅如此,二者间交互作用也同样显著(P<0.001)。

图4 保加利亚乳杆菌的生长曲线Fig.4 The growth curve of Lacbobacillus bulgaricus
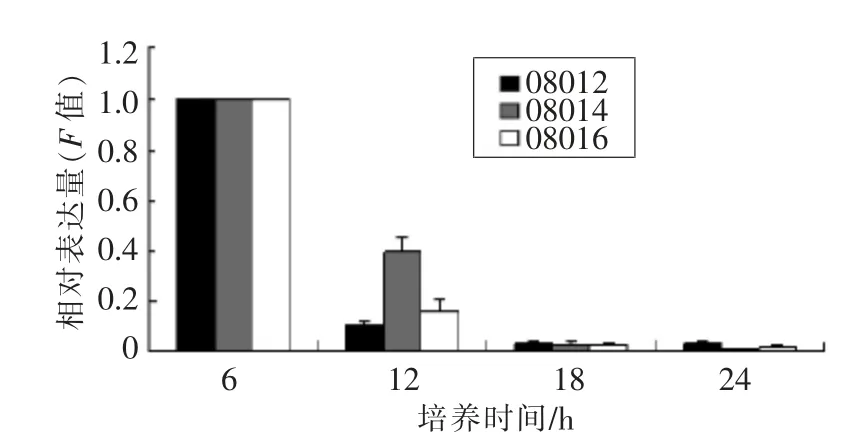
图5 菌体不同生长阶段目的基因PrtB 表达的动态变化Fig.5 Kinesis of the target gene PrtB during the different growth phase

表3 3 个菌株不同生长时期目的基因的相对表达分析Table 3 Analysis of the relativity quality of the target genes during’ different growth phase of three strains
2.4 不同氮源对PrtB 基因表达的影响
乳酸菌生长体系中的蛋白质通常情况下会被乳酸菌水解,转化为氨基酸与小分子游离氨基酸来维持菌体自身的生长。
由表4可以看出,氮源条件对于试验结果影响显著(P<0.05),且PrtB 基因的表达在不同菌株之间同样存在显著差异。此外,如图6所示,N 缺乏条件与正常MRS 培养条件相比,PrtB 的表达量呈上升的趋势(P<0.05),平均上调2.4 倍,其在LB08015 中变化最大,在LB08012 中变化最小;添加酪蛋白胨后,PrtB 的表达量显著下调(P<0.05),平均下调4.1 倍。其在LB08012 中的下降趋势最为显著。
2.5 不同初始pH 对PrtB 基因表达的影响
不同的pH 环境会对酶活性影响显著。
通过调整不同的初始pH,PrtB 基因的表达见表5和图7。图7中,pH 显著影响PrtB 基因的表达,不仅如此,PrtB 基因的表达在不同菌株之间同样存在显著差异。在LB08006、LB08007、LB08012和LB08016 中,随着初始pH 的提高,PrtB 基因的表达水平上调。在初始pH6.5 的培养条件下PrtB的表达量与初始pH5.6 相比,上调5.0 倍,LB08016 与LB08006、LB08007 和LB08012PrtB 的PrtB 表达量相比差异极显著 (P<0.01);而 在LB08014 和LB08017 中,当调整初始pH 为5.6时,其表达量明显低于初始pH5.9、初始pH 6.2 和初始pH 6.5;在LB08015 中,PrtB 的表达呈先上升后下降的规律。
综上,当调整培养环境的pH 值为5.9,6.2,6.5 时,相比于对照组,LB08006、LB08007、LB08012和LB08016 中目的基因显著上调,LB08014、LB08015 和LB08017 中的目的基因显著下调。菌株的差异与培养条件共同影响其基因的表达。
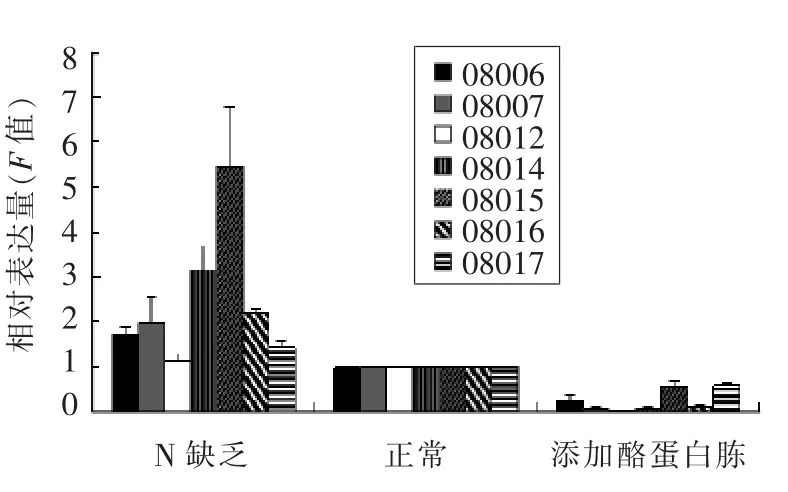
图6 不同氮源培养下目的基因PrtB 表达的动态变化Fig.6 Kinesis of the target gene PrtB at the different nitrogen source cultivation

图7 不同初始pH 培养下目的基因PrtB 表达的动态变化Fig.7 Kinesis of the target gene PrtB at the different initial pH cultivation

表4 不同氮源培养下PrtB 的相对表达量(n=3)Table 4 The relative quantity of PrtB at the different nitrogen source cultivation(n=3)

表5 不同初始pH 培养下PrtB 的相对表达量(n=3)Table 5 The relative quantity of PrtB in the different initial pH cultivation(n=3)
2.6 不同温度对PrtB 基因表达的影响
试验发现,温度通过干扰蛋白酶的活性来干扰菌体的生长。本研究通过调整温度条件来探究PrtB 基因表达的改变。
如表6与图8所示,12h 后,温度差异会给PrtB 的表达带来影响。在LB08006、LB08016 和LB08017 3 种保加利亚乳杆菌中,30 ℃时PrtB 的表达量最高,在37,42 ℃和45 ℃时较30 ℃有所下降。其中,在37、42 ℃和45 ℃时,其呈现出先上升后下降的趋势。
在LB08007、LB08012、LB08014 和LB08015中PrtB 基因的表达变化呈先上升再下降的趋势,在37 ℃时达到最高,相对于对照组分别上调了1.3、2.3、5.3 倍和15.5 倍。在LB08015 中差异最大,在LB08007 中差异最小(P<0.05);45 ℃时目的PrtB 基因的表达量最低,与对照组相比分别下降了50,41.7,5.6 倍和1.9 倍。
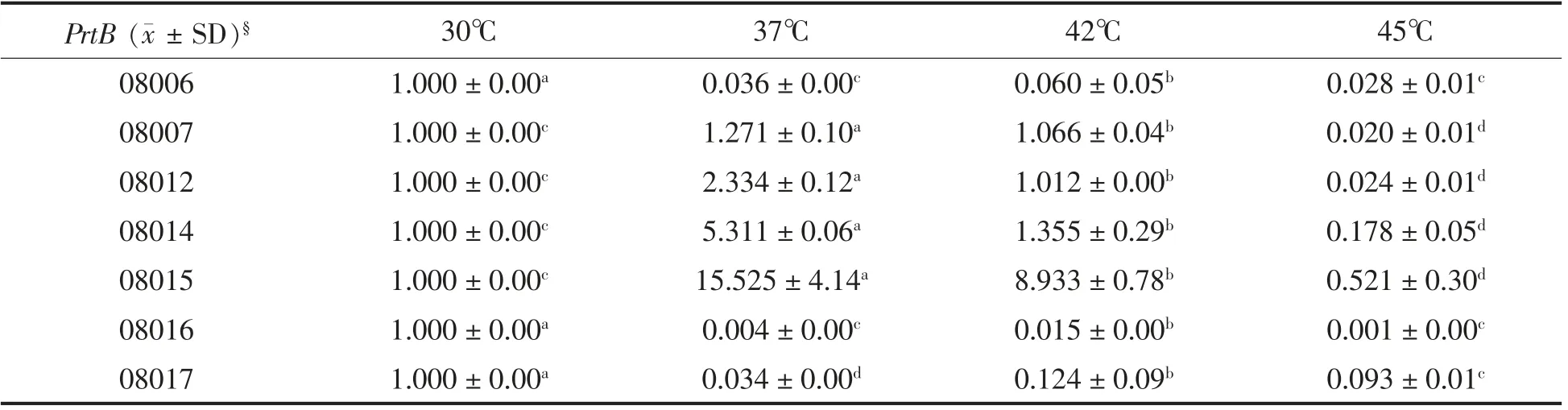
表6 不同初始温度培养下PrtB 的相对表达量(n=3)Table 6 The relative quantity of PrtB in the different temperature cultivation(n=3)
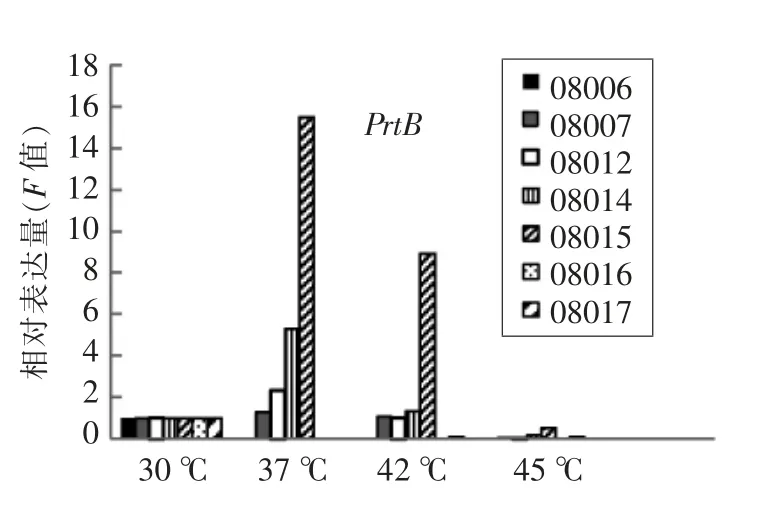
图8 不同温度培养下目的基因表达的动态变化Fig.8 Kinesis of the target gene in the different temperature cultivation
3 讨论
乳酸菌中,乳酸杆菌蛋白的水解能力比乳酸球菌的水解能力强[17-18]。本试验选取保加利亚乳杆菌为目的菌株。胞外酶、转运系统与胞内酶为构成蛋白水解体系的主要成分。保加利亚乳杆菌的蛋白水解体系中的胞外酶经过基因鉴定为PrtB 基因,其最重要的功能就是将大分子蛋白水解为多肽。在乳酸菌研究领域,广泛应用RT-PCR 技术来探讨不同样本或同一样本在不同处理前、后某一基因的表达水平。
伴随着菌体的不断生长,胞外酶PrtB 基因表达水平有所上升,在对数期至稳定期区间,其变化趋势为下降,达到稳定期后无显著变化的趋势。其蛋白在转绿与翻译的过程中,由于生物学差异,造成PrtB 的差异。不仅如此,PrtB 的表达水平在不同菌株之间存在显著差异,这可能是由于菌体自身的生物学活性导致的[19-20]。本研究与Leila Sadat-Mekmene 等[21]的发现一致,其通过探究不同生长时期胞外蛋白酶的变化,得出在对数生长期胞外酶基因的表达量最大,与菌体生长呈正相关。试验中PrtB 基因表达的下降趋势与Nicoline Vermeulen 等[15]的研究结果一致,其认为对数期与稳定期Lactobacillus sanfranciscensis DSM 20451T中蛋白酶OppF、DtpT 和PepT 在面团发酵过程中基因表达的水平都是下降的。综上所述,在对数初期,保加利亚乳杆菌蛋白酶表达量最大,其它时期相对较小。
目的基因PrtB 在无氮源条件下表达量有所增加。本试验中,添加酪蛋白胨条件与正常MRS培养条件相比,PrtB 的表达量显著下调。这是由于当培养基添加了酪蛋白胨后,菌体的繁殖非常迅速,稳定期后,菌体蛋白基因表达因游离氨基酸的积累而受到抑制。氮源可以抑制PrtB 基因在蛋白质水解体系中的表达。
当初始pH 增加时,其基因的表达有所增加。这与Rina Wu 等[22]得到的结论一致,其对Lactobacillus casei Zhang 中PepP 基因 在pH 2.5 和pH6.4 环境中的表达进行比较分析,结果显示该基因在低pH 值下的表达水平也较低,而PrtB 会因生物学的差异而在一些菌株中下降。这种差异同样表现在蛋白的水平上。pH 值对蛋白的水解率的影响因菌株的差异而有所不同,当菌体细胞膜上的电荷受的pH 值影响时,其膜的通透性发生改变,导致其蛋白酶的活性与氮源吸收率的改变;在较低的pH 条件下,乳酸菌无法平衡细胞内的pH 稳定,使得细胞内的pH 也降低,抑制乳酸菌生长[23]。同样,菌株的特性决定了抑制的情况[24]。
本试验结果显示,在LB08007、LB08012、LB08014 和LB08015 中,PrtB 基因的表达量先上升后下降,在37 ℃最高,45 ℃最低。30 ℃时,低温同样使得表达量很低,一部分菌体处于休眠状态。不仅如此,酶活性也受低温的影响。PrtB 基因的表达在37 ℃上升,45 ℃下降可能是因为37 ℃为最适的生长温度,菌体处于对数期生长,所需肽与氨基酸也更多,更多的蛋白质被蛋白酶分解,进而蛋白酶表达水平较高。
综合以上分析,PrtB 基因活性显著影响发酵剂的品质。其菌属与生长环境共同决定其蛋白的水解特性。通过研究发现培养时间、氮源种类、初始pH 和培养温度是影响其活性的主要条件。
4 结论
PrtB 基因的表达受培养时间、氮源种类和含量、初始pH 和培养温度的影响。LB08012、LB08014、LB08016 中,PrtB 基因在对数初期至稳定期表达量显著下降,到稳定期PrtB 基因已不表达。PrtB 的表达量在N 缺乏条件下上升(P<0.05),平均上调2.4 倍,不同的菌种,上升的幅度有差异。PrtB 的表达量在添加酪蛋白胨时显著下调,平均 下调4.1 倍。随着初始pH 的提高,PrtB 在LB08006、LB08007、LB08012 和LB08016 中 表 达量上调。在LB08016 中,PrtB 上升幅度最为显著,上调10.0 倍;在LB08014 和LB08017 中,PrtB 的表达量随pH 值的升高显著下调;在LB08015 中,PrtB 的表达随着pH 值的升高而下降。在45 ℃条件下PrtB 的表达量与对照组(30 ℃下)相比显著下降(P<0.05)。
