丁香假单孢菌重组褐藻胶裂解酶的酶学性质及酶解产物的抗氧化活性
2019-12-03吴丽云朱艳冰银小倩李鹤宾肖安风
吴丽云 朱艳冰,2,3,4* 银小倩 李鹤宾 倪 辉,2,3,4 肖安风,2,3,4
(1 集美大学食品与生物工程学院 福建厦门361021 2 福建省食品微生物与酶工程重点实验室 福建厦门361021 3 厦门市食品与生物工程技术研究中心 福建厦门361021 4 厦门市南方海洋研究中心经济海藻资源化利用与深加工重点实验室 福建厦门361021 5 厦门医学院 福建厦门361008)
褐藻胶主要提取自褐藻的细胞壁和细胞间质,它是由β-D-甘露糖醛酸(M)及其在C5 上的差向异构体α-L-古罗糖醛酸(G)通过β-1,4 糖苷键连接形成的一类阴离子酸性直链多糖,是褐藻酸有机衍生物及褐藻酸盐的统称[1]。褐藻胶的降解产物褐藻寡糖的分子质量低,稳定性高,水溶性强,易被人体吸收。它具有多种生物活性,例如解毒、整肠、抗病毒、抑菌、抗自由基氧化、免疫调节和促进生长等。
褐藻胶裂解酶可通过β-消除反应切断褐藻胶的糖苷键,生成不饱和糖醛酸寡糖和单体。根据底物的特异性可将褐藻胶裂解酶分为聚甘露糖醛酸裂解酶(EC 4.2.2.3)、聚古罗糖醛酸裂解酶(EC 4.2.2.11) 以及可同时降解两种片段的双功能酶。除了制备褐藻寡糖,褐藻胶裂解酶还可解决铜绿假单胞菌(Pseudomonas aeruginosa)生物膜的耐药性[2],制备原生质体和海藻单细胞[3],提取RNA、DNA 及其它一些胞内活性物质,分析褐藻胶的结构[4]等。
褐藻胶裂解酶主要存在于海洋细菌、海洋无脊椎动物、真菌和病毒等中。微生物来源的褐藻胶裂解酶具有种类多,便于生产等优点,成为褐藻胶裂解酶的主要来源。产褐藻胶裂解酶的微生物来源包括噬琼胶菌属 (Agarivorans sp.)[5]、弧菌属(Vibrio sp.)[6]、交替单胞菌属(Alteromonas sp.)[7]、铜绿假单胞菌(Pseudomonas aeruginosa)[8]、嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia)[9]、鞘氨醇单胞菌属(Sphingomonas sp.)[10]、叶氏假交替单胞菌 (Pseudoalteromonas elyakovii)[11]、产黄菌属(Flavobacterium sp.)[12]、棒状杆菌属(Corynebacterium sp.)[13]和环状芽孢杆菌 (Bacillus circulans)[14]等。
在先前的研究中,作者对丁香假单孢菌(Pseudomonas syringae) 的褐藻胶裂解酶基因alg进行了克隆及生物信息学分析[15]。本研究在此基础上进行丁香假单孢菌褐藻胶裂解酶的酶学性质及酶解产物的抗氧化活性研究,为进一步研究该酶的结构与功能奠定了良好的基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 pMD18-T-alg 重组质粒、大肠杆菌(E.coli)BL21(DE3),由本实验室保存;pET-28a 载体,Novagen 公司。
1.1.2 主要试剂 dNTPs、T4 DNA 连接酶、Taq DNA 聚合酶、EcoRI 和HindIII,TaKaRa 公司;卡那霉素、柱式DNA 胶回收试剂盒和柱式质粒DNA 提取试剂盒,生工生物工程(上海)股份有限公司;金属镍螯合琼脂糖凝胶6FF,GE Healthcare Life Sciences 公司;D-聚甘露糖醛酸和L-聚古罗糖醛酸,博智汇力生物科技有限公司;其余试剂均为分析纯产品。
1.1.3 培养基LB 培养基 酵母粉5 g,NaCl 10 g,蛋白胨10 g,去离子水1000 mL(LB 固体培养基则需添加琼脂20 g)。
1.2 主要仪器、设备
7200 可见分光光度计,尤尼柯(上海)仪器有限公司;ALP-高压蒸汽灭菌器,日本ALP 公司;ZHWY-2102 双层全温度恒温摇床,上海智城分析仪器制造有限公司;SW-CJ-2FD 型双人单面净化工作台,苏州净化设备有限公司;Unic3-18K 冷冻离心机,Sigma 公司;AvantiTMJ-25 冷冻离心机,美国Beckman 公 司;7934070 冷冻干燥仪,美国Thermo Fisher 公司。
1.3 重组表达质粒的构建
丁香假单孢菌褐藻胶裂解酶基因alg 的正向引物序列:5′-CCGGAATTCGCACTGGTTCCACCCAAGGG-3′(划线部分为EcoRI 酶切位点),反向 引 物 序 列:5′-GCGAAGCTTTCGAACCGTCGTTATCGC-3′(划线部分为HindIII 酶切位点)。以丁香假单孢菌的基因组DNA 为模板,进行褐藻胶裂解酶基因扩增,反应程序:95 ℃预变性5 min,94℃变性45 s,50 ℃退火45 s,72 ℃延伸90 s,30次循环;72 ℃延伸10 min。采用琼脂糖凝胶电泳检测PCR 产物大小,并进行PCR 产物纯化。利用限制性内切酶EcoRI 和HindIII 对目的基因和表达载体pET-28a 进行双酶切,采用DNA 胶回收试剂盒分别回收目的基因和表达载体,它们的连接产物转化至大肠杆菌BL21(DE3)感受态细胞。细胞涂布于LB 固体培养基(含100 μg/mL 卡那霉素),经菌落PCR 验证后,测序鉴定插入序列,获得阳性克隆。
1.4 重组褐藻胶裂解酶的诱导表达及纯化
挑选阳性单菌落接种于5 mL LB 培养基(含50 μg/mL 卡那霉素),于37 ℃、200 r/min 振荡培养过夜。取2 mL 活化菌液接种入200 mL LB 培养基(含50 μg/mL 卡那霉素)中,于37 ℃、200 r/min 振荡培养至OD600介于0.8~0.9 范围。添加终浓度为0.1 mmol/L 的诱导剂——异丙基-β-D-硫代半乳糖苷(IPTG),22 ℃诱导表达14 h。离心收集菌体,加入20 mL 预冷缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,15 mmol/L 咪唑,pH 8.0) 彻底重悬。经冰水浴超声破菌后,于4 ℃、13 000×g 离心15 min,收集上清,参照金属镍螯合琼脂糖凝胶6FF的说明书,利用亲和层析对重组蛋白进行分离纯化。利用SDS-PAGE 检测样品纯度及其分子质量,采用Bradford 法[16]测定蛋白质浓度。
1.5 重组褐藻胶裂解酶的性质研究
1.5.1 褐藻胶裂解酶的活力测定 取145 μL 0.5%(质量分数)褐藻酸钠溶液(以50 mmol/L NaH2PO4-Na2HPO4,pH 7.5 配制),加入5 μL 酶液,30 ℃反应20 min,加入150 μL DNS 试剂,沸水浴10 min,冷却至室温后,于波长540 nm 处测定反应液的吸光度值。褐藻胶裂解酶的活力定义为:在上述条件下,每分钟水解底物产生1 μmoL 还原糖(以葡萄糖计)所需的酶量为1 个酶活力单位(U)。
1.5.2 酶的底物特异性研究 配制0.5%的海藻酸钠、D-聚甘露糖醛酸和L-聚古罗糖醛酸底物溶液,分别加入重组酶,30 ℃下反应20 min,于光波长235 nm 处检测反应液的吸光度值,测定酶的活力,研究酶的底物特异性。
1.5.3 温度对酶活性和稳定性的影响 以海藻酸钠为底物,在20~50 ℃范围测定酶的活力,研究酶的最适反应温度。将重组酶分别置于不同温度下(30,35,40,45,50 ℃和55 ℃)放置0.5~4 h,检测酶的残余活力。以未经处理的酶活力为100%,研究酶的热稳定性。
1.5.4 pH 对酶活性的影响 在pH 6.0~11.0 范围测定重组酶的活性,研究酶的最适作用pH。所用缓冲液为50 mmol/L NaH2PO4-Na2HPO4缓冲液(pH 6.0~8.0),50 mmol/L Tris-HCl 缓冲液(pH 8.0~9.0),50 mmol/L 甘氨酸-NaOH 缓冲液(pH 9.0~11.0)。
1.5.5 金属离子对重组酶活性的影响 在重组酶中分别添加终浓度为1 mmol/L 的不同金属离子(Na+、Li+、K+、Hg+、Mg2+、Ca2+、Mn2+、Ba2+、Ni2+、Zn2+、Co2+、Cu2+、Fe2+、Fe3+、Al3+),37 ℃放置30 min 后检测重组酶的活力。以不添加金属离子的酶活力为100%,研究金属离子对酶活性的影响。
1.5.6 抑制剂和去垢剂对酶活性的影响 在重组酶中分别加入1 mmol/L 或10 mmol/L 的抑制剂(包括EDTA、β-ME、DTT 和PMSF)、0.1%或1%(体积分数或质量分数) 的去垢剂 (包括Tween 20、Tween 80、Triton X-100、SDS 和Chaps),37 ℃放置30 min 后检测酶的活力。以不添加抑制剂或去垢剂的酶活力为100%,研究抑制剂和去垢剂对酶活性的影响。
1.5.7 重组酶的动力学参数测定 分别配制不同质量浓度的海藻酸钠溶液(1.5,2.5,3.5,4.5,5.0 mg/mL),测定重组酶在不同底物浓度下的酶活力。利用Lineweaver-Burk 双倒数作图法,求解酶的Vmax和Km值。
1.6 酶解产物的抗氧化活性研究
配制1.0%(质量分数) 海藻酸钠底物于50 mmol/L Tris-HCl 缓冲液(pH 7.5)中,每100 mL底物溶液中加入0.5 U 重组褐藻胶裂解酶,混匀,30 ℃反应8 h 后,沸水加热10 min 灭活酶蛋白,完全冷却后,10 000×g 离心20 min,除去沉淀。用10 ku 的滤膜过滤,将滤液冷冻干燥至粉末。按照Wu等[17]的方法进行清除ABTS 自由基、·OH 自由基和还原能力的测定。
2 结果
2.1 褐藻胶裂解酶在大肠杆菌中的表达
利用IPTG 对含有重组质粒pET-28a-alg 的阳性转化子进行诱导表达,经SDS-PAGE 分析发现,在40 ku 左右有明显的融合蛋白表达条带(图1,道4)。利用亲和层析进行分离纯化,获得电泳纯的重组褐藻胶裂解酶(图1,道5),分子质量为40.8 ku,酶的比活力1.9 U/mg,纯化倍数23.4,回收率76.3%。

图1 丁香假单孢菌褐藻胶裂解酶基因在大肠杆菌中的表达Fig.1 Expression of alginate lyase gene from P.syringae in E.coli
2.2 重组褐藻胶裂解酶的性质
2.2.1 酶的底物特异性 分别以海藻酸钠、聚甘露糖醛酸和聚古罗糖醛酸为底物,研究酶的底物特异性,结果(图2)显示,重组褐藻胶裂解酶可降解海藻酸钠和聚甘露糖醛酸,不具有降解聚古罗糖醛酸的活性,说明该重组酶为聚甘露糖醛酸裂解酶。
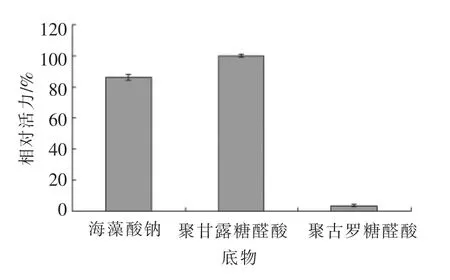
图2 重组褐藻胶裂解酶的底物特异性Fig.2 Substrate specificity of recombinant alginate lyase
2.2.2 温度对酶活性及稳定性的影响 在不同温度下测定重组酶的活力,结果(图3a)显示,重组酶的最适作用温度为30 ℃,在20 ℃时具有44%的酶活力,45 ℃时具有36%的活力,而50 ℃时酶活力为零。酶的热稳定性分析(图3b)显示,重组酶在30,35,40 ℃和45 ℃处理4 h 后,酶仍具有85%以上的活力;在50 ℃处理4 h,酶具有63%的活力;在55 ℃处理1 h,酶具有29%的活力,在该温度下处理2 h,酶活力基本丧失。

图3 温度对重组褐藻胶裂解酶活性(a)及热稳定性(b)的影响Fig.3 Effect of temperature on activity (a) and thermostability (b) of recombinant alginate lyase
2.2.3 pH 值对酶活性的影响 在不同pH 值条件下测定重组褐藻胶裂解酶的活力,结果(图4)显示,酶在pH 7.5 时活力最高。在pH 7.0~9.0 之间保持了较高的活力。该重组酶在pH 10.0 条件下仍具有55%的活力,而在pH 6.5 和11.0 时基本上没有活力。
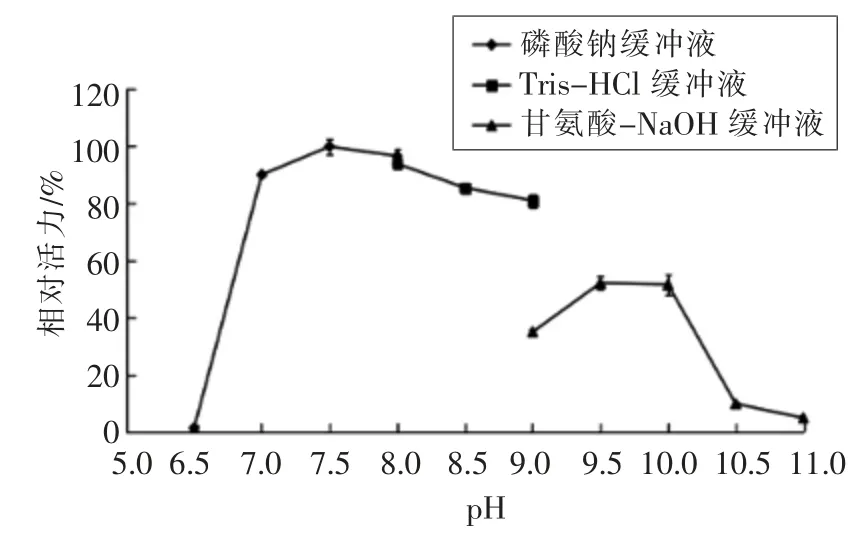
图4 pH 值对重组褐藻胶裂解酶活性的影响Fig.4 Effects of pH on recombinant alginate lyase activity
2.2.4 金属离子对酶活性的影响 1 mmol/L 的不同金属离子对重组褐藻胶裂解酶活性的影响见表1。K+、Na+、Li+、Ca2+、Mg2+和Al3+对重组酶的活性几乎没有影响;Mn2+、Ba2+、Fe3+、Fe2+、Ni2+、Co2+、Cu2+、Zn2+和Hg+对重组酶活性有不同程度的抑制作用,其中Co2+、Cu2+、Zn2+和Hg+几乎完全抑制重组酶的活力。

表1 金属离子对重组褐藻胶裂解酶活性的影响Table 1 Effects of metal ions onactivity of recombinant alginate lyase
2.2.5 抑制剂和去垢剂对酶活性的影响 研究不同的抑制剂和去垢剂对重组褐藻胶裂解酶活性的影响,结果(表2)显示,1 mmol/L 或10 mmol/L 的EDTA 对重组酶表现出微弱的抑制作用;1 mmol/L PMSF 对重组酶活性没有明显的影响,而在10 mmol/L 的高浓度下对重组酶活性的抑制率约47%;1 mmol/L DTT 对重组酶抑制率约11%,添加浓度达10 mmol/L 的情况下,几乎完全抑制酶的活性;β-巯基乙醇对重组酶有激活作用。SDS 对重组酶有强烈的抑制作用,在0.1%或1%的情况下几乎完全抑制酶的活性;重组酶对其它测试的去垢剂 (包括Tween-20、Tween-80、Triton X-100 和Chaps)具有良好的抗性。

表2 抑制剂和去垢剂对重组褐藻胶裂解酶活性的影响Table 2 Effects of inhibitors and detergents on activity of recombinant alginate lyase

图5 酶解产物对ABTS 自由基的清除作用Fig.5 ABTS radical scavenging activity of hydrolysate
2.2.6 重组褐藻胶裂解酶的动力学参数 以不同浓度的海藻酸钠为底物,利用Lineweawer-Burk 双倒数法测定褐藻胶裂解酶的米氏常数,重组酶的Km和Vmax分别为11.17 mg/mL 和14.12 U/mg。
2.3 重组褐藻胶裂解酶酶解产物的抗氧化活性
2.3.1 清除ABTS 自由基的能力 由图5可知,酶解产物对ABTS 自由基的清除作用随着酶解产物质量浓度的增大而增强。当酶解产物质量浓度为3 mg/mL 时,对ABTS 自由基的清除率达到77%。酶解产物对ABTS 自由基的半数抑制剂量IC50为1.56 mg/mL。
2.3.2 清除·OH 自由基的能力 由图6可知,酶解产物对·OH 自由基的清除作用随着酶解产物质量浓度的提高而增强。当酶解产物质量浓度为0.5 mg/mL 时,对·OH 自由基的清除率为51%;此后清除作用的增速变缓,酶解产物质量浓度提至1.0 mg/mL 时,对·OH 自由基的清除率达到77%。酶解产物对·OH 自由基的半数抑制剂量IC50为0.56 mg/mL。
2.3.3 还原能力 还原能力是反映物质抗氧化性能的重要指标。测得吸光度值越高还原力越强,抗氧化性能越好。由图7可知,酶解产物的还原能力随酶解产物质量浓度的增大而增强,还原能力与质量浓度基本呈正比关系。
3 讨论
褐藻胶裂解酶可通过降解褐藻胶制备具有多种生物活性的褐藻胶寡糖。在吴丽云等[15]研究的基础上,本文将丁香假单孢菌的褐藻胶裂解酶进行异源表达、纯化和重组酶的酶学性质研究。
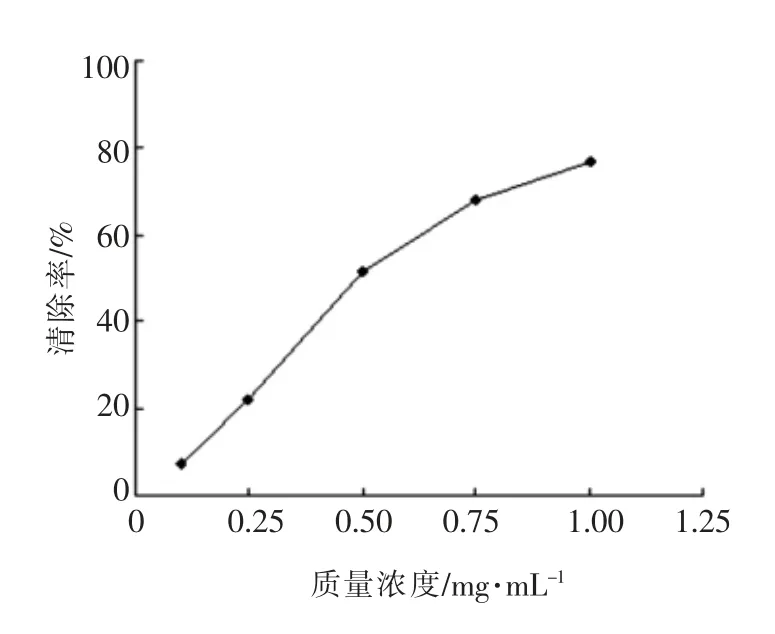
图6 酶解产物对·OH 自由基的清除作用Fig.6 ·OH radical scavenging activity of hydrolysate
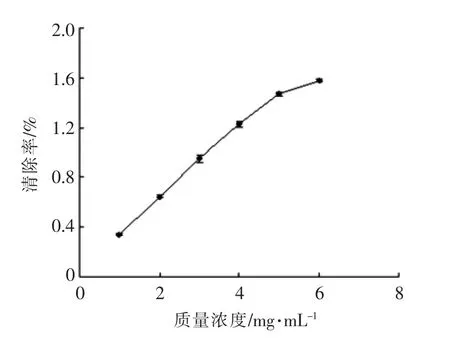
图7 重组褐藻胶裂解酶酶解产物的还原能力Fig.7 Reducing capacity of hydrolysate
本研究中,重组褐藻胶裂解酶具有专一性降解聚甘露糖醛酸活性,属于聚甘露糖醛酸裂解酶,与来源自假单胞菌属 (Pseudomonas sp.QD03)[18]表现出的底物选择性一致。该重组褐藻胶裂解酶的最适反应温度为30℃,与假单胞菌属(Pseudomonas sp.E03)[19]、叶氏假交替单胞菌(Pseudoalteromonas elyakovii)[11]和根瘤农杆菌C58(Agrobacterium tumefaciens strain C58)[20]来源的褐藻胶裂解酶的最适反应温度相同。该重组褐藻胶裂解酶的热稳定性研究表明,将酶在40 ℃下温浴1 h,酶活力基本不受影响;在50 ℃条件下分别放置1 h 和4 h,残余酶活力分别为80%和63%;在55 ℃下放置30 min,残余酶活力仍达39%。源自产黄菌属 (Flavobacterium sp.S20) 的褐藻胶裂解酶[12]在50 ℃下放置1 h,酶活力基本为零,即高温下酶的热稳定性没有本研究中的酶好。假单胞菌属 (Pseudomonas sp.E03) 的褐藻胶裂解酶[19]在40 ℃和50 ℃下温浴1 h,残余酶活力分别约为80%和50%,比本研究中的重组酶较不稳定。本研究中重组褐藻胶裂解酶的最适作用pH7.5,这与假单胞菌属(Pseudomonas sp.QD03)来源的酶[18]最适作用pH 值一致,高于鞘氨醇单胞菌属(Sphingomonas sp.MJ-3)[10](最适pH 为6.5)和酿酒酵母2-40(Saccharophagus degradans 2-40)[21](最适pH 为6.0)来源的酶的最适作用pH 值。
本研究金属离子的影响中,除K+、Na+、Li+、Ca2+、Mg2+和Al3+对酶活性没有明显的影响,其余的一些金属离子对褐藻胶裂解酶有不同程度的抑制作用。其中,Zn2+完全抑制酶的活性,这与Lee 等[9]的研究结果一致。EDTA 对重组褐藻胶裂解酶表现出微弱的抑制作用,与Inoue 等[22]的研究结果一致,而Sakatoku 等[23]的研究表明,EDTA 严重抑制酶的活性。本研究中,1 mmol/L PMSF 对重组酶活性没有明显的影响,而在高浓度下对重组酶活性的抑制率约为47%。Ma 等[11]的研究中,在添加1 mmol/L PMSF 条件下也表现出微弱的抑制作用。另外,本试验中SDS 对重组酶的抑制效果明显,几乎完全抑制,这与一些研究报道相同,例如假单胞菌属(Pseudomonas sp.QD03)来源的褐藻胶裂解酶[18]在添加1 mmol/L SDS 的情况下,其酶活力被完全抑制。除了SDS 以及高浓度的DTT 与PMSF,重组酶对其它抑制剂和去垢剂表现出耐受性,该性质使酶在工业上有一定的应用潜力。
在人体代谢过程中会产生一些活性氧,诱发伤害,例如组织损伤和细胞老化等。人体可以通过摄食一些含有抗氧化性的物质清除这些活性氧。本研究中,酶解产物的体外抗氧化试验表明,酶解产物具有ABTS 和·OH 自由基清除能力及还原能力,具有良好的抗氧化活性,具有作为抗氧化产品的潜力。
