MicroRNA-124对喉鳞状细胞癌细胞自噬、侵袭和迁移的影响
2019-11-29鲁保才郜庆祖余文发卢振民
鲁保才,李 靖,郜庆祖,余文发,卢振民,连 荣,苏 蔚
(1.新乡医学院第一附属医院耳鼻喉科,河南 卫辉 453100;2.新乡医学院第一附属医院病理科,河南 卫辉 453100)
喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)是一种高侵袭性头颈部恶性肿瘤,约占全身恶性肿瘤的1%~5%,已成为呼吸道第2位高发恶性肿瘤[1-2]。随着诊疗技术的进步,LSCC的治疗效果得到了明显改善,但患者的预后仍不佳,5 a生存率较低。相关研究表明,人体细胞自噬是维持机体正常生理平衡和内环境稳态的重要机制,与生长发育及肿瘤发生等过程密切相关[3];自噬调节紊乱是人LSCC发生、发展的重要影响因素[4]。微RNA(microRNA,miRNA)是一类参与多种细胞生理过程的内源性非编码RNA,能够调节数百个靶基因的表达,在细胞生长、增殖、分化和凋亡中发挥不可缺少的作用,但miRNA在人恶性肿瘤中的表达存在显著差异。miR-124是miRNA家族的一员,广泛参与前列腺癌、肝癌、胃癌、乳腺癌等多种恶性肿瘤的增殖、侵袭和转移[5-8];然而,miR-124在人LSCC中的表达特点和作用尚不明确。本研究旨在探讨miR-124在人LSCC组织中的表达及其对LSCC细胞自噬、侵袭和迁移的影响,以期为LSCC的治疗提供新的思路。
1 资料与方法
1.1 一般资料选择2016 年1 月至2018 年9 月新乡医学院第一附属医院耳鼻咽喉科收治的LSCC患者手术切除的癌组织及其匹配的癌旁组织(距肿瘤边缘1~2 cm)标本为观察对象,所有标本手术切除后立即放入液氮保存。纳入标准:患者术前未接受放射治疗、化学治疗,均经病理学检查确诊为LSCC。排除标准:(1)妊娠期妇女;(2)有严重心脑血管疾病者;(3)有重要脏器功能障碍和感染者。本研究共纳入LSCC患者12例,男6例,女6 例,年龄33 ~ 57(44.3±8.2)岁。本研究经医院伦理委员会审核批准,研究对象均签署知情同意书。
1.2 实验细胞人喉鳞状细胞癌细胞株Hep-2购自南京科佰生物科技有限公司,液氮冷冻保存。
1.3 主要试剂与仪器RPMI-1640培养基、胎牛血清(fetal bovine serum,FBS)、二甲基亚砜(dimethyl sulfoxide,DMSO)购自加拿大Gibco公司,无血清Opti培养基购自美国Hyclone 公司,磷酸盐缓冲液(phosphate buffer saline,PBS)购自北京中杉金桥生物技术有限公司,TRIzol裂解液购自日本TaKaRa公司,miRNA反转录试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)试剂盒购自广州天骏生物科技有限公司,基质胶、细胞培养板购自美国Corning 公司,Transwell小室试剂盒购自美国 Novus Biologicals 公司,吉姆萨染色剂购自上海歌凡生物科技有限公司,细胞裂解液购自北京百泰克生物技术有限公司,显色液、二喹啉甲酸(bicinchoninic acid,BCA)试剂盒购自江苏凯基生物技术股份有限公司,微管相关蛋白轻链3B(microtubule-associated protein light chain 3B,LC3B)抗体、3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)抗体购自美国Abcam公司,转染脂质体 2000(lipofectamine 2000)购自上海英潍捷基贸易有限公司,西罗莫司购自上海麦克林生化科技有限公司,3-甲基腺嘌呤(3-methyladenine autophagy inhibitor,3-MA)购自上海阿拉丁生化科技股份有限公司,miR-124 类似物(miR-124 mimics)、miR-124抑制剂(miR-124 inhibitor)、类似物阴性对照(mimics negative control,mimics NC)和抑制剂阴性对照(inhibitor negative control,inhibitor NC)序列均由上海吉玛制药技术有限公司设计与合成;核酸蛋白分析仪、高速冷冻离心机、酶标仪均购自美国 Thermo 公司,凝胶成像仪购自英国Cleaver公司,PCR仪购自深圳市瑞安康科技有限公司。
1.4 实验方法
1.4.1 实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)检测LSCC组织和癌旁组织中miR-124表达取LSCC组织和癌旁组织各100 mg放入瓷研钵中,加入液氮研磨,迅速使用液氮预冷的金属勺将组织样本转移至液氮预冷的EP管中,加入1 mL TRIzol试剂,提取RNA,使用核酸蛋白分析仪检测RNA浓度;对RNA进行反转录,反转录条件为37 ℃ 60 min,85 ℃ 5 min。将反转录得到的cDNA用于qRT-PCR检测,以人U6为内参,miR-124正向引物序列为5′-GCTAAGGCACGCGGTG-3′,反向引物序列为5′-GTGCAGGGTCCGAGGT-3′;U6正向引物为5′-CTCGCTTCGGCAGCACATATACT-3′,反向引物为5′-ACGCTTCACGAATTTGCGTGTC-3′。PCR反应体系:2×All-in-OneTMqPCR Mix 10 μL,All-in-OneTMmiRNA qPCR Primer 2 μL,Universal Adaptor PCR Primer 2 μL,cDNA溶液 2 μL,ROX Reference Dye 0.2 μL,RNase Free dH2O 3.8 μL。实验操作根据miRNA PCR试剂盒说明书进行,PCR反应条件: 95 ℃变性10 s,58 ℃退火20 s,72 ℃延伸10 s,共40个循环。应用2-△△Ct法计算miR-124的相对表达量。每个样本重复3次,取均值。
1.4.2 细胞培养、分组及处理将人Hep-2细胞置于2 mL含有体积分数10% FBS的达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)中,于37 ℃、含体积分数5% CO2的细胞孵箱中培养,细胞融合度达80%以上时,胰蛋白酶消化,传代培养,待细胞融合度达50%~60%时,根据处理条件分为miR-124 mimics组、miR-124 inhibitor组、mimics NC组、inhibitor NC组、mimics+西罗莫司组和inhibitor+3-MA组。miR-124 mimics组、miR-124 inhibitor组、mimics NC组及inhibitor NC组细胞的DMEM培养基更换为1.5 mL Opti培养基;mimics+西罗莫司组和inhibitor+3-MA组细胞的DMEM培养基更换为1.5 mL Opti培养基,mimics+西罗莫司组细胞加入200 mmol·L-1的西罗莫司2 μL,inhibitor+3-MA组细胞加入10 g·L-1的3-MA 2 μL;然后,吸取5 μL miR-124 mimics、miR-124 inhibitor、mimics NC、inhibitor NC加入装有 250 μL Opti培养基的无菌EP管中,吸取5 μL 转染脂质体2000加入到另外装有250 μL Opti培养基的无菌EP管中,吹打混匀,室温静置5 min后将以上2管液体混匀,室温静置20 min。然后将混合液加入到已加有1.5 mL Opti培养基的各组细胞中,轻柔混匀。置于37 ℃、含体积分数5% CO2的细胞孵箱中培养4~6 h,将孔中的液体换成2 mL含体积分数10% FBS的DMEM培养基,继续培养,2 d后收集细胞用于后续实验。
1.4.3 qRT-PCR法检测过表达及干扰表达miR-124的细胞中miR-124的表达将转染2 d后的miR-124 mimics组、mimics NC组、miR-124 inhibitor组、inhibitor NC组细胞用PBS洗3次,吸干PBS后加入1 mL TRIzol,常温裂解5 min,提取RNA。按照“1.4.1项”方法进行反转录和miRNA qRT-PCR检测。
1.4.4 Western blot 法检测LSCC组织、癌旁组织和Hep-2细胞和癌旁组织中自噬相关蛋白LC3B-Ⅱ的表达取LSCC组织和癌旁组织标本各100 mg,剪碎后置于EP管中,加入0.5 mL 裂解液;取“1.4.2项”培养的miR-124 mimics组、mimics NC组、miR-124 inhibitor组、inhibitor NC组细胞,PBS洗3次,使用细胞刮将细胞刮下并转移至1.5 mL离心管中,4 ℃ 1 000 r·min-1离心3 min,弃上清液,加入0.2 mL裂解液;在冰上对组织和细胞进行超声裂解后,4 ℃ 12 000 r·min-1离心,吸取上清液并检测浓度。取30 μg蛋白样品进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分离,切胶后进行转膜,以脱脂奶粉室温封闭1 h,分别加入LC3B、GAPDH抗体一抗(11 000)孵育,4 ℃过夜后进行洗膜,加入二抗(15 000),室温孵育1 h后进行洗膜和曝光。
1.4.5 Transwell侵袭实验检测各组细胞侵袭能力使用无血清DMEM稀释4 ℃过夜融化的基质胶(51),吸取55 μL稀释液均匀铺于Transwell小室上室底部,将Transwell小室置于37 ℃恒温箱中孵育2 h,然后置于紫外灯下照射30 min。取“1.4.2项”培养好的miR-124 mimics组、miR-124 inhibitor组、mimics NC组、inhibitor NC组、mimics+西罗莫司组和inhibitor+3-MA组的细胞,用不含血清的细胞培养液配制成单细胞悬液,调整细胞密度为1×106L-1,吸取200 μL接种于Transwell小室上室底部,下室添加500 μL含体积分数20% FBS的培养基,注意避免产生气泡。将Tranwell小室置于37 ℃恒温孵育箱中,36 h后使用棉签将Transwell小室内壁膜上的细胞轻轻擦去,将小室置于体积分数95%乙醇中固定30 min,用水轻轻漂洗,使用吉姆萨染色剂进行染色,显微镜下观察,视野中出现的有核细胞即为侵袭细胞,随机选取5个视野计数侵袭细胞数目,取均值。
1.4.6 划痕实验检测各组细胞迁移能力取“1.4.2项”培养好的各组细胞。按照每孔6×105个细胞接种于6孔板,待细胞融合度达90%时,在每个孔的底部距离直径0.5 cm处使用200 μL无菌枪头平行划2道直线,分别于0、72、96 h时将培养基换为PBS,然后在显微镜下拍照,测量划痕宽度,计算愈合率,划痕愈合率=[(0 h宽度-测量时宽度)/0 h宽度]×100%。
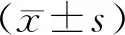
2 结果
2.1 LSCC组织和癌旁组织中miR-124表达比较LSCC组织和癌旁组织中miR-124相对表达量分别为0.160±0.038、1.237±0.072,LSCC组织中miR-124相对表达量显著低于癌旁组织,差异有统计学意义(P<0.05)。
2.2 LSCC组织和癌旁组织中自噬蛋白LC3B-Ⅱ表达比较结果见图1。LSCC组织和癌旁组织中LC3B-Ⅱ的相对表达量分别为1.92±0.06、0.91±0.04,LSCC组织中LC3B-Ⅱ蛋白相对表达量显著高于癌旁组织,差异有统计学意义(P<0.05)。
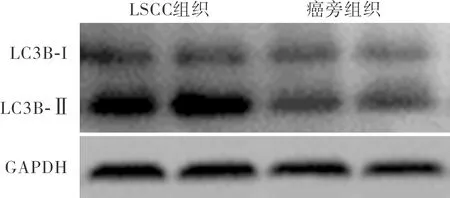
图1 LSCC组织和癌旁组织中自噬蛋白LC3B-Ⅱ的表达
Fig.1 Expression of autophagy-related protein LC3B-Ⅱ in LSCC tissues and paracancerous tissues
2.3 过表达和干扰表达miR-124的细胞中miR-124相对表达量比较miR-124 mimics组、mimics NC组、miR-124 inhibitor组、inhibitor NC组细胞中miR-124相对表达量分别为50.11±4.41、2.37±0.18、0.51±0.07、2.53±0.10。miR-124 mimics组细胞中miR-124相对表达量显著高于mimics NC组,差异有统计学意义(P<0.05);miR-124 inhibitor组细胞中miR-124相对表达量显著低于inhibitor NC组,差异有统计学意义(P<0.05)。
2.4 过表达和干扰表达miR-124的细胞中自噬蛋白LC3B-Ⅱ表达量比较结果见图2。 mimics NC组、miR-124 mimics组、inhibitor NC组、miR-124 inhibitor组细胞中LC3B-Ⅱ蛋白相对表达量分别为0.32±0.02、0.12±0.03、0.21±0.05、2.31±0.09。miR-124 mimics组细胞中LC3B-Ⅱ蛋白相对表达量显著低于mimics NC组,差异有统计学意义(P<0.05);miR-124 inhibitor组细胞中LC3B-Ⅱ蛋白相对表达量显著高于inhibitor NC组,差异有统计学意义(P<0.05)。
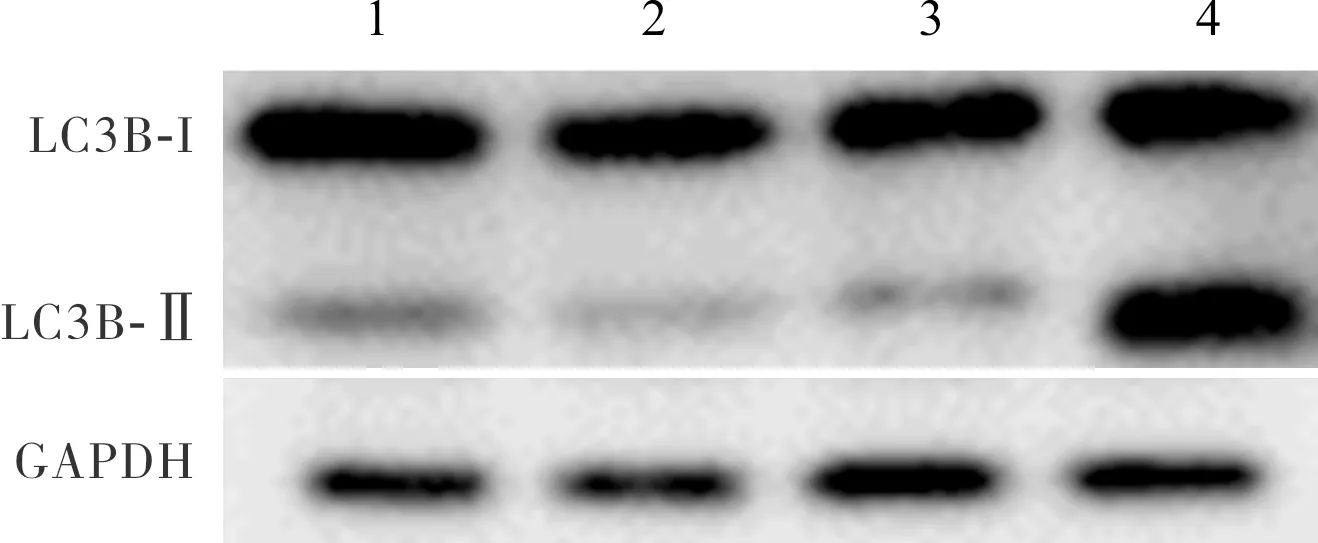
1:mimics NC组;2:miR-124 mimics组;3:inhibitor NC组;4:miR-124 inhibitor组。
图2 过表达和干扰表达miR-124的细胞中自噬蛋白LC3B-Ⅱ的表达
Fig.2 Expression of autophagy-related protein LC3B-Ⅱ in miR-124-upregulated and miR-124-downregulated cells
2.5 各组细胞侵袭细胞数比较结果见图3。miR-124 mimics组、mimics NC组、mimics+西罗莫司组、miR-124 inhibitor组、inhibitor NC组和inhibitor+3-MA组侵袭细胞数分别为22.2±2.1、56.7±5.4、50.3±4.8、111.5±7.3、42.4±2.5和56.3±3.4个。miR-124 mimics组侵袭细胞数显著少于mimics NC组和mimics+西罗莫司组,差异有统计学意义(P<0.05);miR-124 inhibitor组侵袭细胞数显著多于inhibitor NC组和inhibitor+3-MA组,差异有统计学意义(P<0.05)。

A:mimics NC组;B:miR-124 mimics组;C:mimics+西罗莫司组;D:inhibitor NC组;E:miR-124 inhibitor组;F:inhibitor+3-MA组。
图3 各组细胞侵袭能力
Fig.3 Cell invasion abilities in each group
2.6 各组细胞迁移能力比较培养72 h后,miR-124 inhibitor组、inhibitor NC组和inhibitor+3-MA组细胞的划痕愈合率分别为(91.3±1.6)%、(78.2±2.8)%、(75.4±3.9)%;inhibitor NC组和inhibitor+3-MA组细胞的划痕愈合率低于miR-124 inhibitor组,差异有统计学意义(P<0.05)。培养96 h后,miR-124 mimics组、mimics NC组和mimics+西罗莫司组细胞的划痕愈合率分别为(82.2±2.1)%、(96.2±1.9)%、(94.6±5.7)%;mimics NC组和mimics+西罗莫司组细胞的划痕愈合率高于miR-124 mimics组,差异有统计学意义(P<0.05)。
3 讨论
LSCC的侵袭转移是受多因素调控的过程,是影响患者预后的关键因素。研究显示,miRNA和自噬对LSCC侵袭转移起重要的调控作用[9],因此,干预LSCC的 miRNA表达和自噬活动为治疗LSCC提供了新思路。
miRNA是一类参与多种细胞过程的内源性非编码RNA,含有18~22个核苷酸,可通过绑定mRNA的3′-UTR端从而下调靶基因的表达[10]。miRNA的表达水平与肿瘤活动密切相关,其调控肿瘤细胞生理、病理过程,发挥致癌或抑癌作用。研究表明,LSCC与miRNA表达密切相关,LSCC组织中异常表达的miRNA可以作为一种生物标志物为判定肿瘤的进展提供重要参考[4,11]。miR-124作为miRNA家族的一员,广泛参与前列腺癌、肝癌、胃癌、乳腺癌等多种恶性肿瘤的增殖、侵袭和转移[5-8],但其在LSCC中的表达特点和作用尚不明确。本研究旨在探究LSCC组织中miR-124表达及其对LSCC侵袭和转移的影响,首先观察了miR-124在LSCC患者癌组织及癌旁组织标本中的表达,结果显示,LSCC组织中miR-124的相对表达量显著低于癌旁组织,提示miR-124在LSCC中发挥抑癌功能。但本研究的样本量较小,尚不足以证明miR-124能够作为预测LSCC预后的标志物。本研究结果显示,miR-124 mimics组细胞中miR-124相对表达量显著高于mimics NC组,miR-124 inhibitor组细胞中miR-124相对表达量显著低于inhibitor NC组,说明相对于mimics NC组,转染miR-124 mimics显著提高人Hep-2细胞中miR-124表达量;而相对于inhibitor NC组,转染miR-124 inhibitor显著降低人Hep-2细胞中miR-124表达量;提示过表达和干扰表达miR-124的细胞模型的转染效率显著,能够用于后续实验。
自噬是广泛存在于真核细胞中的细胞器更新过程,当细胞处于饥饿或受损状态时,细胞内自噬增强并产生自体吞噬,为细胞合成代谢提供必需原料。目前研究发现,自噬与肿瘤的侵袭和迁移关系密切,当肿瘤细胞发生侵袭迁移时,其细胞内自噬常常发生变化,提示自噬在该过程发挥重要作用[12]。已有研究报道,LC3B-Ⅱ与自噬关系密切,在自噬过程中吞噬物被双层膜包裹,成为自噬小体,运往溶酶体进行降解,自噬相关蛋白LC3-Ⅱ是双层膜的重要组成部件[13],因此,LC3B-Ⅱ蛋白表达水平与自噬水平有关,LC3B-Ⅱ表达量高说明自噬活跃。在本研究中,与癌旁组织相比,LSCC组织中LC3B-Ⅱ蛋白表达量明显上调,表明LSCC组织中自噬增强,提示自噬可能参与了LSCC的发生、发展过程,起促癌作用。另外,本研究结果显示,miR-124 mimics组细胞中LC3B-Ⅱ蛋白表达下调,明显低于mimics NC组;miR-124 inhibitor组细胞中LC3B-Ⅱ蛋白表达上调,明显高于inhibitor NC组;提示过表达miR-124以后,Hep-2细胞的自噬水平下调;干扰miR-124以后,Hep-2细胞的自噬水平上调;提示miR-124在Hep-2细胞中发挥抑制自噬的作用。
西罗莫司为自噬激动剂,可通过抑制mTOR通路而诱导和促进细胞自噬的发生;3-MA为自噬抑制剂,能够通过抑制Ⅲ型PI3K来阻断自噬体形成,从而抑制自噬[14]。本研究细胞侵袭实验显示,miR-124 mimics组侵袭细胞数显著少于mimics NC组和mimics+西罗莫司组,miR-124 inhibitor组侵袭细胞数显著多于inhibitor NC组和inhibitor+3-MA组;过表达miR-124明显抑制了LSCC细胞的侵袭能力,但加入自噬激动剂后明显恢复LSCC细胞的侵袭能力;抑制miR-124表达明显促进LSCC细胞的侵袭,当加入自噬抑制剂后明显削弱了细胞癌细胞的侵袭能力。而细胞迁移实验结果显示,培养72 h后,inhibitor NC组和inhibitor+3-MA组细胞的划痕愈合率显著低于miR-124 inhibitor组;培养96 h后,mimics NC组和mimics+西罗莫司组细胞的划痕愈合率高于miR-124 mimics组。上述结果提示,过表达miR-124明显抑制了LSCC细胞的迁移能力,但加入自噬激动剂后明显恢复LSCC细胞的迁移能力;抑制miR-124表达明显促进LSCC细胞的迁移能力,当加入自噬抑制剂后明显削弱了细胞癌细胞的迁移能力。因此,miR-124可能通过抑制自噬发挥抑癌作用。但仍然需要进一步明确miR-124作用于自噬通路的靶基因,以完整阐述miR-124调控LSCC细胞侵袭和迁移的机制。
综上所述,人LSCC组织中miR-124表达显著下调,人LSCC组织中以及miR-124过表达细胞中自噬相关蛋白LC3B-Ⅱ显著上调,miR-124可能通过抑制自噬而抑制LSCC细胞的侵袭和迁移。该研究为探讨LSCC的发病机制及临床治疗提供了新的方法和思路。
