Adropin对脂肪细胞自噬及磷脂酰肌醇-3激酶/丝氨酸苏氨酸蛋白激酶通路的影响
2019-11-29李凤丽李茂山康志强
李凤丽,李茂山,何 丽,罗 方,康志强
(1.郑州大学附属郑州中心医院内分泌科,河南 郑州 450007; 2.河南省直第三人民医院骨科,河南 郑州 450006)
随着生活水平的提高,我国居民高能量食物的摄入不断增加,机体摄入的过剩糖类、脂质等转化为脂类物质过量积累,导致肥胖发生率越来越高,进而引起代谢性疾病的发生,如糖尿病、高血压、脂肪肝和冠状动脉粥样硬化性心脏病等,严重威胁人类健康[1-2]。Adropin是由能量平衡基因(energy homeostasis associated gene,Enho)编码的分泌性蛋白,在不同种属间具有高度同源性,其主要表达于胰腺、肝脏、肾脏、冠状动脉、脐动脉和脑组织等[3]。研究显示,Adropin可抑制脂类生成及肝脏中脂肪的合成,可能是影响机体肥胖的重要因素之一[4]。Adropin不仅具有调节脂类代谢、改善胰岛素抵抗的作用,同时,还能通过调节葡萄糖介导的胰岛素释放而调节蛋白质和碳水化合物的代谢[5-7]。研究发现,脂类可以参与细胞自噬,而自噬可调控脂质代谢,纠正肥胖导致的代谢紊乱,进而治疗肥胖[8-9],因此,Adropin可能通过调控自噬治疗肥胖。但目前Adropin对脂肪细胞自噬的影响尚不明确。磷脂酰肌醇-3激酶/丝氨酸苏氨酸蛋白激酶(phosphatidylinositol 3 kinase/protein kinase B,PI3K/AKT)通路参与介导细胞自噬,miR-138可通过靶向抑制人黑色素瘤A2058细胞中3-磷酸肌醇依赖性蛋白激酶1(3-phosphoinositide-dependent protein kinase-1,PDK1)蛋白的表达而抑制PI3K/AKT/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路,进而促进细胞自噬,诱导细胞凋亡;Adropin可通过下调细胞外信号调节激酶1/2(extracellular signal regulated kinase 1 and 2,Erk1/2)表达及上调PI3K/AKT通路而抑制人主动脉平滑肌细胞的迁移和增殖[10-11];因此考虑,Adropin可能通过调节PI3K/AKT通路而介导脂肪细胞自噬。本研究以Adropin处理成熟脂肪细胞,旨在探讨其对脂肪细胞自噬及PI3K/AKT通路的影响。
1 材料与方法
1.1 细胞小鼠胚胎成纤维前脂肪细胞株3T3-L1(前体脂肪细胞)购自上海酶研生物科技有限公司,保存于郑州市自身免疫性内分泌疾病重点实验室。
1.2 主要试剂与仪器Adropin购自美国Selleck公司,西罗莫司购自美国MedChemexpress公司,异丁基-甲基-黄嘌呤、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)购自上海生工生物工程股份有限公司,地塞米松、油红O购自上海恒斐生物科技有限公司,胰岛素购自上海研卉生物科技有限公司,达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、胎牛血清、胰蛋白酶、青链霉素购自美国Gibco公司,细胞自噬染色检测试剂盒购自北京雷根生物技术有限公司,抗微管相关蛋白轻链3(anti-microtubule-associated protein 1 light chain3,Anti-LC3)、Anti-Beclin1、Anti-P62、Anti-PI3K、抗磷酸化PI3K(anti-phosphorylated-PI3K,Anti-p-PI3K)、Anti-AKT、抗磷酸化AKT(anti-phosphorylated-AKT,Anti-p-AKT)、Anti-GAPDH、Alexa Fluor 488标记的羊抗兔二抗购自美国Abcam公司,二喹啉甲酸(bicinchoninic acid,BCA)试剂盒、蛋白裂解液购自上海碧云天生物技术有限公司,单丹磺酰尸胺(monodansylcadaverine,MDC)染色试剂盒购自北京雷根生物技术有限公司;Olympus CKX41显微镜、CKX53倒置相差显微镜、BX63自动荧光显微镜购自日本Olympus 公司,Centrifuge 5424R低温高速离心机购自德国Eppendorf公司,1659001蛋白电泳仪、Trans-Blot SD半干转膜仪购自美国Bio-Rad公司。
1.3 培养基配置500 mL高糖DMEM中加入体积分数10%胎牛血清50 mL、100×103U·L-1青链霉素5 mL,震荡混匀后即为完全培养基;向500 mL完全培养基中加入0.25 mmol异丁基-甲基-黄嘌呤、5 μmol 地塞米松、5 μg胰岛素,即为诱导分化培养基A;向500 mL完全培养基中加入5 μg胰岛素即为诱导分化培养基B。
1.4 细胞培养、诱导分化及分组取原装细胞瓶中保存的3T3-L1细胞,接种于含有5 mL完全培养基的25 cm2培养瓶中,置于37 ℃、含体积分数5% CO2的恒温培养箱中培养,2 d换完全培养基1次,待细胞在瓶底铺至70%~80%时,用胰蛋白酶消化,然后接种于24孔板中,待细胞铺满培养孔,参照文献[12]方法进行诱导分化:将24孔板中的完全培养基更换为诱导分化培养基A,培养48 h后更换为诱导分化培养基B,继续培养48 h,弃去诱导分化培养基B,更换为完全培养基,继续培养10 d,每 2 d 更换1次,诱导分化结束后弃去培养基,采用磷酸盐缓冲液(phosphate buffered solation,PBS)冲洗3次,使用 40 g·L-1多聚甲醛1 mL固定2 h,加入体积分数0.3%油红O染液250 μL,室温染色1 h,吸去染液,加入体积分数60%异丙醇250 μL处理 5 min,在200倍光学显微镜下观察脂滴着色情况,观察到细胞中有红色脂滴即表示脂肪细胞分化成熟。取诱导分化成熟的脂肪细胞,经胰蛋白酶消化后接种于3个24孔板中,随机分为对照组、Adropin组、自噬激动剂组及Adropin+自噬激动剂组;对照组细胞不予特殊处理,Adropin组细胞加入Adropin(终浓度为 1 μmol·L-1)[13],自噬激动剂组加入西罗莫司(终浓度为100 nmol·L-1)[14],Adropin+自噬激动剂组细胞加入Adropin(终浓度为 1 μmol·L-1)和西罗莫司(终浓度为100 nmol·L-1),继续培养2 h,以备后续实验使用。
1.5 MDC染色检测各组细胞自噬空泡取1个24孔板的细胞,弃去培养基,PBS漂洗,使用MDC染色试剂盒染色,具体操作步骤参照说明书进行,荧光显微镜进行观察,细胞中的自噬空泡被染为绿色。每组细胞随机选取5个视野,计数自噬空泡数目,得出各组细胞自噬空泡相对含量,以对照组自噬空泡数为参照,设定为100%,实验组细胞自噬空泡相对含量=实验组自噬空泡数/对照组自噬空泡数×100%,实验重复3次,取均值。
1.6 免疫荧光染色检测各组细胞中微管相关蛋白轻链3(microtubule associated protein light chain 3,LC3)表达取1个24孔板的细胞,以PBS漂洗,40 g·L-1多聚甲醛固定,牛血清白蛋白(含有体积分数0.5%TritonX-100)封闭,然后经LC3一抗、Alexa Fluor 488标记的羊抗兔二抗、DAPI染剂分别避光孵育后,在荧光显微镜下观察细胞着色情况,DAPI着色于细胞核,细胞核为蓝色;LC3着色于细胞质,LC3阳性细胞的细胞质为红色。每组随机选取5个视野,分别计数总细胞数(即DAPI阳性细胞)、LC3阳性细胞数,计算各组LC3阳性细胞所占比例,LC3阳性细胞比例= LC3阳性细胞数/总细胞数×100%。实验重复3次,取均值。
1.7 Western blot法检测各组细胞自噬相关蛋白及PI3K/AKT通路蛋白表达取1个24孔板的细胞,胰蛋白酶消化处理后,收集各组细胞,加入200 μL蛋白裂解液,4 ℃裂解后提取总蛋白,以BCA试剂盒测定总蛋白浓度,具体操作步骤参照说明书进行。蛋白置于水浴锅中煮沸5 min,根据测定结果,各组分别取含20 μg蛋白的样品液在电泳仪中进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,然后将蛋白转移至聚偏氟乙烯膜上,以脱脂奶粉室温封闭2 h后,依据目的蛋白相对分子质量截取蛋白条带置于小盒中,加入相应一抗(Beclin-1、LC3-Ⅰ、LC3-Ⅱ、p62、p-PI3K、PI3K、p-AKT、AKT,以GAPDH作为内参,11 000比例稀释),4 ℃孵育过夜;加入二抗(15 000),室温孵育1~2 h,采用增强化学发光法显色,以Tanon软件拍摄图像并分析Beclin-1、LC3-Ⅱ、p62、p-PI3K、PI3K、p-AKT、AKT蛋白的相对表达量。实验重复3次,取均值。
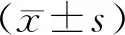
2 结果
2.1 3T3-L1细胞诱导分化结果结果见图1。3T3-L1细胞形态为梭形,贴壁生长。诱导分化10 d后,油红O染色,细胞中出现红色脂滴,表明细胞已分化为成熟脂肪细胞。
A:3T3-L1细胞;B:成熟脂肪细胞。
图1 3T3-L1细胞诱导分化成熟脂肪细胞的鉴定(油红O染色,×200)
Fig.1 Identification of mature adipocytes induced by 13T3-L1 cells (Oil red O staining,×200)
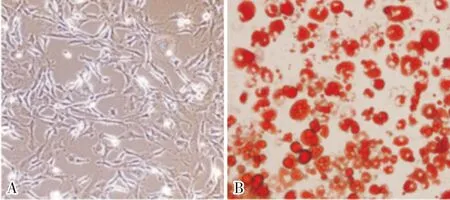
2.2 各组细胞中自噬空泡相对含量比较结果见图2。对照组、Adropin组、自噬激动剂组、Adropin+自噬激动剂组细胞中自噬空泡相对含量分别为(100.00±0.00)%、(23.63±5.21)%、(207.59±51.33)%、(92.78±20.22)%。与对照组比较,Adropin组细胞中自噬空泡相对含量降低,自噬激动剂组细胞中自噬空泡相对含量升高,差异有统计学意义(P<0.05);Adropin+自噬激动剂组与对照组细胞自噬空泡相对含量比较差异无统计学意义(P>0.05)。与Adropin组比较,自噬激动剂组、Adropin+自噬激动剂组细胞中自噬空泡相对含量显著升高,差异有统计学意义(P<0.05)。与自噬激动剂组比较,Adropin+自噬激动剂组细胞中自噬空泡相对含量显著降低,差异有统计学意义(P<0.05)。
A:对照组;B:Adropin组;C:自噬激动剂组;D:Adropin+自噬激动剂组。
图2 各组细胞中自噬空泡表达结果(MDC染色,×400)
Fig.2 expression of autophagy vacuole in the cells of each group (MDC staining ,×400)
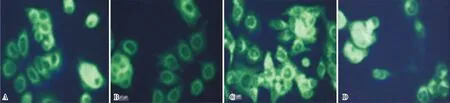
2.3 各组细胞LC3阳性细胞比例比较结果见图3。对照组、Adropin组、自噬激动剂组、Adropin+自噬激动剂组LC3阳性细胞比例分别为(28.93±5.13)%、(10.03±2.23)%、(66.57±7.79)%、(26.08±4.92)%。与对照组比较,Adropin组细胞LC3阳性细胞比例显著降低,自噬激动剂组细胞LC3阳性细胞比例显著升高,差异有统计学意义(P<0.05);Adropin+自噬激动剂组与对照组细胞LC3阳性细胞比例比较差异无统计学意义(P>0.05 )。与Adropin组比较,自噬激动剂组、Adropin+自噬激动剂组细胞LC3阳性细胞比例显著升高,差异有统计学意义(P<0.05)。与自噬激动剂组比较,Adropin+自噬激动剂组细胞LC3阳性细胞比例显著降低,差异有统计学意义(P<0.05)。
A:对照组;B:Adropin组;C:自噬激动剂组;D:Adropin+自噬激动剂组。
图3 各组细胞LC3阳性细胞染色结果(免疫荧光染色,×400)
Fig.3 Results of LC3 positive cell staining in each group(immunofluorescence staining ,×400)
2.4 各组细胞中自噬相关蛋白相对表达量比较结果见图4和表1。与对照组比较,Adropin组细胞中Beclin-1、LC3-Ⅱ 蛋白相对表达量显著降低,p62蛋白相对表达量显著升高,自噬激动剂组细胞中Beclin-1、LC3-Ⅱ 蛋白相对表达量显著升高,p62蛋白相对表达量显著降低,差异均有统计学意义(P<0.05);Adropin+自噬激动剂组与对照组细胞中Beclin-1、LC3-Ⅱ、p62蛋白相对表达量比较差异无统计学意义(P>0.05)。与Adropin组比较,自噬激动剂组、Adropin+自噬激动剂组细胞中Beclin-1、LC3-Ⅱ蛋白相对表达量显著升高,p62蛋白相对表达量显著降低,差异有统计学意义(P<0.05)。与自噬激动剂组比较,Adropin+自噬激动剂组细胞Beclin-1、LC3-Ⅱ蛋白相对表达量显著降低,p62蛋白相对表达量显著升高,差异有统计学意义(P<0.05)。
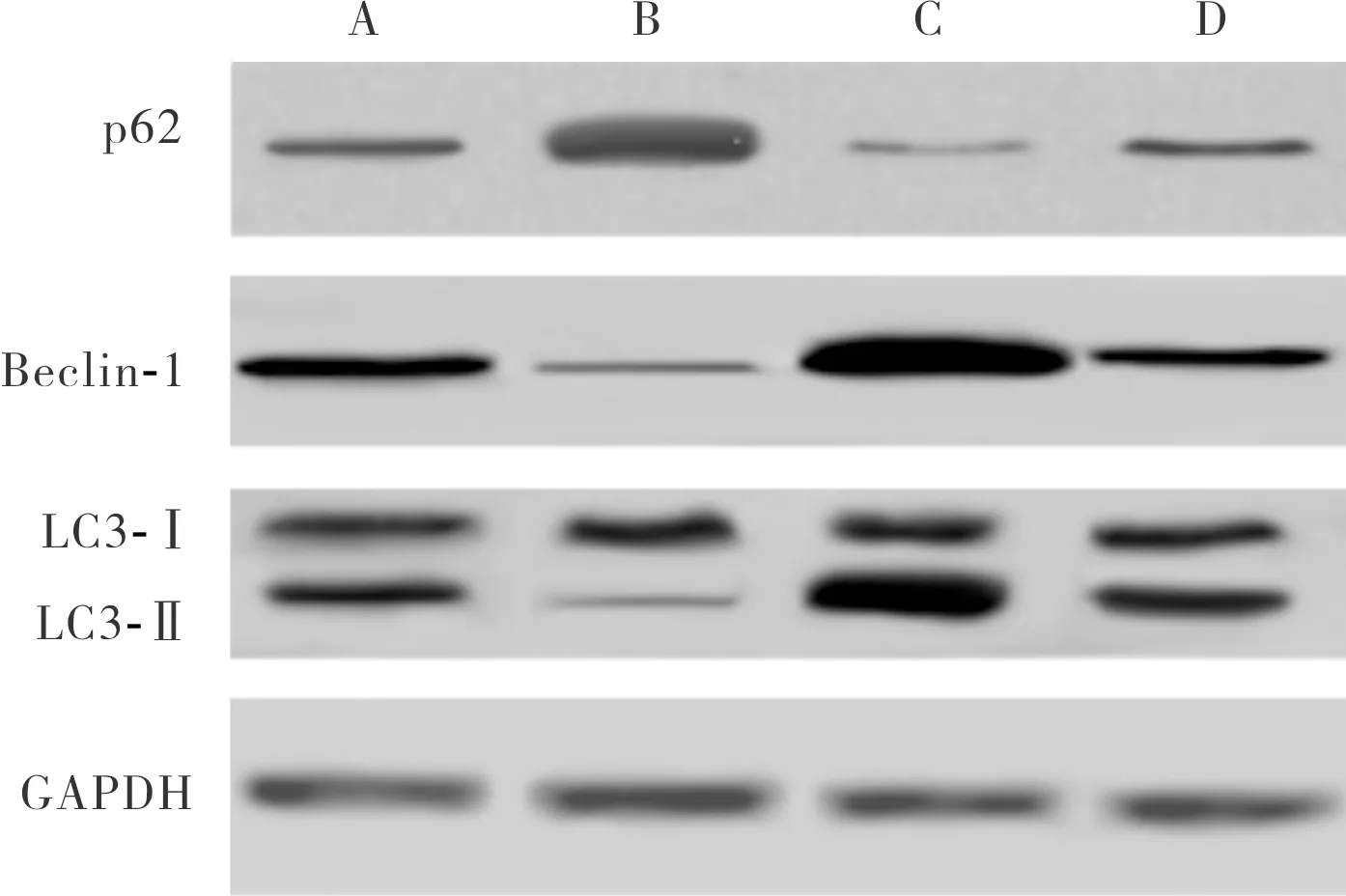
A:对照组;B:Adropin组;C:自噬激动剂组;D:Adropin+自噬激动剂组。
图4 各组细胞中自噬相关蛋白Beclin-1、LC3、p62的表达
Fig.4 Expression of autophagy-related proteins Beclin-1, LC3 and p62 in cells of each group(Western blot)
表1 4组细胞中自噬相关蛋白Beclin-1、LC3-II、P62相对表达量比较

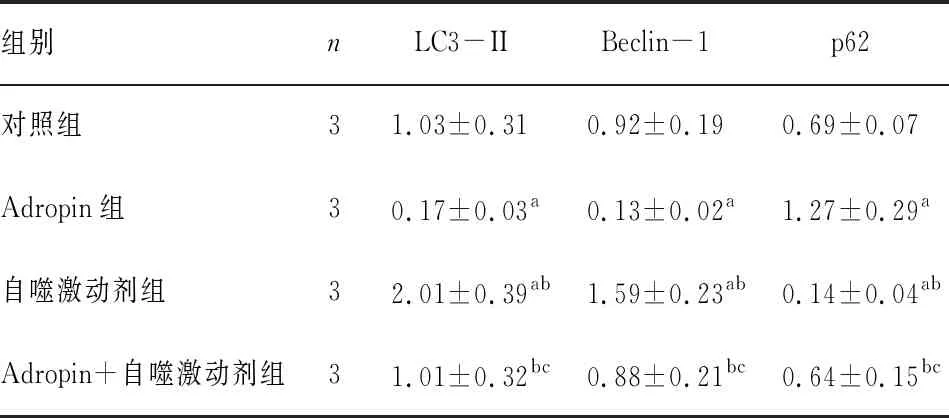
组别nLC3-IIBeclin-1p62对照组31.03±0.310.92±0.190.69±0.07Adropin组30.17±0.03a0.13±0.02a1.27±0.29a自噬激动剂组32.01±0.39ab1.59±0.23ab0.14±0.04abAdropin+自噬激动剂组31.01±0.32bc0.88±0.21bc0.64±0.15bc
注:与对照组比较aP<0.05;与Adropin组比较bP<0.05;与自噬激动剂组比较cP<0.05。
2.5 各组细胞中PI3K/AKT 通路相关蛋白相对表达量比较结果见图5、表2。与对照组比较,Adropin组细胞中p-PI3K、p-AKT蛋白相对表达量显著升高,自噬激动剂组细胞中p-PI3K、p-AKT蛋白相对表达量显著降低,差异有统计学意义(P<0.05);Adropin+自噬激动剂组与对照组细胞中p-PI3K、p-AKT蛋白相对表达量比较差异无统计学意义(P>0.05)。与Adropin组比较,自噬激动剂组、Adropin+自噬激动剂组细胞中p-PI3K、p-AKT蛋白相对表达量显著降低,差异有统计学意义(P<0.05)。与自噬激动剂组比较,Adropin+自噬激动剂组细胞p-PI3K、p-AKT蛋白相对表达量显著升高,差异有统计学意义(P<0.05)。4组细胞中PI3K、AKT蛋白相对表达量两两比较差异均无统计学意义(P>0.05)。
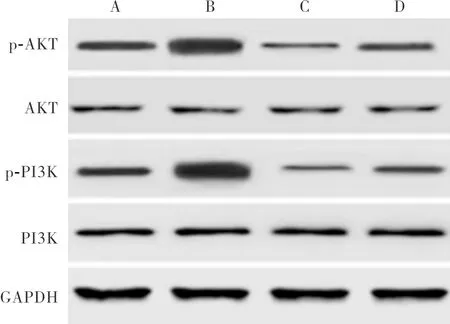
A:对照组;B:Adropin组;C:自噬激动剂组;D:Adropin+自噬激动剂组。
图5 各组细胞中PI3K/AKT 通路蛋白p-PI3K、PI3K、AKT、p-AKT的表达(Western blot)
Fig.5 Expression of PI3K/AKT pathway proteins p-PI3K, PI3K, AKT and p-AKT in cells of each group(Western blot)
表2 4组细胞中PI3K/AKT 通路蛋白p-PI3K、PI3K、AKT、p-AKT相对表达量比较

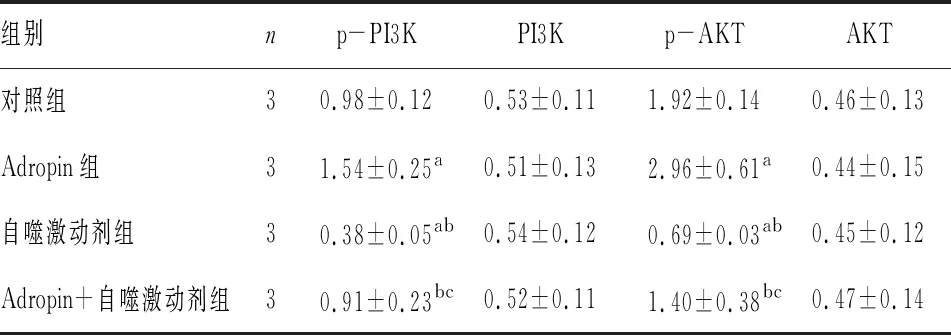
组别np-PI3KPI3Kp-AKTAKT对照组30.98±0.120.53±0.111.92±0.140.46±0.13Adropin组31.54±0.25a0.51±0.132.96±0.61a0.44±0.15自噬激动剂组30.38±0.05ab0.54±0.120.69±0.03ab0.45±0.12Adropin+自噬激动剂组30.91±0.23bc0.52±0.111.40±0.38bc0.47±0.14
注:与对照组比较aP<0.05;与Adropin组比较bP<0.05;与自噬激动剂组比较cP<0.05。
3 讨论
肥胖与多种代谢性疾病如2型糖尿病、脂肪肝和心血管疾病等的发生相关,因此,对肥胖及代谢紊乱相关疾病的研究具有重要临床意义[15]。Adropin参与体内脂质代谢,敲除小鼠Enho基因可使小鼠脂肪组织增加50%,引起小鼠肥胖;过表达Enho基因或以Adropin治疗后可减少脂肪合成,减轻其体质量;因此,Enho基因编码的Adropin可能具有调节脂肪细胞的作用[16]。机体内的能量物质氨基酸、葡萄糖与脂滴等可通过不同途径参与细胞自噬,研究发现,敲除小鼠自噬相关基因7可使脂肪组织的自噬活性降低,脂肪组织减少,提示自噬对调节机体脂质代谢平衡至关重要[17]。
3T3-L1是一种胚胎成纤维细胞,可诱导分化为成熟脂肪细胞,因此又称为前体脂肪细胞,是研究脂肪细胞分化调控机制的经典模型细胞,3T3-L1需要经过2个细胞周期的增殖后再在成脂分化诱导下经过2次诱导分化才能培养为成熟脂肪细胞。本研究以3T3-L1诱导分化的成熟脂肪细胞作为研究对象,将3T3-L1经过2次诱导分化培养基的培养,结果显示,多数3T3-L1细胞中出现被油红O着色的小液滴,表明大多数细胞已经可以形成脂滴,分化为成熟脂肪细胞,因此,3T3-L1诱导分化10 d后即可进行后续实验。
MDC是一种嗜酸性染色剂,可以染色自噬空泡结构,用于检测自噬体的形成。LC3是自噬体上表达的蛋白,可作为自噬体的检测标志物,其包含2种蛋白亚基,即LC3-Ⅰ和LC3-Ⅱ;内质网合成的前体LC3被Atg4B剪切为LC3-Ⅰ,自噬发生过程中,LC3蛋白由LC3-Ⅰ转为LC3-Ⅱ,LC3-Ⅱ主要定位于自噬小体膜结构上,稳定表达于自噬体膜上,其与自噬小体的形成密切相关[18-19]。本研究结果显示,与对照组比较,Adropin组细胞中自噬空泡相对含量、LC3阳性细胞比例、LC3-Ⅱ蛋白相对表达量显著降低,自噬激动剂组细胞中自噬空泡相对含量、LC3阳性细胞比例、LC3-Ⅱ蛋白相对表达量显著升高;与Adropin组比较,自噬激动剂组、Adropin+自噬激动剂组细胞中自噬空泡相对含量、LC3阳性细胞比例、LC3-Ⅱ蛋白相对表达量显著升高;与自噬激动剂组比较,Adropin+自噬激动剂细胞中自噬空泡相对含量、LC3阳性细胞比例、LC3-Ⅱ蛋白相对表达量显著降低;此结果表明,Adropin干预不仅可降低自噬空泡相对含量,同时也可降低LC3阳性细胞比例和LC3-Ⅱ蛋白表达,提示Adropin干预可能对自噬小体形成具有一定的抑制作用。但是,单独分析2LC3-Ⅱ含量不能有效反映自噬作用,同时,由于细胞中的酸性物质不只包括自噬空泡,所以,本研究通过检测细胞Beclin-1、p62蛋白相对表达情况,进一步分析Adropin干预对脂肪细胞自噬的影响。
Beclin-1是酵母ATG6的同系物,也是哺乳动物参与自噬的特异性基因,可与Ⅲ型PIK3形成复合体,介导自噬相关蛋白ATG定位于自噬泡,从而促进自噬,Beclin-1基因表达减少或活性降低均会对自噬产生抑制作用,因此,多位学者认为其可作为反映自噬的指标[20-21]。p62是一种由应激诱导产生的细胞内蛋白,可连接LC3与聚泛素化蛋白,通过泛素信号途径将受损的线粒体、聚合的蛋白及细菌等转运到自噬小体,被自噬溶酶体降解;当自噬激活时,自噬囊泡中p62蛋白水平降低;当自噬被抑制时,自噬囊泡中p62蛋白水平升高[22]。本研究结果显示,与对照组比较,Adropin组细胞中Beclin-1蛋白相对表达量显著降低,p62蛋白相对表达量显著升高;与对照组比较,自噬激动剂组细胞中Beclin-1蛋白相对表达量显著升高,p62蛋白相对表达量显著降低;与Adropin组比较,自噬激动剂组、Adropin+自噬激动剂组细胞中Beclin-1蛋白相对表达量显著升高,p62蛋白相对表达量显著降低;与自噬激动剂组比较,Adropin+自噬激动剂组细胞中Beclin-1蛋白相对表达量显著降低,p62蛋白相对表达量升高。此结果表明,Adropin可减少Beclin-1蛋白表达,增加p62蛋白表达,从而抑制脂肪细胞自噬。
AKT是PI3K下游的丝/苏氨酸蛋白激酶,AKT几乎在所有组织中均有表达,可保护细胞应对损伤,若敲除AKT基因,则细胞保护作用将会被抑制,最终导致细胞凋亡[23]。PI3K/AKT通路是调节细胞自噬的主要通路之一,该通路被激活后可抑制人前列腺癌细胞自噬,进而促使其凋亡[24]。有研究显示,敲除小鼠Enho基因可降低其血清中Adropin水平,降低AKT磷酸化,引起小鼠肺损伤[25]。因而推测,Adropin可调节PI3K/AKT信号活性,且可能是Adropin抑制脂肪细胞自噬的作用机制。本研究结果显示,与对照组比较,Adropin组细胞中p-PI3K、p-AKT蛋白相对表达量升高,自噬激动剂组细胞中p-PI3K、p-AKT蛋白相对表达量显著降低;与Adropin组比较,自噬激动剂组、Adropin+自噬激动剂组细胞中p-PI3K、p-AKT蛋白相对表达量显著降低;与自噬激动剂组比较,Adropin+自噬激动剂细胞p-PI3K、p-AKT蛋白相对表达量升高;而4组细胞中PI3K、AKT蛋白相对表达量比较差异无统计学意义。以上结果表明,Adropin可激活PI3K/AKT信号,揭示PI3K/AKT信号通路激活可能是Adropin抑制脂肪细胞自噬的作用机制。
综上所述,外源性Adropin可抑制脂肪细胞自噬,其作用机制可能与激活PI3K/AKT信号通路有关。但与自噬相关的通路及机制还有许多,Adropin是否通过其他通路或分子协同调控脂肪细胞自噬尚不清楚,将是下一步研究的重点。
