高危型人乳头状瘤病毒载量和Th1/Th2不均衡表达对宫颈病变进程的影响
2019-11-29邹晶晶朱小飞
邹晶晶,朱小飞,余 杨
(1.焦作市第二人民医院检验科,河南 焦作 454150;2.新乡医学院分子诊断与医学检验技术河南省协同创新中心,河南 新乡 453003)
宫颈癌在女性恶性肿瘤中发病率仅次于乳腺癌,其病率呈逐年升高趋势,高危型人乳头状瘤病毒(high risk-human papillomavirus,HR-HPV)持续性感染是导致宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)及宫颈癌的主要病因[1-3]。HPV感染很普遍,大多数人可以自然消退,即使感染了高危亚型,也未必发展为癌。HPV诱发的宫颈病变的转归与宫颈局部微环境密切相关。免疫和炎症是宫颈微环境的基本特征。肿瘤细胞转化由固有的基因改变决定,但肿瘤进展受肿瘤微环境、炎症和免疫反应控制[4-6]。作为重要的免疫效应细胞,辅助性T细胞(helper T cell,Th)通过分泌特异的细胞因子而发挥免疫调控功能。在不同抗原的刺激下,Th可分化为Th1与Th2 亚群,2类细胞相互制约、交互调节,共同维持机体的免疫稳态,一旦平衡被打破,机体处于Th1优势或Th2优势,则导致各种病理反应、病变趋向,甚至发生肿瘤。本研究通过比较宫颈病变不同阶段局部微环境中Th1和Th2细胞因子的表达以及HR-HPV DNA对感染状态的量化监测,分析免疫、感染、局部微环境三者相互作用的多样表现及其在宫颈癌和癌前病变的差异性;研究HR-HPV、Th1/Th2细胞因子的变化与宫颈病变发展趋势的联系;探讨从炎症到癌转化过程中可能的免疫学机制,为建立高级别CIN和宫颈癌的分流诊治提供临床支持。
1 资料与方法
1.1 一般资料选择焦作市第二人民医院2012年1月至2015年9月收治的339例HR-HPV持续性感染的不同宫颈病变患者为研究对象,其中CIN I 级71例(CIN I组)、CIN Ⅱ 级66例(CIN Ⅱ组)、CIN Ⅲ 级77例(CIN Ⅲ组),宫颈癌125例(宫颈癌组),均经病理学检查确诊。所有患者入院前未接受宫颈物理治疗、手术治疗、放射治疗和化学治疗;既往无其他系统肿瘤病史;无子宫切除手术史;无免疫系统缺陷疾病史;近期未使用过免疫抑制类药物。患者本人均知情同意,随访资料完整。持续性HR-HPV感染的定义[7-8]:HR-HPV感染者第1年每4个月随访1次,以后至少6个月随访1次,持续2 a以上,同一患者的宫颈检测样本均显示HR-HPV阳性且为同种类型。另选择HPV阴性且细胞学检查为正常宫颈的40例健康体检者作为对照组。CIN I组患者年龄 34~62(46.45±7.88)岁,CIN Ⅱ组患者年龄34~61(47.56±8.83)岁,CIN Ⅲ组患者年龄35~62(47.86±9.28)岁,宫颈癌组患者年龄34~62(47.05±8.60)岁,对照组受试者年龄34~62(46.55±9.36)岁;各组受试者年龄比较差异均无统计学意义(χ2=0.136,P>0.05),具有可比性。
1.2 主要试剂与仪器白细胞介素(interleukin,IL)-2、干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和IL-4、IL-6、IL-10检测试剂盒均购自上海江莱生物科技有限公司;DA7600型聚合酶链反应(polymerase chain reaction,PCR)扩增仪、高危型HPV核酸定量(16、18、31、33、45、52、56、58共8个型)检测试剂盒购自中山大学达安基因公司。
1.3 宫颈分泌物中HR-HPV DNA定量检测无菌条件下采用宫颈刷插入受试者宫颈内,旋转数周后停留片刻取出,将宫颈刷置入无菌管。将采集的宫颈分泌物及时送检或4 ℃保存,1周内检测。DNA提取和PCR扩增具体操作严格按照说明书进行。
1.4 宫颈灌洗液中细胞因子的检测将2 mL无菌磷酸盐缓冲液(pH 7.4)注入宫颈管内,收集宫颈灌洗液。将采集的灌洗液3 500 r·min-1离心10 min,分离上清液,立即进行检测或置-20 ℃冰箱保存待测。用双抗体夹心酶联免疫吸附试验法检测宫颈灌洗液中IL-2、IFN-γ、TNF-α、IL-4、IL-6、IL-10的含量,操作过程严格按照说明书进行。
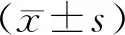
2 结果
2.1 5组受试者宫颈分泌物中HR-HPV DNA载量及宫颈灌洗液中细胞因子水平比较结果见表1。各组受试者宫颈分泌物中HR-HPV DNA载量及宫颈灌洗液中IL-2、IL-4、IL-6、IL-10、IFN-γ、TNF-α水平总体上比较差异均有统计学意义(P<0.05)。CIN Ⅱ组和CIN Ⅲ患者宫颈分泌物中HR-HPV DNA载量比较差异无统计学意义(P>0.05),其余各组患者宫颈分泌物中HR-HPV DNA载量两两比较差异均有统计学意义(P<0.05)。CIN I组、CIN Ⅱ组、CIN Ⅲ组及宫颈癌组患者宫颈灌洗液中IL-2、IFN-γ、TNF-α、IL-4、IL-6、IL-10水平均高于对照组,差异有统计学意义(P<0.05)。CIN I组、CIN Ⅱ组、CIN Ⅲ组及宫颈癌组患者宫颈灌洗液中IL-2、IFN-γ、TNF-α水平呈逐渐降低趋势,IL-4、IL-6、IL-10水平呈逐渐升高趋势。其中CIN Ⅱ组和CIN Ⅲ组患者宫颈灌洗液中IFN-γ、TNF-α、IL-4、IL-6水平比较差异无统计学意义(P>0.05),其余各宫颈病变组两两比较差异均有统计学意义(P<0.05);各宫颈病变组患者宫颈灌洗液中IL-2、IL-10水平两两比较差异均有统计学意义(P<0.05)。对照组、CIN Ⅰ组、CIN Ⅱ组TNF-α/IL-10比值比较差异均无统计学意义(P>0.05);CIN Ⅲ组宫颈癌组患者TNF-α/IL-10比值显著小于对照组、CIN I组、CIN Ⅱ组,差异均有统计学意义(P<0.05);宫颈癌组患者TNF-α/IL-10比值小于CIN Ⅲ组,差异有统计学意义(P<0.05)。
表1 各组受试者宫颈分泌物中 HR-HPV DNA载量及宫颈灌洗液中细胞因子水平比较

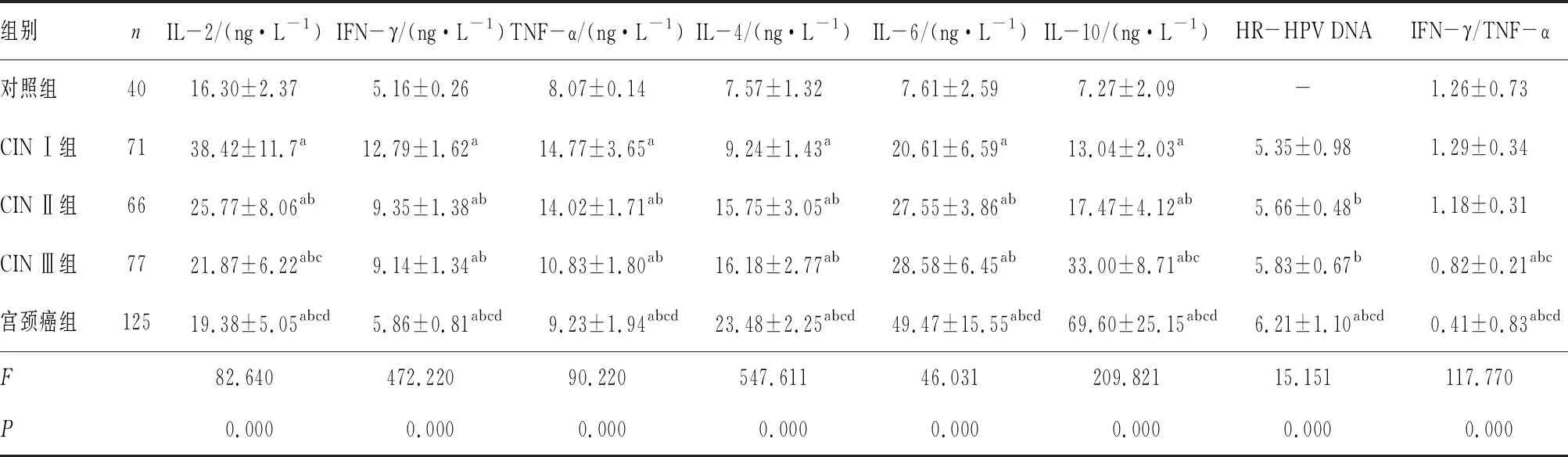
组别nIL-2/(ng·L-1)IFN-γ/(ng·L-1)TNF-α/(ng·L-1)IL-4/(ng·L-1)IL-6/(ng·L-1)IL-10/(ng·L-1)HR-HPV DNAIFN-γ/TNF-α对照组4016.30±2.375.16±0.268.07±0.147.57±1.327.61±2.597.27±2.09-1.26±0.73CIN Ⅰ组7138.42±11.7a12.79±1.62a 14.77±3.65a 9.24±1.43a 20.61±6.59a 13.04±2.03a 5.35±0.981.29±0.34CIN Ⅱ组6625.77±8.06ab9.35±1.38ab14.02±1.71ab15.75±3.05ab27.55±3.86ab17.47±4.12ab5.66±0.48b1.18±0.31CIN Ⅲ组7721.87±6.22abc9.14±1.34ab10.83±1.80ab16.18±2.77ab28.58±6.45ab33.00±8.71abc5.83±0.67b0.82±0.21abc宫颈癌组12519.38±5.05abcd5.86±0.81abcd9.23±1.94abcd23.48±2.25abcd49.47±15.55abcd69.60±25.15abcd6.21±1.10abcd0.41±0.83abcdF82.640472.22090.220547.61146.031209.82115.151117.770P0.0000.0000.0000.0000.0000.0000.0000.000
注:与对照组比较aP<0.05;与CINⅠ组比较bP<0.05;与CINⅡ组比较cP<0.05;与CIN Ⅲ组比较dP<0.05;“-”无数据。
2.2 HR-HPV DNA载量与6种细胞因子的关系结果见表2。多元线性回归分析显示,IL-2、IL-4与HR-HPV DNA载量无线性关系(P>0.05),未进入回归方程;IL-6、IL-10、IFN-γ、TNF-α与HR-HPV DNA载量存在线性关系(P<0.05),HR-HPV DNA=6.852-0.010IL-6+0.008IL-10-0.036 TNF-α-0.066 IFN-γ,与HR-HPV载量的密切程度依次为IL-10>IL-6>IFN-γ>TNF-α。
表2 HR-HPV DNA裁量与6种细胞因子的关系分析
Tab.2 Multivariate linear regression analysis of the relationship between the HR-HPV load and six cytokines
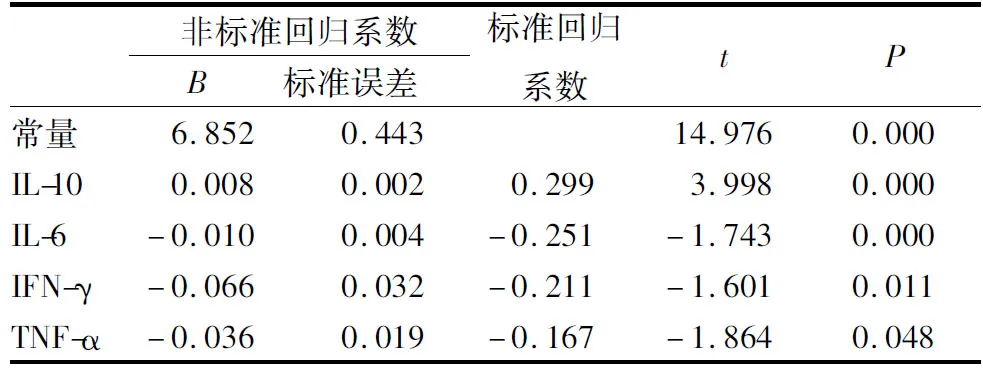
非标准回归系数B 标准误差 标准回归系数tP常量6.8520.44314.9760.000IL-100.0080.0020.299 3.9980.000IL-6-0.0100.004-0.251-1.7430.000IFN-γ-0.0660.032-0.211-1.6010.011TNF-α-0.036 0.019-0.167-1.8640.048
3 讨论
从HPV感染到CIN再到宫颈癌是感染至慢性炎症再到癌变的过程,因此,宫颈癌是一种与炎性反应密切相关的肿瘤。免疫应答和免疫逃逸在炎症向癌转化过程中发挥重要作用。Th1细胞分泌的IL-2、IFN-γ、TNF-α具有免疫保护作用,在病毒清除和癌性炎症反应中发挥重要作用;Th2细胞分泌的IL-4、IL-6、IL-10可破坏机体的免疫系统,促进肿瘤浸润和转移,严重干扰机体的抗肿瘤免疫[9]。Th1和Th2细胞因子可以相互下调对方的生长、分化,刺激自身增殖。Th1/Th2平衡是促炎和抗炎因子之间的平衡,也是促瘤和抗瘤作用因子的平衡。随着微环境的变化,Th1与Th2数量发生改变,二者比例失衡,由此产生不同的功能效应。
本研究结果显示,CINⅠ阶段即有细胞因子的异常表达,Th1和Th2型细胞因子均高于对照组,以Th1型细胞因子中的IL-2、IFN-γ为著,TNF-α/IL-10比值无明显变化,提示Th1/Th2相对平衡;CIN Ⅱ阶段较CINⅠ阶段明显变化的细胞因子是IL-2、IFN-γ、IL-4、IL-6,有Th1优势表达的趋势,TNF-α/IL-10比值略下降,Th1/Th2基本平衡;CIN Ⅲ阶段TNF-α/IL-10比值急剧下降,Th1/Th2明显失衡,呈现Th2优势表达模式,直至宫颈癌变阶段。这些变化提示HR-HPV感染干扰了Th1/Th2的平衡表达,由 CIN Ⅰ→CIN Ⅱ→CIN Ⅲ→宫颈癌,Th1向Th2的总体偏移趋势参与影响宿主对病毒正确的免疫识别,从而促进宫颈病变的持续发展。
在病变的不同阶段,免疫系统的作用和表现是不同的,呈现阶段依赖性的变化模式:CIN低度病变时,即有各种细胞因子异常表达; CIN中度病变时,各种细胞因子的调控作用此消彼长,虽有单个细胞因子如IL-2、IL-4、IL-6表达的突出变化,但整个Th1/Th2细胞因子网络仍能维持基本平衡。Th2细胞因子模式的转变在CIN Ⅲ级病变中较为明显,CIN Ⅲ级至宫颈癌发生发展过程中,Th2细胞因子的负向免疫抑制作用明显高于Th1细胞因子的正向免疫保护作用。这一方面体现了机体免疫调控的精细化,机体可通过自我调节限制应答的强度,维护过度激活、异常表达和有效免疫效应之间的平衡,维护促癌/抗癌、促炎/抗炎微环境之间的平衡。另一方面反映了机体免疫调控的复杂性,免疫细胞之间,外来抗原HPV和免疫细胞之间,HPV、免疫细胞与局部微环境之间均存在相互制约、相互调节的交互作用和交联影响。因此,在监测和评价免疫系统在HPV宫颈病变进程中的作用时,不仅要考虑Th细胞因子数量的变化,更要注重Th1与Th2的比例关系,免疫反应活跃即有细胞因子数量的变化,但Th1/Th2细胞因子比例失衡,Th2优势表达的免疫功能失调,可使宫颈微环境免疫抑制加重,进一步干扰机体对HPV复制的免疫控制,使得病毒大量复制,导致慢性持续性感染日渐严重,从而打破了机体微环境抗癌/促癌的内在平衡,进一步加剧了从CIN到宫颈癌的顺向发展。由此可见,免疫抑制在HPV宫颈病变由量变到质变整个链条中的重要作用,这与文献报道宫颈癌的免疫状态为免疫耐受或免疫逃逸一致[10]。
有研究报道,血清细胞因子水平与HPV感染的清除或持续无关[11],这与本研究结果不同但并不矛盾,主要原因为肿瘤在演进的过程中,各阶段的HPV载量和细胞因子均与其周围环境交互作用,由此形成的免疫微环境是有别于人体正常内环境的复杂系统,HPV感染局限于皮肤黏膜表皮细胞层,不形成病毒血症,局部黏膜免疫系统具有独特的区域免疫特性。CD4+T细胞既能在没有CD8+T细胞的情况下,独立将肿瘤细胞清除,还能辅助CD8+T细胞激活,并通过表达趋化因子重塑肿瘤微环境[12],在适应性免疫应答中处于中心地位,在宫颈病变HPV感染以外的部位T细胞不直接接触抗原,无法启动免疫识别机制,无相应的免疫应答产生。
目前,关于HR-HPV病毒载量与宫颈病变程度的关系尚存在一定的争议,有研究认为,HR-HPV载量与宫颈病变程度相关[13],也有相反的报道[14]。本研究结果显示,在CIN Ⅱ组和CIN Ⅲ组患者HR-HPV DNA载量比较差异无统计学意义,该2组患者HR-HPV DNA载量高于CIN Ⅰ组,低于宫颈癌组,这些均证实了HR-HPV持续性感染是宫颈癌发生的必要而非充分条件,需要免疫体系协同作用。但有证据表明,慢性炎症可通过诱导促炎介质和免疫抑制细胞的积聚或激活而诱导或加重免疫抑制[15],因此,对HR-HPV持续感染者仍应坚持随访,并动态监测HR-HPV DNA载量。
