“碳酸钠、碳酸氢钠和碳酸钙”知识点总结
2019-11-25王云堂
王云堂
(江苏省连云港市华杰实验学校 222100)
一、碳酸钠的化学性质介绍
例如:碳酸钠俗称为纯碱,是一种白色的粉末状物体,能够和二氧化碳以及水发生反应产生碳酸氢钠,化学方程式为:( );还能够与HCl发生反应放出二氧化碳,不过在实验室中无法使用此方法制取二氧化碳,主要原因是:( );现在指导碳酸钠的溶解度相对于碳酸氢钠要大的多,那么在饱和的碳酸氢钠溶液中不断通入二氧化碳,可以看到的想象是:( )
考点解析过程:本道化学题考察的是碳酸钠的基本性质,依据提出给出的条件以及反应物和成生物可以书写出相对应的化学方程式,实验室中制取二氧化碳时,需要容易操作和收集装置,然而碳酸钠与HCl之间反应比较快,无法有效收集二氧化碳气体.因为碳酸纳的溶解度相碳酸氢钠要大,所以在饱和溶液中不断通入二氧化碳,则生成的碳酸氢钠,不能全部溶解,并且液体会出现浑浊现象.

二、碳酸钙的化学性质介绍
比如:小花、小草、小东在实验室作碳酸钙受热发生分解实验,加热一段时间过后,三人对试管内存在的固体成分进行了研究.
提出问题:加热后的碳酸钙试管内固体成分有哪些?
提出建设:小花假设,碳酸钙没有发生分解,固体成分依旧是碳酸钙.
小草假设,碳酸钙发生一部分分解,固体成分是( )
小东假设,碳酸钙全部分解,其固体成分是:( )
收集证明,小花提取部分固体放在试管之中,加入一定量H2O进行振荡后静置,在向试管内滴加无色酚酞试液,一旦试液出现红色,那么小花加H2O发生反应的化学方程式就是:( )
小草在小花实验基础上的试管内滴加了过量的HCl稀,则溶液中出现了一部分气泡.
最终结论:通过实验可以得到( )的建设成立.
总结分析:实验结束后,在小组内进行交流和互动,很多学生会提出:在实验中可以使用以下仪器中( )(编号),就能够依据实验发生现象得到碳酸钙在加热中是否发生了分解.
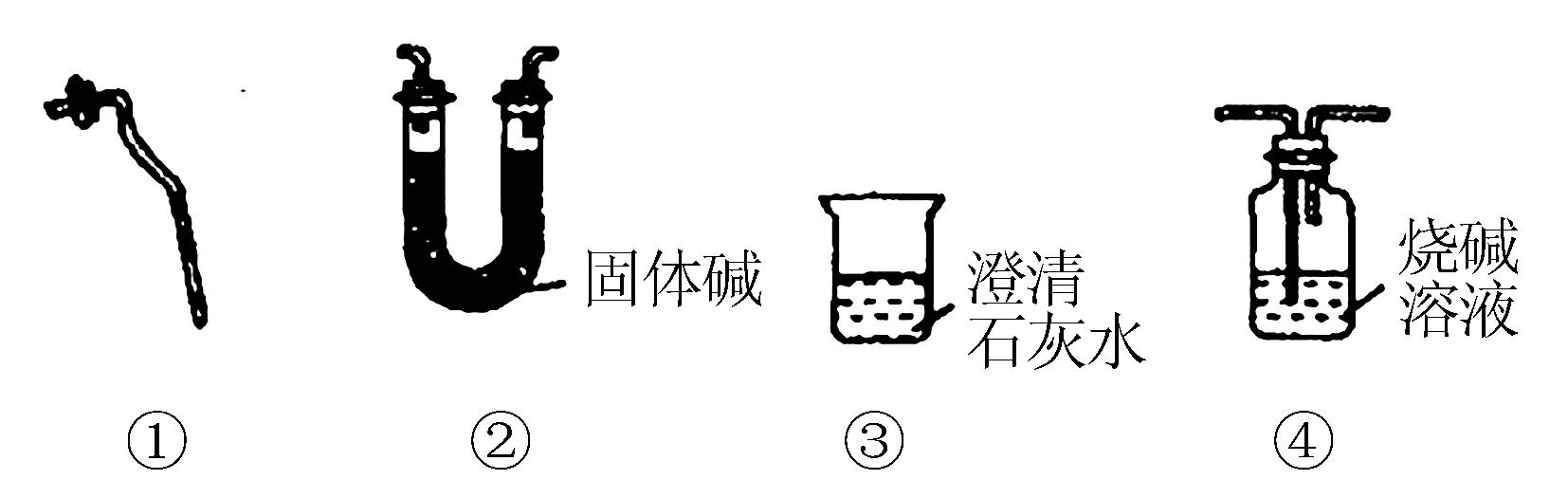
试题解析:碳酸钙受到加热后分解的化学方程式为:
加热分解完全剩余的固体则是CaO,假设部分发生分解,那么剩余的固体则是碳酸钙、氧化钙的混合物,加入水和氧化钙发生反应后生成氢氧化钙.进而再加入一些酚酞试液则会变红,也就说明了溶液呈现碱性,则原来固体中有氧化钙,再滴入HCl则出现气泡,则说明原有固体中含有CaCO3,所以在加热中,将出现的气体引入到澄清石灰水之中,依据溶液出现浑浊现象,就可以对其进行合理判断.

三、碳酸钠与碳酸氢钠比较
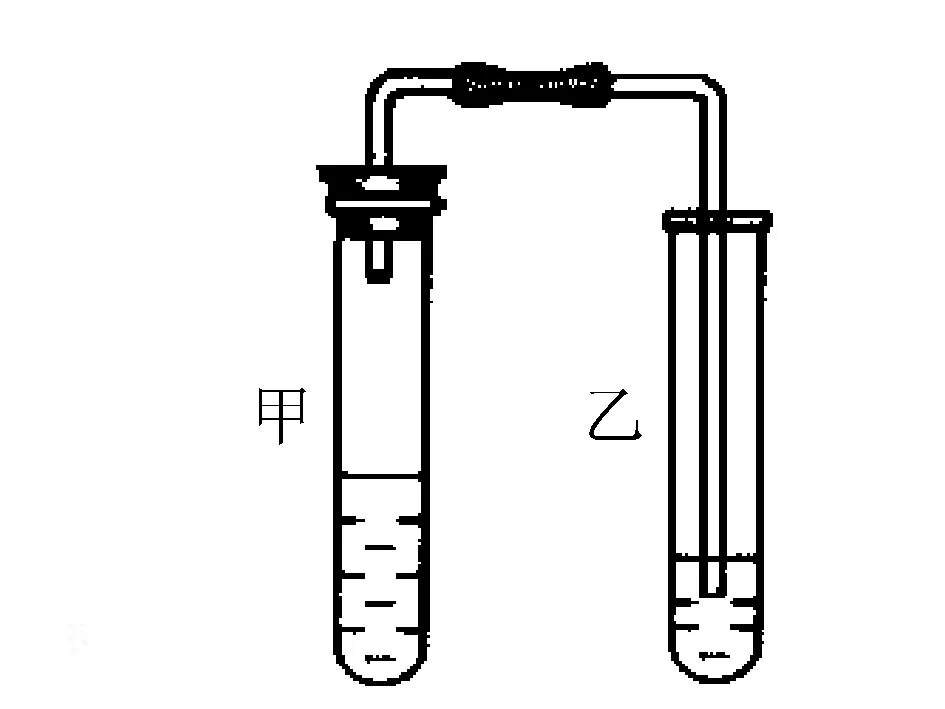
比如:在学习Na2CO3和NaHCO3时,做出了以下图形所示的装置实验,向加有0.5g的Na2CO3试管中加入2mL的HCl,快速塞上具有导管的胶塞,并将导管的另一端引入具有澄清石灰水的试管之中,对其出现的现象进行观察.用NaHCO3代替Na2CO3进行上述实验,并对现象进行观察和分析.
(1)经过以上试管中甲乙之间发生的两次发生进行对比,填写一下表格:

NaHCO3+HClNa2CO3+HCl实验现象发生迅速,生成了大量气体反应(),生成气体更多实验结论
实验装置如下图所示.
实验应品:相同型号的U形试管2个,橡皮塞2个,5mL注射器两个,气球2个.

实验诗具体步骤:在U形试管中分别加入Na2CO3和NaHCO3固体,并在两支注射器内引入同等质量分数和体积的足够的HCl稀,将注射器使用相关一起堵住,进而在快速将HCl注入两个U形试管内.
(1)若取出的Na2CO3为0.53g,为使得实验中出现的气体相等,那么应该取出NaHCO3( )g;
(2)同学对设计的实验采用了( )研究方法;
(3)实验中能够观察的想象是( )
试题分析:Na2CO3和NaHCO3都能够和HCl发生反应生成CO2,不过因为NaHCO3反应比Na2CO3快,假设0.53g的Na2CO3完全与HCl发生反应,设其质量为x,一旦生成同等质量的CO2,那么就需要NaHCO3质量为y.

106 44
0.53gx
x=0.22g

84 44
y0.22g

