睡前加餐对乙肝肝硬化合并糖尿病患者能量代谢及血糖的影响研究
2019-11-22董金玲贾琳王忠英朱跃科胡中杰于红卫孟庆华
董金玲,贾琳,王忠英,朱跃科,胡中杰,于红卫,孟庆华
肝脏是人体能量和葡萄糖代谢的重要器官,由于肝硬化患者肝细胞有效数量减少和功能紊乱,易出现糖代谢异常和胰岛素抵抗。据估计,只有30%的患者有正常的葡萄糖耐量,58%~96%的患者有葡萄糖耐量受损,35%~71%的患者有明确的糖尿病[1-2]。肝硬化合并糖尿病患者面临着并发症增多、生存率降低、恶性肿瘤风险增加的问题[3]。住院肝硬化患者约81%存在蛋白质-能量营养不良症(PEM),空腹血糖(FBG)水平是影响肝硬化合并糖尿病患者能量代谢的重要因素,肝硬化患者饥饿一个夜晚(12 h)引起的代谢异常,约等于正常人饥饿3 d 的改变,并增加了脂肪燃烧率,降低非蛋白呼吸商(NPRQ)[4-5]。美国肠外和肠内营养学会[6]、欧洲临床营养和代谢学会指南[7]均建议睡前加餐(LES),以避免夜间空腹时间过长时增加自身储备的能量消耗来满足机体的能量需求和预防次日晨起低血糖。本研究旨在探讨低升糖指数、高碳水化合物为主的LES 对乙肝肝硬化合并糖尿病患者能量代谢和葡萄糖代谢的影响。
1 资料与方法
1.1 研究标准 纳入标准:(1)性别不限,年龄18~70岁。(2)符合乙肝肝硬化诊断标准:乙肝表面抗原阳性,有肝硬化症状、体征,肝功能异常,有门脉高压症表现,影像学符合肝硬化典型表现;肝硬化按Child-Pugh分级为A、B 级者。(3)2 型糖尿病及肝源性糖尿病患者,糖尿病诊断标准符合《中国2 型糖尿病防治指南(2013 年版)》[8]诊断标准,FBG ≥7.0 mmol/L 和/或餐后2 h 血糖≥11.1 mmol/L,除外糖耐量异常。血糖控制稳定的标准范围:FBG 控制在6.0~9.0 mmol/L,餐后2 h 血糖<10.0 mmol/L,糖化血红蛋白(HbA1c)在4.0%~9.0%,入组患者血糖稳定4 周以上(每天检测7次血糖,至少连续3 d,FBG<9.0 mmol/L,餐后2 h 血糖<10.0 mmol/L)。(4)接受恩替卡韦抗病毒治疗时间超过2 年,乙型肝炎病毒(HBV)DNA<100 U/ml(至少连续2 次,每次检测间隔3 个月)。
排除标准:(1)酒精性肝损害、肝硬化合并肝癌、其他病因肝硬化;(2)摄取富含支链氨基酸食物或应用支链氨基酸药物,胃肠道疾病外科术后患者等;(3)合并甲状腺功能亢进、恶性肿瘤、严重感染,心、脑、肺、肾功能不全,以及正在应用有明确影响代谢作用的药物(如糖皮质激素)等;(4)不同意签署知情同意书者。
剔除标准:(1)不能按要求完成试验者;(2)在研究期间连续3 d 平均FBG ≥9.0 mmol/L 和/或餐后 2 h 血糖≥10.0 mmol/L;(3)出现研究相关低血糖表现或任意时间血糖≤4.4 mmol/L,均需明确调整降糖药物用量者。
1.2 研究对象 选取2015-01-01 至2017-12-30 于首都医科大学附属北京佑安医院肝病重症医学科住院的31 例乙肝肝硬化合并糖尿病患者,其中男26 例,女5例。研究期间6 例患者被剔除,其中3 例没有按要求控制饮食,2 例患者因血糖不稳定调整降糖药物,1 例发现肝癌,最终纳入研究25 例。将患者依据随机数字表法分为低升糖指数、高碳水化合物LES 管理组(干预组,n=12)和肝硬化糖尿病饮食组(非干预组,n=13)。
本研究已获得首都医科大学附属北京佑安医院伦理委员会批准并备案,入组患者均签署知情同意书。
1.3 药物治疗 患者均继续使用恩替卡韦抗病毒治疗,可以使用护肝和抗纤维化药物。干预组与非干预组各1例患者为新发糖尿病患者,未应用药物治疗,其他患者在2002—2017 年使用控制血糖药物(α-葡萄糖苷酶抑制剂0.1~0.2 g,3 次/d,胰岛素0.1~0.3 U·kg-1·d-1)治疗。在本研究过程中,控制血糖药物的剂量没有改变。
1.4 饮食摄入营养指导 研究开始前,患者均接受营养师的肝硬化糖尿病饮食营养指导。在全程研究过程中,患者掌握了使用标准化中国食品成分表计算营养摄入(能量、脂肪、蛋白质和碳水化合物)的方法,接受肝硬化糖尿病饮食管理,定时、定量进餐:摄入总量控制在非蛋白质为25~30 kcal·kg-1·d-1,蛋白质为1.0~1.2 g·kg-1·d-1,约60%碳水化合物、24%脂肪和16%蛋白质。总量摄入计算:1.3×静息能量消耗(REE),REE 根据Harris-Benedict(H-B)公式[9]计算得出,男性REE(kcal/d)=66.473 0+13.751 6×W +5.003 3 ×H-6.755 0×A; 女 性REE(kcal/d) =655.095 5 +9.563 4×W+1.849 6×H-4.675 6×A。公式中W 表示体质量,单位为kg;H 表示身高,单位为cm;A 表示年龄,单位为年。为了确保两组之间在基线时能量和营养素摄入的一致性,在研究开始前3 d 内及研究结束3 个月时,收集所有患者3 d 的食物摄入记录进行摄入量评估。
1.5 LES 非干预组维持肝硬化糖尿病3 餐饮食;干预组患者将传统3 餐改为4 餐,3 餐各减少67 kcal(每餐减少16.7 g 碳水化合物)食物,放在睡前1 h 进行加餐。LES 的营养成分为:总能量200 kcal 约836 kJ 高膳食纤维饼干(含60%以上碳水化合物,升糖指数<46),约65.8 g(每1 g:能量20.32 kJ,碳水化合物0.60 g,蛋白质0.084 g,脂肪0.234 g,糖0.016 g)。住院期间持续干预,病情稳定出院后维持LES,让患者形成习惯。
1.6 BMI 计算、糖代谢指标检测、胰岛素抵抗指标计算及生化指标检测 所有患者于基线和干预3 个月时,清晨(禁食12 h 以上)脱鞋、免冠,仅穿内衣测量身高及体质量,根据公式计算BMI:BMI=体质量(kg)/身高(m2),采集空腹静脉血5 ml,采用己糖激酶法检测FBG,化学分光法检测胰岛素(FINS),高效液像色谱法检测HbA1c水平,并计算胰岛素抵抗指数(HOMA-IR) 〔(HOMA-IR=空腹胰岛素×FBG/22.5)〕和胰岛B细胞功能指数(FBCI),FBCI=FINS/FBG[10]。采用生化检测仪(西门子,ADVAS 2400,德国)测量丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、总蛋白(TP)、白蛋白(ALB)、前白蛋白(PALB)、胆碱酯酶(CHE)、凝血酶原活动度(PTA)。
1.7 能量代谢指标测定 采用美国Medgraphics 公司生产的CCM/D 营养代谢测试系统(简称代谢车)进行间接能量代谢测定。测试前要求:患者清醒状态下,禁食8~10 h,取平卧位,避免肌肉活动30 min 以上,环境温度20~30 ℃,湿度50%~65%,大气压101.0~102.4 kPa, 由固定技术人员在患者床边进行测试,测试时间为 15 min,代谢车自动计算出REE。代谢车根据一定时间内吸入气体和呼出气体中氧气(O2)和二氧化碳(CO2)的浓度差及总气体量,自动计算出一定时间内机体呼出CO2的量与吸入O2量的比值即为呼吸商(RQ)。同时收集代谢车测定当日24 h 尿液,测定尿素氮,按公式计算24 h尿氮(g)=尿素氮(mol/L)×尿素分子量(g/mol) ×24 h 总尿量(L)[11]。在代谢车系统中输入24 h 尿素氮后可自动得出蛋白质氧化率(PRO%)、除去蛋白质消耗后的NPRQ,由NPRQ 可得出碳水化合物氧化率(CHO%)和脂肪氧化率(FAT%)。预计REE(PREE)是根据Harris-Benedict(H-B)公式[9]计算得出。
1.8 观察指标 收集患者疾病史情况,包括肝硬化病史、糖尿病病史、糖尿病类型、Child-Pugh 分级。比较两组患者基线人口学资料(性别、年龄)及基线和干预结束3 个月人体测量学资料(体质量、BMI)、饮食摄入情况(碳水化合物、脂肪、蛋白质、能量)、能量代谢指标(REE、PREE、PREE%、RQ、CHO%、FAT%、PRO%)、 糖 代 谢 指 标(HbA1c、FBG、FINS)、HOMA-IR、FBCI、肝功能指标〔ALT、AST、TBIL、TP、ALB、PALB、CHE、PTA〕。
1.9 统计学方法 采用SPSS 13.0 统计学软件进行数据分析。符合正态分布的计量资料以表示,两组间比较采用两独立样本t 检验,基线与干预结束3 个月资料比较采用配对t 检验;计数资料以相对数表示,组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 研究患者疾病史及Child-Pugh 分级情况 25 例肝硬化合并糖尿病患者,肝硬化病史为(3.6±2.1)年,糖尿病史为(5.0±4.6)年。干预组肝源性糖尿病患者占3/13,非干预组肝原性糖尿病患者占2/12,其他患者均为2 型糖尿病患者。两组患者基线Child-Pugh 分级各有2 例为B 级,其余均为A 级,干预结束3 个月后所有研究对象Child-Pugh 分级为A 级。
2.2 两组患者基线人口学资料及基线和干预结束3 个月人体测量学资料、饮食摄入情况比较 两组患者性别、年龄及基线和干预结束3 个月体质量、BMI、碳水化合物摄入量、脂肪摄入量、蛋白质摄入量、能量摄入量比较,差异无统计学意义(P>0.05,见表1)。
2.3 两组患者基线、干预结束3 个月REE、PREE、PREE%、RQ、CHO%、FAT%、PRO% 比较 两组患者基线REE、PREE、PREE%、RQ、CHO%、FAT%、PRO%比较,差异无统计学意义(P>0.05);两组患者干预结束3 个月REE、PREE、PREE%比较,差异无统计学意义(P>0.05);干预组患者干预结束3 个月RQ、CHO%高于非干预组,FAT%、PRO%低于非干预组,差异有统计学意义(P<0.05)。干预组患者干预结束3 个月REE、PREE、PREE%与同组基线比较,差异无统计学意义(P>0.05);干预组患者干预结束3 个月RQ、CHO%高于同组基线,FAT%、PRO%低于同组基线,差异有统计学意义(P<0.05)。非干预组患者干预结束3 个 月REE、PREE、PREE%、RQ、CHO%、FAT%、PRO%与同组基线比较,差异无统计学意义(P>0.05,见表2)。

表1 两组患者基线人口学资料及基线和干预结束3 个月人体测量学资料、饮食摄入情况比较Table 1 Comparison of demographic and anthropometric characteristics and dietary intake between two groups at baseline and after three-month intervention
表2 两组患者基线、干预结束3 个月REE、PREE、PREE%、RQ、CHO%、FAT%、PRO%比较Table 2 Comparison of REE,PREE,PREE%,RQ,CHO%,FAT% and PRO% between two groups before and after three-month intervention
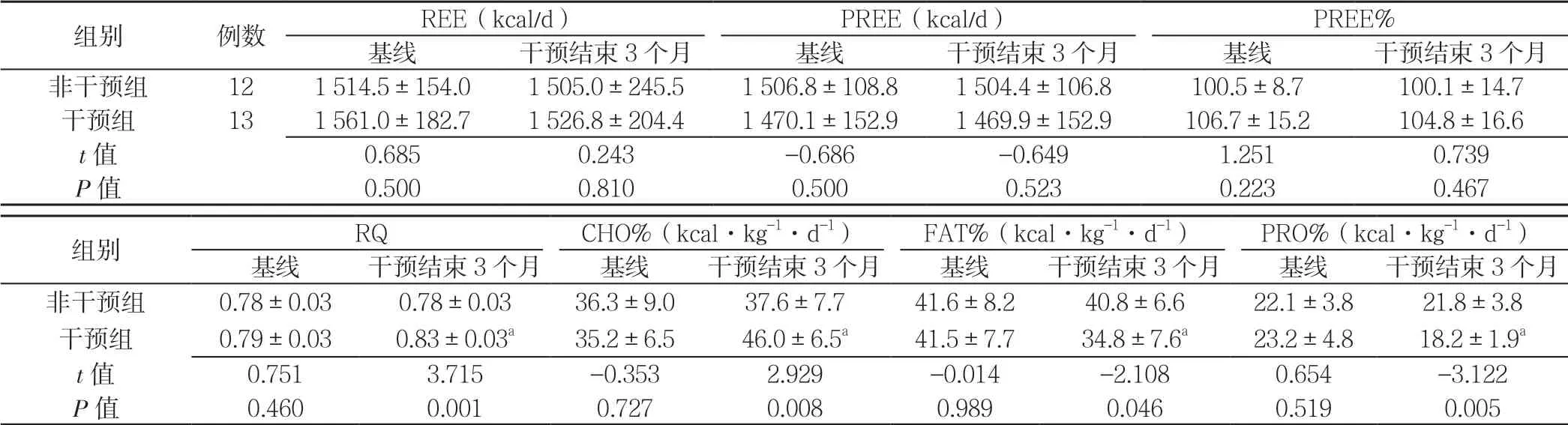
表2 两组患者基线、干预结束3 个月REE、PREE、PREE%、RQ、CHO%、FAT%、PRO%比较Table 2 Comparison of REE,PREE,PREE%,RQ,CHO%,FAT% and PRO% between two groups before and after three-month intervention
注:REE=静息能量消耗,PREE=预计静息能量消耗,PREE%=REE 占PREE 百分比,RQ=呼吸商,CHO%=碳水化合物氧化率,FAT%=脂肪氧化率,PRO%=蛋白质氧化率;与同组基线比较,aP<0.05
组别 例数 REE(kcal/d) PREE(kcal/d) PREE%基线 干预结束3 个月 基线 干预结束3 个月 基线 干预结束3 个月非干预组 12 1 514.5±154.0 1 505.0±245.5 1 506.8±108.8 1 504.4±106.8 100.5±8.7 100.1±14.7干预组 13 1 561.0±182.7 1 526.8±204.4 1 470.1±152.9 1 469.9±152.9 106.7±15.2 104.8±16.6 t 值 0.685 0.243 -0.686 -0.649 1.251 0.739 P 值 0.500 0.810 0.500 0.523 0.223 0.467组别 RQ CHO%(kcal·kg-1·d-1) FAT%(kcal·kg-1·d-1) PRO%(kcal·kg-1·d-1)基线 干预结束3 个月 基线 干预结束3 个月 基线 干预结束3 个月 基线 干预结束3 个月非干预组 0.78±0.03 0.78±0.03 36.3±9.0 37.6±7.7 41.6±8.2 40.8±6.6 22.1±3.8 21.8±3.8干预组 0.79±0.03 0.83±0.03a 35.2±6.5 46.0±6.5a 41.5±7.7 34.8±7.6a 23.2±4.8 18.2±1.9a t 值 0.751 3.715 -0.353 2.929 -0.014 -2.108 0.654 -3.122 P 值 0.460 0.001 0.727 0.008 0.989 0.046 0.519 0.005
2.4 两组患者基线、干预结束3 个月HbA1c、FBG、FINS、HOMA-IR、FBCI 比较 两组患者基线HbA1c、FBG、FINS、HOMA-IR、FBCI 比较,差异无统计学意义(P>0.05);干预组患者干预结束3 个月HbA1c、FBG、FINS、HOMA-IR 低于非干预组,差异有统计学意义(P<0.05);两组患者干预结束3 个月FBCI 比较,差异无统计学意义(P>0.05)。干预组干预结束3 个月HbA1c、FBG、FINS、HOMA-IR 低于同组基线,差异有统计学意义(P<0.05);干预组患者干预结束3 个月FBCI 与同组基线比较,差异无统计学意义(P>0.05);非干预组患者干预结束3 个月HbA1c、FBG、FINS、HOMA-IR、FBCI 与同组基线比较,差异无统计学意义(P>0.05,见表3)。
2.5 两组患者肝功能指标比较 两组患者基线ALT、AST、TBIL、TP、ALB、PALB、CHE、PTA 比 较, 差异无统计学意义(P>0.05);两组患者干预结束3 个月ALT、AST、TBIL、TP、ALB、PALB、CHE、PTA 比较,差异无统计学意义(P>0.05)。干预组患者干预结束3 个月TP、ALB、PALB 高于同组基线,差异有统计学意义(P<0.05);干预组患者干预结束3 个月ALT、AST、TBIL、CHE、PTA 与同组基线比较,差异无统计学意义(P>0.05);非干预组患者干预结束3 个月ALT、AST、TBIL、TP、ALB、PALB、CHE、PTA 与 同组基线比较,差异无统计学意义(P>0.05,见表4)。
表3 两组患者基线、干预结束3 个月HbA1c、FBG、FINS、HOMA-IR、FBCI 比较Table 3 Comparison of HbA1c,FBG,FINS,HOMA-IR and FBCI between two groups before and after three-month intervention

表3 两组患者基线、干预结束3 个月HbA1c、FBG、FINS、HOMA-IR、FBCI 比较Table 3 Comparison of HbA1c,FBG,FINS,HOMA-IR and FBCI between two groups before and after three-month intervention
注:HbA1c=糖化血红蛋白,FBG=空腹血糖,FINS=空腹胰岛素,HOMA-IR=胰岛素抵抗指数,FBCI=胰岛β 细胞功能指数;与同组基线比较,aP<0.05
组别 例数 HbA1c(%) FBG(mmol/L) FINS(μU/ml) HOMA-IR FBCI基线 干预结束3 个月 基线 干预结束3 个月 基线 干预结束3 个月 基线 干预结束3 个月 基线 干预结束3 个月非干预组 12 6.90±1.08 6.86±0.97 7.67±0.71 7.57±0.44 11.60±1.33 11.55±1.09 3.98±0.72 3.89±0.46 56.65±9.05 57.25±7.17干预组 13 6.82±0.83 6.13±0.56a 7.66±0.54 6.99±0.42a 11.71±2.06 10.37±1.31a 3.97±0.68 3.24±0.55a 57.60±14.24 59.66±6.19 T 值 -0.222 -2.331 -0.018 -3.382 0.157 -2.444 -0.010 -3.200 0.197 0.902 P 值 0.826 0.029 0.986 0.003 0.877 0.023 0.992 0.004 0.846 0.376
表4 两组患者基线、干预结束3 个月肝功能指标比较Table 4 Comparison of ALT、AST、TBIL、TP、ALB、PALB、CHE and PTA between two groups before and after three-month intervention

表4 两组患者基线、干预结束3 个月肝功能指标比较Table 4 Comparison of ALT、AST、TBIL、TP、ALB、PALB、CHE and PTA between two groups before and after three-month intervention
注:ALT=丙氨酸氨基转移酶,AST=天冬氨酸氨基转移酶,TBIL=总胆红素,TP=总蛋白,ALB=白蛋白,PALB=前白蛋白,CHE=胆碱酯酶,PTA=凝血酶原活动度;与同组基线比较,aP<0.05
组别 例数 ALT(U/L) AST(U/L) TBIL(μmol/L) TP(g/L)基线 干预结束3 个月 基线 干预结束3 个月 基线 干预结束3 个月 基线 干预结束3 个月非干预组 12 51.9±48.6 32.2±12.0 37.1±27.2 29.8±7.6 17.6±8.2 17.8±7.2 69.6±5.5 70.8±6.2干预组 13 35.2±19.0 33.1±11.6 32.4±12.3 33.5±10.5 22.7±11.6 21.0±8.2 67.6±6.0 70.0±5.1a F 值 -1.147 0.205 -0.568 1.019 1.263 1.050 -0.915 -0.351 P 值 0.263 0.840 0.576 0.319 0.219 0.302 0.370 0.729组别 ALB(g/L) PALB(mg/dl) CHE(U/L) PTA(%)基线 干预结束3 个月 基线 干预结束3 个月 基线 干预结束3 个月 基线 干预结束3 个月非干预组 38.5±5.5 39.4±5.5 162.1±41.2 175.9±44.2 6 522.2±2 184.2 6 745.4±1 966.4 86.0±12.4 88.3±10.1干预组 38.7±6.3 40.0±5.7a 159.5±30.8 171.5±28.6a 6 476.1±2 165.8 6 513.4±1 803.2 84.2±19.9 88.6±15.4 F 值 0.108 0.239 -0.181 -0.296 -0.053 -0.308 -0.276 0.054 P 值 0.915 0.813 0.858 0.770 0.958 0.761 0.785 0.958
3 讨论
全球约20 亿人曾感染HBV,30%肝硬化病因为HBV 感染,乙肝肝硬化常伴随多种并发症[12],诊治过程中最容易被忽视的是患者营养不良。肝硬化患者改变了营养、能量和糖代谢,包括FBG 和脂肪氧化增加、葡萄糖氧化减少和PEM,这是导致预后不良的主要原因[1,13]。LES 缩短了夜间的生理禁食时间,既可以改善肝硬化患者分解蛋白和脂肪氧化供能的代谢失衡,又能预防次晨低血糖,但是否适用于肝硬化合并糖尿病人群值得进一步探讨研究。本研究目的是观察LES 干预与非干预组患者的静息能量、三大营养底物的代谢变化及血糖变化,探讨LES 对肝硬化合并糖尿病患者血糖、能量代谢的影响,以期达到既能平稳有效控制血糖又能改善这一特殊群体能量代谢的目的。
既往YAMANAKA 等[14]通过研究21 例Child-Pugh A 级肝硬化患者,比较给予LES(200 kcal 米饭团)前后的RQ,发现LES 有利于RQ 的改善;YAMANAKAOKUMURA 等[15]通过对39 例Child-Pugh A 级患者1 年生活质量评分研究,得出长期LES 可以提高肝硬化患者生活质量;以及TSIEN 等[16]发现lES 能降低脂质氧化,改善氮平衡等,结果均提示LES 有利于机体的能量代谢。本研究发现,在给予3 个月LES(低升糖指数、高碳水化合物总能量为836 kJ)后,干预组RQ 较基线升高(P=0.001),这与GUO 等[17]报道给予肝硬化患者1~3 周的LES 治疗后,患者RQ 值显著升高一致。肝硬化合并糖尿病患者处于高代谢状态,给予LES 后,CHO%较基线明显升高,PRO%、FAT%较基线明显降低,这与前期本课题组给予非糖尿病肝硬化患者进行 200 kcal LES 的研究结果一致[18],其原因可能为LES提供了机体夜间能量来源,降低了空腹时机体对自身脂肪和蛋白质的分解,有利于维持三大营养物质代谢均衡。
在临床实践工作中,医生会考虑LES 是否会影响肝硬化合并糖尿病患者BMI 和血糖水平。SUZUKI 等[19]对36 例未应用降糖药物的Child-Pugh A 级病毒性肝炎肝硬化合并糖代谢紊乱(未达糖尿病诊断标准)的患者给予4 餐(即LES 管理),结果提示LES 可降低平均和高峰血糖水平,有利于血糖控制。本研究中,两组患者在基线和干预结束3 个月BMI 无差异;干预组患者在干预结束3 个月时HbA1c、FBG、FINS、HOMA-IR 低于非干预组;且干预组患者在干预前后HbA1c、FBG、FINS、HOMA-IR 均有改善。
本 研 究 发 现, 患 者FBG 总 体 稳 定 在6.0~9.0 mmol/L,且干预组干预结束3 个月时FBG 更接近理想范围6.0~7.0 mmol/L,没有发生低血糖及FBG 过高的情况,改善了患者胰岛素抵抗,分析可能原因是LES 避免了单次饮食量超过胰岛B 细胞工作的负担,使血糖不至于过高;当血糖下降时因避免了长时间禁食,从而避免了低血糖反应改善患者能量代谢。从肝脏功能评价来看,干预组患者干预结束3 个月TP、ALB、PALB 高于同组基线,说明lES 可以改善肝硬化合并糖尿病患者肝脏功能。
本研究尚存在一定的局限性,例如本研究样本量较小,对入组研究者要求较高,患者需具有较强的依从性,能够掌握营养师的饮食营养指导,具备对自身饮食、运动和血糖管理的能力,并且达到血糖控制稳定范围方可入组。整个研究中虽然患者降糖药物剂量没有变化,但因患者LES 时间较短,对胰岛B 细胞功能改善有限,应进一步延长时间观察LES 的临床效益,通过改善肝脏和胰岛B 细胞功能,从而可能会减少降糖药物剂量。不能否认患者糖代谢指标的改善既有使用降血糖药物的控制作用,也可能是在专业营养指导后的饮食习惯改善的作用。虽然本研究具有一定局限性,但是在真实世界研究中对于将LES 应用于肝硬化合并糖尿病患者这一特殊人群推广仍具有重大临床意义。
综上所述,低升糖指数、高碳水化合物的LES 不仅能改善肝硬化合并糖尿病患者蛋白质分解和脂肪氧化的代谢失衡,还有利于改善血糖控制情况,降低胰岛素抵抗,预防糖代谢紊乱可能引发的低血糖。
作者贡献:董金玲、孟庆华进行文章的构思与设计,结果分析与解释;董金玲、贾琳、朱跃科进行研究的实施与可行性分析;董金玲、王忠英、于红卫进行数据收集;董金玲进行数据整理、撰写论文;胡中杰进行统计学处理;孟庆华负责修订论文,文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
