乳腺癌保乳术术中冰冻切片分析切缘阳性的影响因素研究
2019-11-22陈晓李莹荆怡杨晓楠张晟
陈晓,李莹,荆怡,杨晓楠,张晟
美国乳腺及肠道外科辅助研究组(NSABP)及欧洲Milan 试验等研究证实,乳腺癌保乳术联合全乳放疗在患者无病生存率(DFS)及总生存率(OS)方面与乳房切除术相比无明显差异,乳腺癌保乳术已成为早期乳腺癌的标准治疗方式[1-3]。与乳房切除术相比,乳腺癌保乳术被认为与心理负担减轻相关,可以提供更好的美容效果,并降低伤口感染风险[4]。
虽然患者乳腺癌保乳术联合术后全乳放疗可以获得与乳房切除术相同的长期生存率,但乳腺癌保乳术的局部复发(LR)率略高[5]。与LR 相关的因素很多,但是乳房肿瘤切除术后阳性的手术切缘仍然是主要的影响因素,多达59%的患者可能会再次扩切或行乳房切除以达到阴性手术切缘[6]。乳腺癌保乳术最重要的缺点是在切除边缘或附近可能存在微小肿瘤[7]。因此,乳腺癌保乳术需要将肿瘤切除并保证切缘无残存肿瘤细胞,以减少LR 的风险。部分患者乳腺癌保乳术后最终的石蜡切片中发现阳性切缘,需要再次手术,而该情况会导致辅助治疗延迟,且与原发手术相比,乳房组织切除量增加导致乳房外观不佳,麻醉风险增加,医疗费用甚至疾病复发率增加[8]。为此,本研究旨探究乳腺癌保乳术术中冷冻切片分析(FSA)切缘阳性的影响因素,为临床如何提高乳腺癌保乳术一次成功率提供帮助。
1 资料与方法
1.2 方法
1.2.1 一般资料收集 回顾性收集患者的一般资料,包括:年龄、月经状态、肿瘤家族史、肿块距离乳头距离、肿瘤位置、术前是否行乳腺MRI、肿物沿导管病变情况、病理类型、组织学分级、病理T 分期、淋巴结有无转移、免疫组化分型情况。
1.2.2 手术步骤及术中FSA 行乳腺癌保乳术期间移除了肿瘤周围约2 cm 肉眼可见的正常组织边缘,以确保足够阴性边缘,部分肿瘤切除范围可达胸大肌筋膜和皮肤下平面。去除含肿瘤标本后,切除标本周围约0.5 cm的组织,制作冰冻切片,标记对应标本切缘位置,并进行病理检查。若术中FSA 结果阴性,则为保乳成功;若术中FSA 结果阳性,则根据术者判断选择进一步扩切或行全乳切除。
1.3 观察指标 患者乳腺癌保乳术初次切缘阳性、阴性情况,分析乳腺癌保乳术初次切缘阳性的影响因素,肿块距离乳头距离诊断乳腺癌保乳术初次切缘阳性的价值,以及影响乳腺癌保乳术初次切缘阳性位点数的相关因素。其中乳腺癌保乳术初次切缘阴性,或初次切缘阳性扩切后为阴性者,记为保乳成功者。
1.4 统计学方法 采用SPSS 24.0 统计学软件进行数据分析。不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验;计数资料以相对数表示,组间比较采用χ2检验;等级资料比较采用秩和检验。影响因素分析采用单因素分析及多因素Logisitic 回归分析。绘制肿块距离乳头距离诊断乳腺癌保乳术初次切缘阳性的受试者工作特征曲线(ROC 曲线),计算ROC曲线下面积及相应的最佳截断值、灵敏度、特异度。进一步分析可能影响切缘阳性位点数的因素,分类及分级变量采用多个独立样本非参数检验,连续变量采用Spearman 秩相关分析。以P<0.05 为差异有统计学意义。
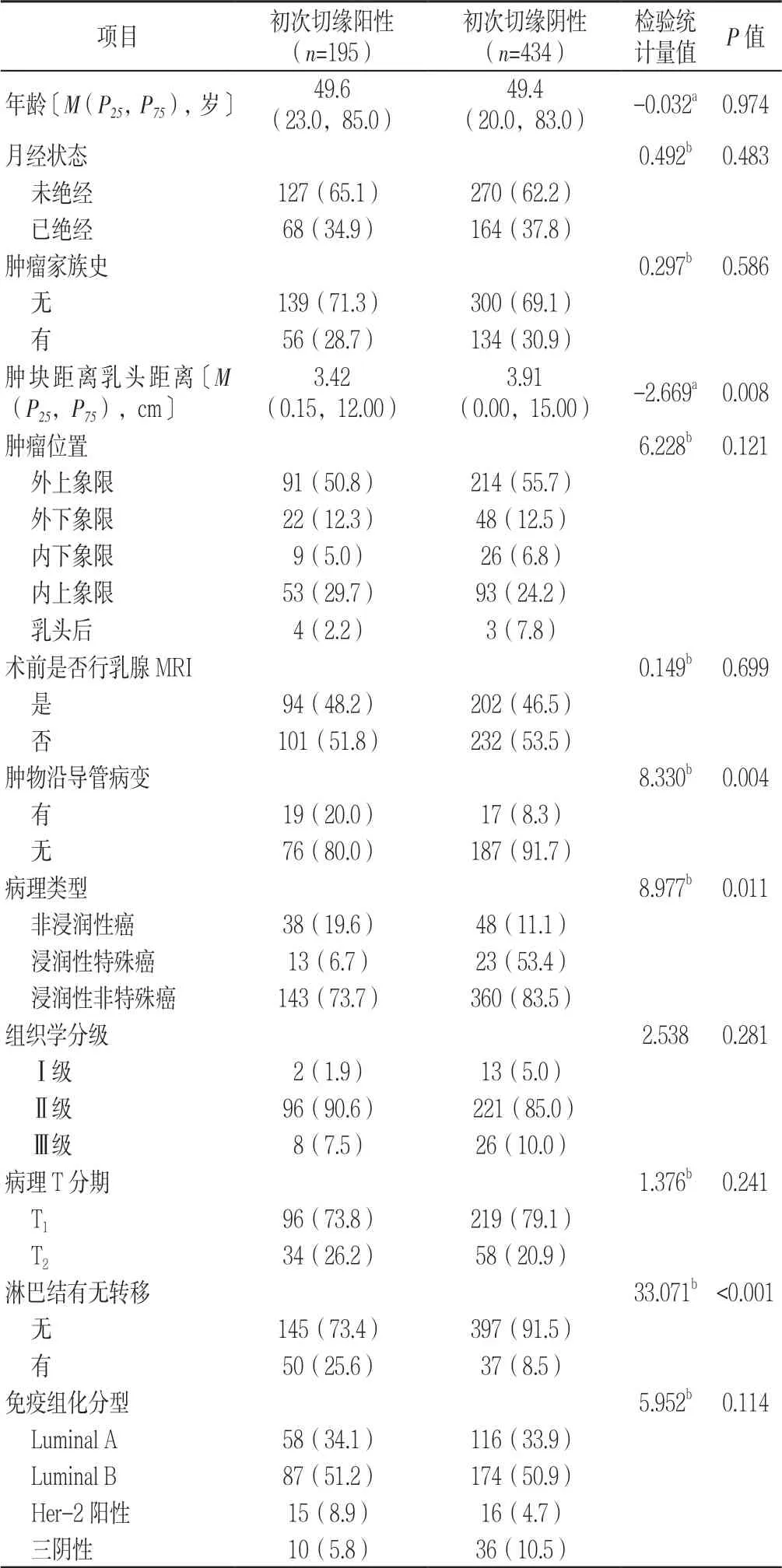
表1 乳腺癌保乳术初次切缘阳性影响因素的单因素分析 Table 1 Univariate analysis of factors affecting the initial positive margin in breast-conserving surgery
2 结果
2.1 基本临床病理资料 629 例患者中,初次切缘阳性195 例(31.0%),其中初次切缘阳性扩切后为阴性者92 例(47.2%),初次切缘阳性扩切后为阳性者7例(3.6%),初次切缘阳性即选择全乳切除术者96 例(49.2%);初次切缘阴性434 例(69.0%)。患者保乳成功者526 例(83.6%)。
2.2 乳腺癌保乳术初次切缘阳性影响因素的单因素分析 乳腺癌保乳术初次切缘阳性与初次切缘阴性患者年龄、月经状态、肿瘤家族史、肿瘤位置、术前是否行乳腺MRI、组织学分级、病理T 分期、免疫组化分型比较,差异无统计学意义(P>0.05);乳腺癌保乳术初次切缘阳性与初次切缘阴性患者肿块距离乳头距离、肿物沿导管病变、病理类型、淋巴结有无转移情况比较,差异有统计学意义(P<0.05,见表1)。
2.3 乳腺癌保乳术初次切缘阳性影响因素的多因素Logistic 回归分析 以乳腺癌保乳术初次切缘阳性为因变量(赋值:阳性=1,阴性=0),以单因素分析中差异有统计学意义的指标〔肿块距离乳头距离(赋值:连续变量)、肿物沿导管病变(赋值:有=1,无=0)、病理类型(赋值:非浸润性癌=1,浸润性特殊癌=2,浸润性非特殊癌=3)、淋巴结有无转移(赋值:有=1,无=0)〕变量为自变量,进行多因素Logistic 回归分析,结果显示,肿块距离乳头距离、肿物沿导管病变、病理类型、淋巴结有无转移是乳腺癌保乳术初次切缘阳性的影响因素(P<0.05,见表2)。
(10)Patent Litigation,Personal Jurisdiction,and the Public Good译文:专利诉讼、属人管辖和公共产品。
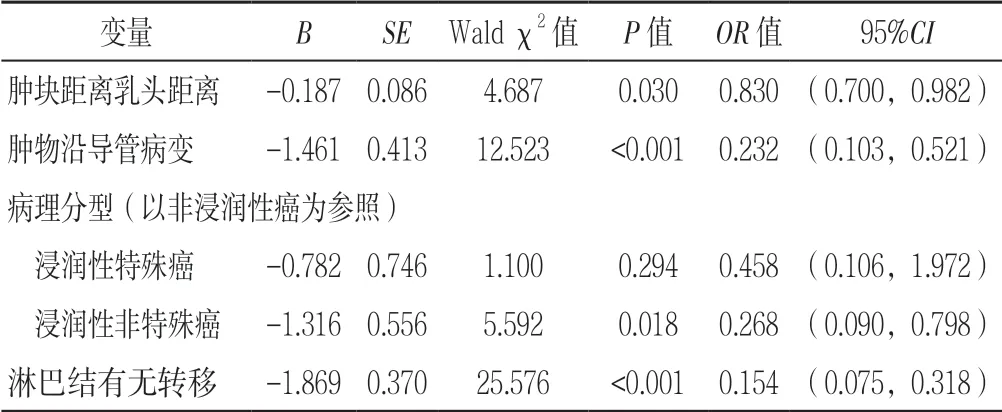
表2 乳腺癌保乳术初次切缘阳性影响因素的多因素Logistic 回归分析Table 2 Multivariate analysis of factors affecting initial positive margin in breast-conserving surgery
2.4 肿块距离乳头距离诊断乳腺癌保乳术初次切缘阳性的价值分析 肿块距离乳头距离诊断乳腺癌保乳术初次切缘阳性的ROC 曲线下面积为0.572〔95%CI(0.520,0.624)〕,最佳截断值为4.55 cm,灵敏度为0.815,特异度为0.333(见图1)。
2.5 影响乳腺癌保乳术初次切缘阳性患者切缘阳性位点数的相关因素分析 195 例乳腺癌保乳术初次切缘阳性患者中,99 例、55 例、22 例、19 例患者切缘阳性位点数分别为1、2、3、≥4 个。初次切缘阳性患者年龄为49.6(23.0,85.0)岁,肿块距离乳头距离3.42(0.15,12.00)cm;乳腺癌保乳术初次切缘阳性患者年龄、肿块距离乳头距离与初次切缘阳性位点无相关关系(rs值分别为-0.110、-0.118,P 值分别为0.127、0.133)。未绝经、术前未行乳腺MRI 患者乳腺癌保乳术初次切缘阳性位点数高于已绝经、术前行乳腺MRI 患者,差异有统计学意义(P<0.05);不同肿瘤家族史、肿瘤位置、肿物沿导管病变、病理类型、组织学分级、病理T 分期、淋巴结有无转移、免疫组化分型患者乳腺癌保乳术初次切缘阳性位点数比较,差异无统计学意义(P>0.05,见表3)。
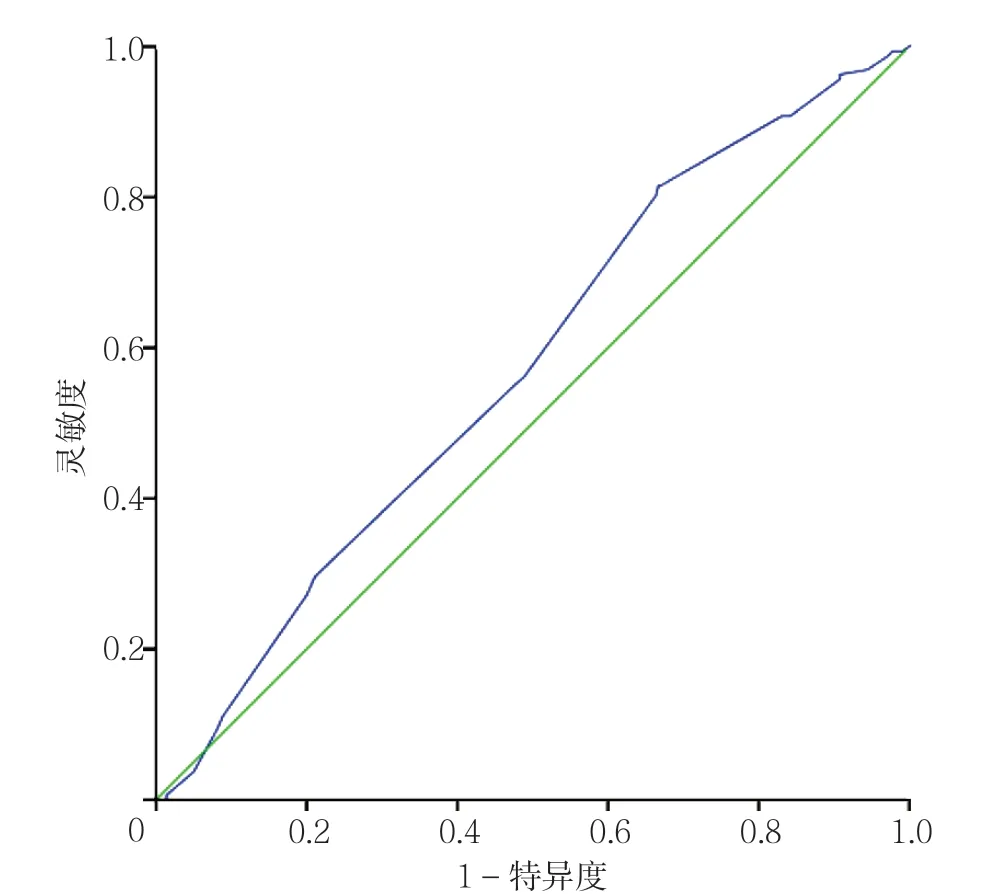
图1 肿块距离乳头距离诊断乳腺癌保乳术初次切缘阳性的ROC 曲线Figure 1 ROC curve of the distance from mass to nipple for the diagnosis of initial positive margin in breast-conserving surgery
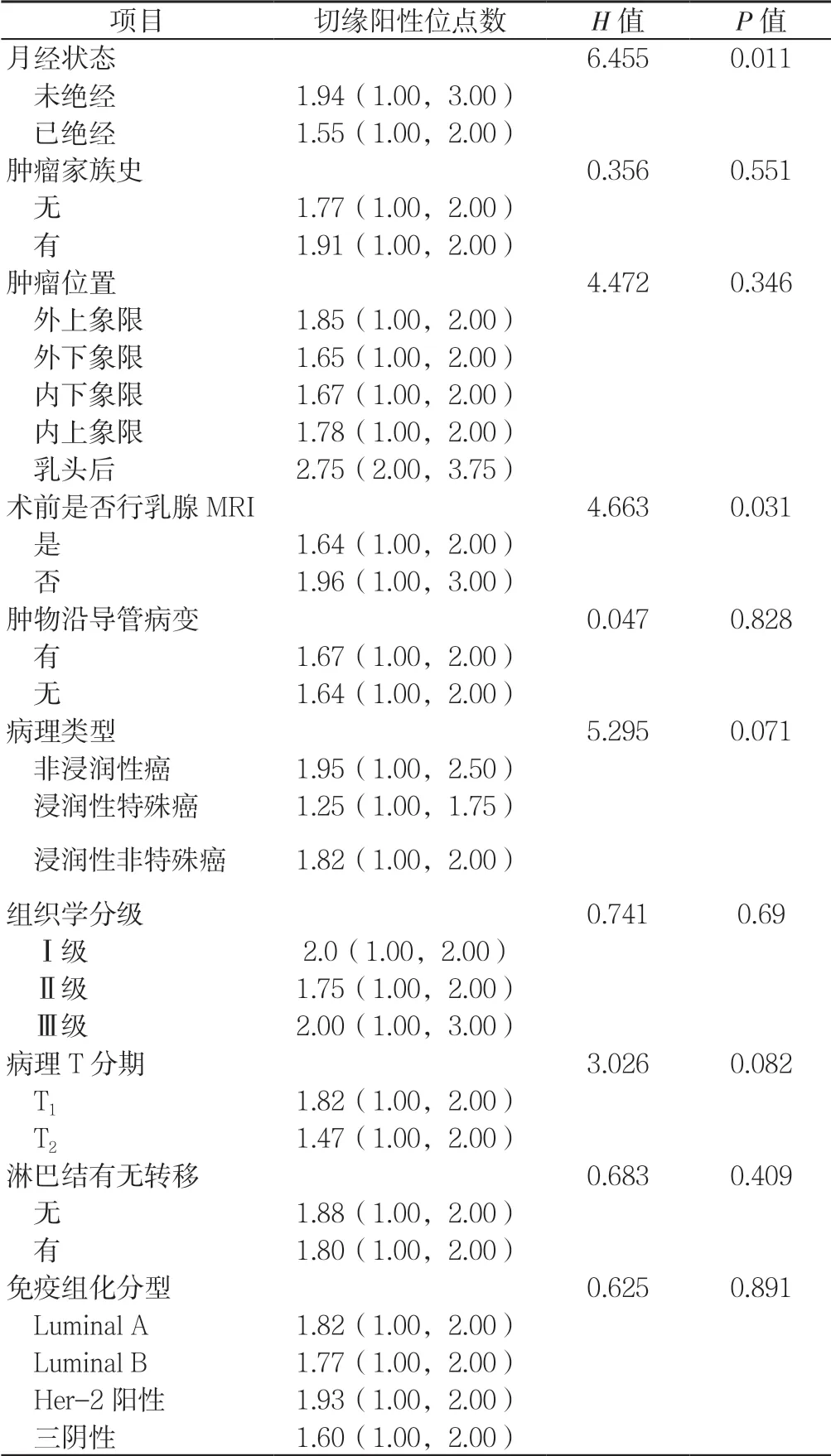
表3 乳腺癌保乳术初次切缘阳性患者切缘阳性位点数的相关因素分析〔M(P25,P75),个,n=195〕Table 3 Analysis of the factors influencing the number of initial positive margin in breast-conserving surgery
3 讨论
几项前瞻性随机对照试验表明,乳腺癌保乳术后放疗是早期乳腺癌治疗中乳房切除术的替代治疗方法[9]。与全乳切除术相比,乳腺癌保乳术最主要的缺点是由于在手术切缘处可能存在残留的微小肿瘤,并且由于残留乳房组织中可能存在肿瘤细胞,导致乳腺癌保乳术的LR 风险较高[10]。且有研究表明,乳腺癌保乳术LR 风险增高与较差的总体生存相关[11]。乳腺癌保乳术阴性手术切缘对于减少LR 局部复发至关重要,因此,乳腺癌保乳术中最重要的因素是实现显微镜下的阴性切缘 状态。
在乳腺癌保乳术中,如果术中未评估切缘状态,并且仅在最终石蜡切片时得知切缘状态为阳性,则必须再次手术以扩大切除边缘[9]。这会导致不良的美容效果,且延迟辅助治疗、增加发病率,增加患者焦虑情绪及成本等[12]。此外,由于乳腺癌保乳术初始手术产生的组织变化,外科医生很难确定再次手术时重新切除的边缘[13]。而术中评估切缘状态的主要优点是可以在同一手术中立即进行扩大切除。在术中通过冷冻切片评估切缘状态,再次手术率会极大降低[14-15]。2005 年CAMP等[16]研究发现,通过术中冷冻切片检查乳腺癌保乳术切缘状态的患者再次手术率与通过永久切片分析边缘状态的患者再次手术率分别为6.3%和36.5%,二者差异显著[16]。
本研究结果显示,患者保乳成功率83.6%,其中14.6%(92/629)的患者为术中FSA 初次切缘阳性扩切后为阴性,最终保乳成功。而国外有研究显示,59%的患者可能会再次扩切或行乳房切除以达到阴性手术切缘[6],这与国内外手术阳性切缘判定标准不同有关。2014 年美国肿瘤外科协会(SSO)/美国临床肿瘤学会(ASCO)/美国放射肿瘤学会(ASTRO)指南建议使用保乳术墨染切缘无肿瘤和全乳房照射(WBI)治疗的早期乳腺癌患者[17],国外乳腺癌保乳术切缘宽度较窄,本研究中患者行乳腺癌保乳术时切除标本周围约2.0 cm切缘宽度,因此切缘阳性率较低,这可能是造成再次扩切率存在差异的原因之一。但有1.1%(7/629)的患者扩切后仍无法达到切缘阴性状态,最终选择全乳切除术。有15.3%(96/629)的患者术中冰冻切缘初次阳性,即选择全乳切除术,这可能为与术者结合患者病情或术中与患者或家属沟通后的决定。
有研究发现,较低的BMI、肿瘤较大和病理证实多灶/多中心病变是接受乳腺癌保乳术患者边缘受累的独立危险因素[18]。多项研究提示,乳腺癌保乳术阳性切缘的预测因子包括小叶组织学、脉管侵犯、术前诊断不足、肿瘤较大、存在广泛的导管内成分、年龄较小、存在DCIS 和乳房钼靶发现微钙化灶[19-21]。
本研究多因素Logistic 回归分析结果显示,肿块距离乳头距离是乳腺癌保乳术初次切缘阳性的影响因素;绘制肿块距离乳头距离诊断乳腺癌保乳术初次切缘阳性的ROC 曲线发现,肿块距离乳头距离为4.55 cm 是最佳截断值,其灵敏度为0.815,特异度为0.333。因此进一步确定肿块距离乳头距离为影响乳腺癌保乳术切缘阳性的独立影响因素,但其预测价值及精确度仍需通过多中心、更大样本量的研究来进一步确定。
本研究多因素Logistic 回归分析结果显示,肿物沿导管病变、病理类型(浸润性非特殊癌)是乳腺癌保乳术初次切缘阳性的影响因素,表明非浸润性癌较浸润性非特殊癌保乳术术中冰冻初次切缘阳性风险大。非浸润性乳腺癌又称原位癌,指癌细胞局限在乳腺导管基底膜内的肿瘤,包括小叶原位癌和导管内癌。此外多项研究证实,导管原位癌成分已被证明是残留病灶的预测因素[19-20,22]。导管原位癌可沿导管蔓延播散,且常会超过切缘阴性所确定的范围。正因为导管原位癌的多灶性,常规建议需要保证足够大的手术切缘才能减少复发。已报道的与导管原位癌病变有关的切缘阳性状态所占比例从20%上升到81%[23-24],因此乳腺MRI 提示存在肿物沿导管病变时,行乳腺癌保乳术时应适当扩大切除范围以避免切缘阳性。虽然传统观点认为小叶原位癌既是乳腺癌风险因素,也是多灶性侵袭性乳腺癌的前兆,但是目前作为良性病变进行治疗,并且不要求完全切除和/或评估切缘状况,内分泌治疗被推荐用于小叶原位癌患者[25]。由美国癌症联合委员会(AJCC)出版的第8版中,TNM 分期中小叶原位癌不再作为原位癌[26]。
本研究多因素Logistic 回归分析结果显示,淋巴结有无转移是乳腺癌保乳术初次切缘阳性的影响因素。同时本文表3 所示,发生淋巴结转移的87 例患者中50 例切缘阳性,而未发生淋巴结转移的542 例患者中仅145例切缘阳性。淋巴结转移的患者肿瘤细胞通过淋巴管转移至淋巴结,这部分患者在行乳腺癌保乳术时存在脉管侵犯,有研究证实脉管侵犯是切缘阳性的预测因子[19]。因此若术前检查明确提示患者已发生淋巴结转移,应扩大切缘宽度以尽量避免切缘阳性。
本研究结果虽未提示切缘阳性受年龄影响,但当进一步分析切缘阳性位点数影响因素时发现,未绝经患者更倾向于发生多个位点切缘阳性的情况。国外一项研究结果显示,绝经前淋巴结阴性行乳腺癌保乳术的乳腺癌患者中,p53 水平升高〔RR=2.14,95%CI(1.13,4.05),P=0.02〕与较高的LR 风险相关[27]。p53 基因是一种抑癌基因,突变型p53 不仅失去了野生型p53 抑癌功能,还能促进恶性转化的活性,p53 阳性表达与乳腺癌临床分期晚及腋窝淋巴结转移等多项预后不良因素相关,因此猜测这可能与绝经前患者容易发生多个位点切缘阳性相关。此外术前是否行乳腺MRI 的患者切缘阳性位点数不同。有研究表明,术前动态增强乳腺MRI 显著提高了乳腺癌保乳术切缘评估的准确性,并极大降低了早期非肿块乳腺癌患者乳腺癌保乳术后切缘阳性的发生率[28]。另有研究证实,术前行乳腺MRI 评估中对乳腺癌保乳术的成功率有积极影响,提高了诊断的准确性和治疗效果[29]。本研究行乳腺癌保乳术的患者并未均行术前乳腺MRI 评估,未行乳腺MRI 的患者易造成术前诊断不足,进而影响乳腺癌保乳术成功率,因此建议行乳腺癌保乳术的患者术前根据乳腺MRI 进行乳腺肿物大小、有无多灶性病变及沿导管病变等情况的评估,以提高切除边缘宽度的准确性,提高乳腺癌保乳术一次成功率。
本研究局限性包括其为单中心样本研究和可能存在的选择偏倚。尽管如此,本研究结果已然可以清楚地证明与乳腺癌保乳术术中FSA 切缘阳性状态相关的临床病理因素。
综上所述,肿块距离乳头距离、肿物沿导管病变、病理类型、淋巴结有无转移是乳腺癌保乳术初次切缘阳性的影响因素,此外,未绝经、术前未行乳腺MRI 患者乳腺癌保乳术初次切缘阳性位点数高于已绝经、术前行乳腺MRI 患者。因此,拟行乳腺癌保乳术的患者均应于术前行乳腺MRI 进行评估,针对患者肿块距离乳头距离越近、肿物有沿导管病变、病理分型为浸润性非特殊癌、有淋巴结转移的患者,在行乳腺癌保乳术时应适当扩大切除范围以避免切缘阳性,从而提高乳腺癌保乳术一次成功率。
作者贡献:陈晓进行文章的构思与设计、研究的实施与可行性分析、文献及数据收集、数据整理、统计学处理、结果分析与解释、撰写论文;荆怡、杨晓楠负责部分数据收集与整理;李莹负责进行论文修订,英文的修订;张晟负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
