香菇多糖对神经胶质瘤SHG-44细胞增殖、周期、凋亡及迁移的影响
2019-11-21万茜淋任雨贺吕瑞娜李玉陈长宝刘淑莹
万茜淋 任雨贺吕瑞娜李 玉陈长宝∗刘淑莹
(1.长春中医药大学吉林省人参科学研究院,吉林 长春130117;2.吉林农业大学食药用菌教育部工程研究中心,吉林 长春130118;3.中国农业科学院特产研究院,吉林 长春130112;4.中国科学院长春应用化学研究所,吉林 长春130022)
香菇Lentinus edodes是香菇属的一个种,隶属于真菌界,担子菌门,蘑菇纲,多孔菌目,多孔菌科。香菇素有山珍之王之称,亦是著名的药食同源菌种,味甘、性平,在我国传统医学中用于治疗食欲减退、少气乏力等症[1]。香菇多糖(Lentinan,LNT)是从香菇中提取分离得到的结构以β-(1→3)-D-葡聚糖残基为主链的成分,也是香菇的主要活性成分。早在1969年,日本学者Chihara 等就研究发现香菇多糖的抗肿瘤活性,从研究到临床应用已近50年时间,香菇多糖一直是香菇中被学者们重点关注的活性成分[2]。
2017年2月,国家癌症中心发布了中国最新癌症数据,全国每天约1万人确诊癌症,每分钟约7人确诊患癌。神经胶质瘤,简称胶质瘤,也称为胶质细胞瘤,是最常见的原发性中枢神经系统肿瘤,是一种遗传易感性和环境致癌因素极高的脑部恶性肿瘤,约占所有颅内原发肿瘤的一半[3]。目前,胶质瘤的首选治疗手段为手术切除,但是由于其与正常脑组织无明显界限,难以达到细胞学上的彻底切除,术后复发快、复发率高、生存期短[4]。因此,针对神经胶质瘤的发生和发展,从根本上进行新型抗肿瘤药物的研发刻不容缓。
已有研究发现,香菇多糖具有抗肿瘤[5]、抗氧化[6]、抗抑郁[7]、抗衰老[8]、抗病毒[9]、抗辐射[10]以及免疫功能调节[11]等多种生物活性,并已经作为免疫增强剂部分应用于临床治疗,可见香菇多糖在学术及临床水平上,受到各国广泛的关注和认可。本实验以人神经胶质瘤SHG-44细胞为研究对象,考察香菇多糖对细胞增殖、周期、凋亡以及迁移的影响,为进一步研究香菇多糖抗肿瘤的作用机制及作用靶点提供理论依据。
1 材料
1.1 细胞株 人神经胶质瘤SHG-44细胞系,购于中国科学院上海细胞生物学研究所,由本实验室传代冻存。
1.2 试药 香菇多糖,购于上海源叶生物科技有限公司,批号C17S9Y69375,含有量>98%,褐色粉末。DMEM 高糖培养基(美国Sigma 公司,批号11965-084);超级新生牛血清(NBS)(杭州四季青生物工程材料有限公司,批号22011-8615);胰蛋白酶(上海生工生物工程有限公司,批号A100260-0010);Annexin V-FITC/PI 细胞凋亡检测试剂盒(江苏凯基生物技术有限公司,批号KGA108-1);DAPI 染色液(上海碧云天生物技术有限公司,批号C1005);细胞周期与细胞凋亡检测试剂盒(上海碧云天生物技术有限公司,批号C1052);Cell Counting Kit-8试剂盒(CCK-8 Kit)(Med Chem Express USA,批号HY-K0301);青链霉素双抗(上海生工生物工程有限公司,批号E607011-0100)。
1.3 仪器 倒置荧光显微镜(日本Nikon Ri2公司);酶标仪(瑞士TECAN);二氧化碳培养箱(美国Thermo BB150);四度医用冷藏箱(海尔SC-242D);双人单面超净工作台(苏净安泰空气技术有限公司SW-CJ-1C);全自动立式高压灭菌锅(致 微 GR60DA);台式离心机(美 国ThermoST8R);电热恒温水浴锅(精宏DK-S26);-20度冷冻冰柜(扬子BD/BC-148);加热鼓风干燥箱(精宏DHG-9240A);流式细胞仪(美国BD CantoⅡ)。
2 方法
2.1 神经胶质瘤细胞系SHG-44传代培养 人神经胶质瘤细胞系SHG-44,培养于含10% NBS 的DMEM 培养基,置于37 ℃恒温培养箱内,5% CO2培养,待细胞密度达到90%时,继续传代。
2.2 细胞增殖检测实验 采用CCK-8法检测香菇多糖对SHG-44细胞增殖的影响[12]。取对数生长期的SHG-44细胞,每孔接种6 000个细胞于96孔板,培养24 h。弃旧培养基,每孔加入100 μL 含药培养基,使药物浓度分别为0、0.25、0.50、1、2、4 mg/mL[13-14],同一质量浓度设5个复孔。继续分别培养24、48、72 h,每孔加入10 μL 的CCK-8溶液继续培养2 h,酶标仪测定吸光值A(450 nm 波长)。根据以下公式计算,活性抑制率=[(A0加药组-A加药组)/(A0加药组-A空白组)]×100%,lgIC50=lg 最大剂量-lg(最大剂量/相临剂量)[阳性反应率之和-(3-最大阳性反应率-最小阳性反应率)/4]。
2.3 细胞周期检测实验 选用细胞周期检测试剂盒检测SHG-44细胞周期。取对数生长期的细胞,每孔4×105个接种于6孔板,培养24 h。弃去旧培养基,每孔加入2 mL 含香菇多糖的新鲜培养基,使药物浓度分别为0、2、4 mg/mL,继续培养48 h,收集细胞,按照试剂盒操作步骤进行实验。
2.4 显微镜观察细胞形态 取对数生长期的SHG-44细胞,铺板及培养条件同2.3项下。香菇多糖加药浓度分别为0.00、2.295 mg/mL,继续培养48 h,显微镜下观察细胞形态并拍照。
2.5 细胞凋亡检测实验 利用Annexin V-FITC/PI双染试剂盒检测SHG-44细胞凋亡。取对数生长期的SHG-44细胞,铺板及培养条件同2.3项下,按照试剂盒操作步骤进行实验,用流式细胞仪检测分析。
2.6 细胞迁移检测实验 采用细胞划伤愈合实验[15]检测细胞迁移。取对数生长期的SHG-44细胞,接种于6孔板中,待细胞密度增殖至80%,用移液器吸头将细胞以井字划伤,PBS 洗涤,加药浓度分别为0、2.295 mg/mL,继续培养48 h,置于显微镜下观察并拍照。
2.7 统计学分析 统计学分析取3次重复实验结果,上述实验所得数据均使用Microsoft Excel 2010和SPSS 7.0数据处理系统进行统计,数据均以()表示,采用单因素方差分析、t检验,P<0.05差异具有统计学意义。
3 结果
3.1 香菇多糖对SHG-44细胞增殖的影响 由表1可见,香菇多糖对神经胶质瘤细胞SHG-44的增殖抑制作用呈浓度依赖性增加。香菇多糖处理SHG-44细胞48 h,抑制率IC50值为2.295 mg/mL,处理72 h抑制率IC50值为2.804 mg/mL。由于24 h 的最大抑制率未达到50%,因此IC50值仅作为参考,故选用48 h 的IC50值2.295 mg/mL 进行后续实验。
表1 香菇多糖对SHG-44细胞增殖的影响(, n=3)Tab.1 Effects of LNT on cellular proliferation of SHG-44(, n=3)

表1 香菇多糖对SHG-44细胞增殖的影响(, n=3)Tab.1 Effects of LNT on cellular proliferation of SHG-44(, n=3)
注:与0 mg/mL 香菇多糖组比较,∗∗P<0.01
3.2 香菇多糖对SHG-44细胞周期的影响 如表2所示,香菇多糖作用SHG-44细胞48 h 后,与0 mg/mL香菇多糖组比较,4 mg/mL 香菇多糖组细胞G1期比例显著升高(P<0.05);2、4 mg/mL 香菇多糖组细胞S 期比例显著减少(P<0.05,P<0.01),而G2期无明显变化。香菇多糖能够抑制细胞从G1期向S 期转变,将细胞周期阻滞于G0/G1期,从而抑制SHG-44细胞的增殖。
表2 香菇多糖对SHG-44细胞周期的影响(%,, n=3)Tab.2 Effects of LNT on cell cycle of SHG-44(%,,n=3)

表2 香菇多糖对SHG-44细胞周期的影响(%,, n=3)Tab.2 Effects of LNT on cell cycle of SHG-44(%,,n=3)
注:与0 mg/mL 香菇多糖组比较,∗P<0.05,∗∗P<0.01
3.3 香菇多糖对SHG-44细胞形态学的影响 如图1所示,香菇多糖处理48 h 后,显微镜常光观察,0 mg/mL 香菇多糖组细胞生长状态良好,形态完整,细胞数量相对较多,大小均一,细胞密集且铺展生长,连接紧密;2.295 mg/mL 香菇多糖组细胞数量显著减少,密度降低,且悬浮细胞逐渐增多,细胞形态皱缩,呈圆珠状,细胞核凸显,形态发生变异。
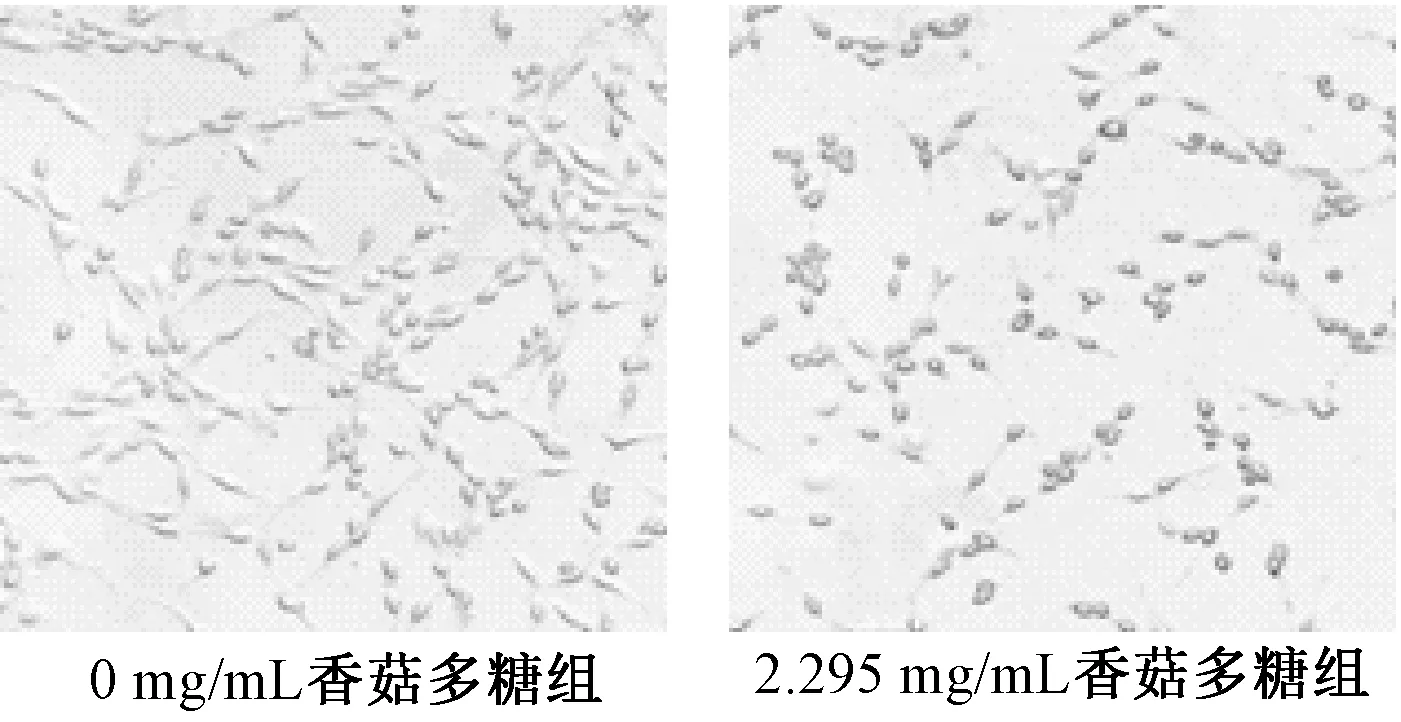
图1 香菇多糖对SHG-44细胞形态学的影响Fig.1 Effects of LNT on morphology of SHG-44 cells
3.4 香菇多糖对SHG-44细胞凋亡的影响 图2为流式细胞仪检测的凋亡散点图,Q1、Q2、Q3、Q4 4个象限分别代表死细胞、晚期凋亡细胞、活细胞、早期凋亡细胞。如表3所示,可进一步看出香菇多糖作用SHG-44细胞48 h 后,细胞的晚期凋亡及总凋亡比例有升高,但统计结果并未出现显著性差异。
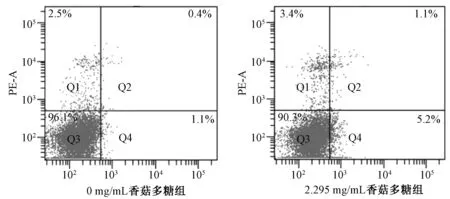
图2 香菇多糖对SHG-44细胞凋亡的影响Fig.2 Effects of LNT on apoptosis of SHG-44 cells
表3 香菇多糖对SHG-44细胞凋亡的影响(%,,n=3)Tab.3 Effects of LNT on apoptosis of SHG-44 cells(%,,n=3)

表3 香菇多糖对SHG-44细胞凋亡的影响(%,,n=3)Tab.3 Effects of LNT on apoptosis of SHG-44 cells(%,,n=3)
3.5 香菇多糖对SHG-44细胞迁移能力的影响如表4、图3所示,当SHG-44细胞处理48 h 后,0 mg/mL香菇多糖组细胞向划伤处迁移生长,2.295 mg/mL 香菇多糖组细胞向内生长较少,并且划伤处宽度略有增加;与0 mg/mL 香菇多糖组比较,2.295 mg/mL 香菇多糖组细胞划伤处面积显著缩小(P<0.01)。

图3 香菇多糖对SHG-44细胞迁移能力的影响Fig.3 Effects of LNT on migration ability of SHG-44 cells
表4 香菇多糖对SHG-44细胞迁移能力的影响(,n=3)Tab.4 Effects of LNT on migration ability of SHG-44 Cells(, n=3)
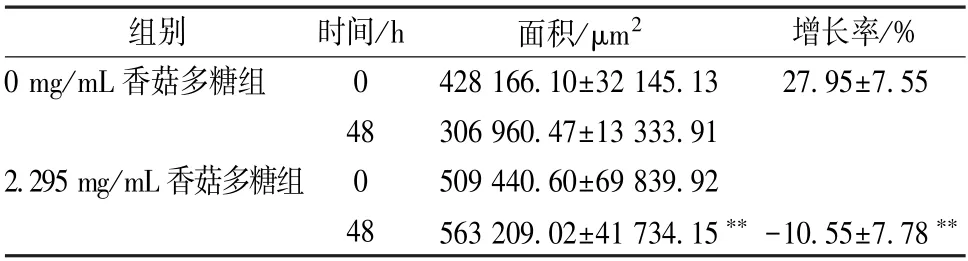
表4 香菇多糖对SHG-44细胞迁移能力的影响(,n=3)Tab.4 Effects of LNT on migration ability of SHG-44 Cells(, n=3)
注:与0 mg/mL 香菇多糖组比较,∗∗P<0.01
4 讨论
香菇,作为与人类生活密切相关的大型真菌,是应用最为广泛的食药用菌资源。中国是人工栽培香菇的发源地和世界香菇第一生产大国,目前,我国香菇年产量约为10万吨,占世界总产量的90%以上[16]。近年来,随着中药受到越来越多的关注,医学界逐渐采用中药辅助治疗多种疾病,中药制剂也作为放化疗之后改善机体免疫力、降低药物不良反应的功能性药物[17-20]。对于香菇多糖的药理活性研究,世界各国均在不同程度的开展。有研究发现,香菇多糖对小鼠肝癌细胞H22、小鼠肛门纤维肉瘤细胞S180、人肝癌细胞HepG2、人口腔上皮癌细胞株KB-3-1、人宫颈癌细胞株HeLa 等都有不同程度的抑制作用,并且可作为辅助剂与抗癌药物联用,发挥肿瘤抑制作用[21-23]。同时,在肿瘤免疫学方向,香菇多糖能够选择性地抑制黑色素瘤的炎症激活[24]。结合香菇多糖在提高免疫功能的作用机制研究,很可能是通过激活丝裂原活化蛋白激酶(MAPK)和NF-κB 2个信号途径调节免疫功能[25]。综合近几年研究成果,真菌提取物能够抑制多种肿瘤细胞的增殖,并诱导其凋亡,其机制与Wnt、NK-κB、MAPK、线粒体凋亡等多种信号通路相关,靶点包括了p38、Bcl-2、c-jun、IκB、βcatenin、Akt、ROS 等多种与细胞生物活动密切相关的蛋白[26-27]。
本研究采用CCK-8法检测香菇多糖对人类神经胶质瘤SHG-44细胞增殖能力的作用。CCK-8方法原理与MTT 相同,但操作方便,不用中途吸取细胞上层液体,避免细胞流失造成的细胞增殖数量误差,所得数据更加精确可靠。实验结果表明,香菇多糖能够显著抑制神经胶质瘤SHG-44细胞的增殖活性,并且呈剂量依赖;同一浓度分别培养24、48、72 h,与0 mg/mL 香菇多糖组比较,香菇多糖组的抑制作用显著(P<0.05,P<0.001),说明给药后细胞活性受到明显抑制,增殖能力受到显著影响。因此,后续实验中我们选取48 h 作为时间点,在不同浓度设置下,进一步探究香菇多糖的抗肿瘤作用机制。
随后,研究香菇多糖对SHG-44细胞周期的影响。研究发现,香菇多糖组细胞周期有显著的变化,G0/G1期显著增加,S 期明显降低(P<0.01),说明香菇多糖可通过调控细胞周期来抑制肿瘤细胞的增殖能力。因此,进一步检测处理48 h时,2.295 mg/mL 香菇多糖对细胞凋亡的影响。
利用显微镜常光下观察到药物对SHG-44细胞形态有很大影响,细胞呈串珠状,浓度明显低于对照组。通过DAPI 染色,在荧光显微镜下观察细胞核中有凋亡小体出现。进一步用Annexin V-FITC/PI 双染检测细胞凋亡情况,经分析得出香菇多糖能够诱导细胞发生凋亡,但并未表现出显著性差异。
最后,通过划伤愈合实验和显微镜分析观察药物对细胞迁移能力的影响,结果发现,0 mg/mL 香菇多糖组细胞明显向划伤处迁移生长;而2.295 mg/mL香菇多糖组细胞密度稀疏,不但不向划伤处生长,反而划伤区域面积显著增加(P<0.01)。可能通过抑制SHG-44细胞的迁移作用来控制肿瘤的发生和发展。
综上所述,本实验对香菇多糖对神经胶质瘤SHG-44细胞的抗肿瘤作用进行研究,结果发现其抗肿瘤作用明显,机制是可能通过对SHG-44细胞G0/G1期阻滞,影响细胞活力,抑制细胞增殖,并一定程度的诱导肿瘤细胞进行程序性凋亡;另一方面,还能抑制肿瘤细胞的迁移,达到减缓肿瘤细胞向外扩散的作用。同时,依据近年来研究成果,香菇多糖很有可能参与机体免疫系统的调控[28]。因此,香菇多糖抗肿瘤作用机制的相关研究值得更深入探索,对以香菇多糖为主要成分的保健食品、新型抗肿瘤药物及相关特殊疾病临床辅助用药的研发具有重要的理论指导意义。
