239例银杏达莫注射液安全用药分析
2019-11-21程小平陈兴莉刘生莲
程小平,陈兴莉,刘生莲,王 薇
(青海省药品不良反应监测中心,青海 西宁810007)
银杏达莫注射液(杏丁注射液)为我国第四代银杏叶提取物加入双嘧达莫的复方制剂,其主要成分为双嘧达莫、白果内酯、银杏黄酮苷、银杏苦内酯,每毫升含双嘧达莫0.34~0.44 mg、银杏总黄酮0.90~1.10 mg。银杏达莫注射液具有扩张动脉血管,降低血管壁通透性和改善水肿,降低缺血黏度、抑制血小板和红细胞的高聚集性,增加红细胞变形性、稳定细胞膜、维持正常细胞结构功能,能清除自由基,减少血栓形成,保护血管内皮细胞,增加血流量,同时能够防止脑、心缺血缺氧,改善神经元,治疗脑水肿、心室纤维化,促进脑细胞功能恢复等作用[1]。临床应用十分广泛,主要用于防治冠心病、血栓栓塞性疾病。随着银杏达莫注射液临床使用量的不断增多,此品种的安全性问题报道屡见不显。本研究对该药239例不良反应报告进行了统计和分析,了解其不良反应发生特点,提出有关建议和对策,促进临床合理用药。
1 资料与方法
1.1 资料来源 不良反应报告来源于国家药品不良反应监测系统青海省数据库,时间为2005年至2018年。排除重复、表述雷同和信息过于简单病例报告后,合格病例报告239例。其中严重病例报告8例,一般病例报告231例。
1.2 研究方法 采取回顾性研究方法,对患者年龄、性别、用药原因、合并用药、不良反应发生时间、累及系统器官、不良反应转归和关联性评价等进行统计分析。
2 结果
2.1 患者年龄和性别分布 239例中,男性患者118例,女性患者121例,男女比例为1 ∶1.03,表明不良反应发生率与性别关系不大。发生不良反应年龄段分布为51~60岁,占33.47%;41~80岁患者占绝大多数,比例高达86.61%,低于40岁和高于80岁年龄段仅占13.39%,与该药主要使用群为中老年群体有关。见表1。

表1 银杏达莫注射液不良反应年龄和性别分布
2.2 患者用药原因 患者局部肿胀共计137例,占57.32%。其他疾病还有血尿、蛋白尿、抗血小板、心慌气短、抽搐伴意识障碍、晕厥和大小便失禁、眼白内障超声乳化联合晶体植入术术后等,病因不详的5例。根据银杏达莫注射液说明书,其功能主治为预防和治疗冠心病、血栓栓塞性疾病。显然心慌气短、抽搐伴意识障碍、晕厥和大小便失禁、眼白内障超声乳化联合晶体植入术术后等42例,属于超适应症用药,占17.57%。
2.3 合并用药情况 239例报告中单独用药198例,占比82.85%;合并用药为41例,占比17.15%;合并用药有前列地尔注射液、灯盏细辛注射液、注射用奥扎格雷钠和胰岛素等。
2.4 用药剂量及溶媒 该药品说明书中规定静脉滴注,成人1次10~25 mL,加入0.9%氯化钠注射液或5%~10%葡萄糖注射液500 mL 中,在239例报告中,206例给药剂量符合规定,33例给药剂量高于规定量。选用的溶剂包括5%、10%的葡萄糖注射液,0.9%氯化钠注射液,葡萄糖氯化钠注射液,果糖注射液和辅酶Q10氯化钠注射液,部分用药过程存在溶媒超出说明书的规定。
2.5 不良反应发生时间 239例报告中,不良反应主要发生在用药30 min 内,共计94例,占比39.33%;30 min 以上的有90例,占比37.66%;不良反应发生时间不详的病例有55例,其中42例为给药过程中出现的,13例为时间不明确。见表2。
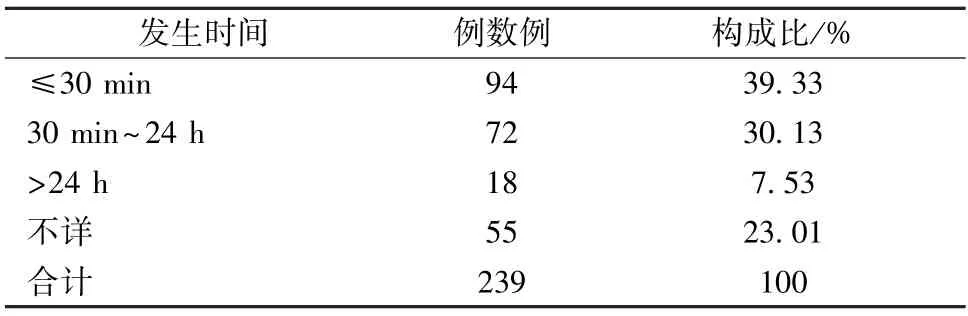
表2 不良反应发生时间分布
2.6 不良反应累及系统/器官及主要临床表现 银杏达莫注射液种不良反应统计共317例次,累及系统/器官前3位的分别是神经系统、皮肤及其附件和消化系统,主要不良反应为头痛、头晕、潮红、瘙痒、红斑、恶心、呕吐等,见表3。
239例报告中涉及两家生产企业,分别是通化谷红制药有限公司为113例,包括严重病例4份;山西晋德药业有限公司为126例,包括严重病例4份。经过比对本药国内6家生产企业的药品说明书,涉及的不良反应主要为偶有恶心、呕吐、头晕、皮肤过敏反应发生、罕见心绞痛加重,一旦停药症状立即消失,有出血倾向者慎用,与肝素、双香豆素等抗凝药同时用时易引起出血倾向,因此局部麻木、潮红、腹泻、口干、发热、胸闷、呼吸困难、视力模糊、静脉炎等不良反应在说明书中未记载。

表3 不良反应累及系统/器官及主要临床表现
2.7 严重不良反应报告情况 有8份严重报告,5例为女性患者,3例为男性患者;年龄51~78岁,占总报告比例的3.35%,其中过敏性休克5例,过敏样反应2例,晕厥、大小便失禁1例,8份报告均是单独用药,无死亡病例。该品种过敏性休克的发生比例较高,值得关注。
2.8 不良反应关联性评价及转归 239例不良反应关联性分为可能137例,占比57.32%;很可能96例,占比40.17%;肯定6例,占比2.51%。该药不良反应缓解或好转137例,占比54.81%,其中30 min 内76例,31~60 min 16例,1 h 以上13例,不详32例;痊愈102例,占比40.17%,其中30 min 内30例,31~60 min 22例,1 h 以上37例,不详13例;不良反应治疗的126例,未治疗的113例。
3 不良反应发生原因讨论
3.1 不良反应与患者方面原因 患者性别、年龄、过敏史,从性别分析男女比例为1 ∶1.03,说明不良反应发生率与性别关系不大,与Martin 等[2]研究结果相近。从年龄分布分析,不良反应主要发生在41岁以上,占比86.61%,原因可能与该药品的适应症为心脑血管及血栓栓塞性疾病有关;加之老年人肝肾功能减退增加了不良反应的发生风险[3];不良反应的发生与过敏史分析,未发现不良反应发生与患者有无药物过敏史有直接的关系。
3.2 不良反应与药品方面原因 从银杏达莫注射液制剂组方来看,该制剂成分较为复杂,为中药银杏叶提取物与双嘧达莫组成的复方制剂,中药注射剂在生产过程中需要加入一定量的辅料,如稳定剂、助溶剂、增溶剂等。通化谷红制药有限公司银杏达莫注射液的辅料为氯化钠、丙二醇、聚山梨酯80、依地酸二钠、注射用水,山西晋德药业有限公司银杏达莫注射液的辅料为维生素C、丙二醇、聚山梨酯80。丙二醇做为辅料有一定的危险性,可产生高渗透压、中枢神经系统抑制、乳酸性中毒、局部静脉炎及心脏毒性反应[14]。聚山梨酯80在中药注射液中广泛使用,易导致过敏反应,中药注射液的许多过敏反应与之有一定的关系。依地酸二钠可引起恶心、尿急、血液凝固性降低头痛等不良反应[15]。提取不纯时如含有蛋白质、淀粉、内酯、萜类、鞣质、树胶等杂质及半抗原成分,进入患者体内后,与体内的载体蛋白进行有机结合,诱导体内产生相当量的IgE,和机体中的Fc 受体结合,易导致机体过敏和其他不良反应[4]。目前由于有关中药注射剂基础研究较为薄弱,引起不良反应的机制、临床特点及增效减毒机理有待于进一步证明和深入研究探讨。
3.3 不良反应与使用方面原因 从监测结果来看,该制剂涉及不合理用药情况涉及超说明书适应症范围和剂量浓度不当两种,一是超适应症情况较为突出,占比为17.57%,另外文献[5-6]也有报道治疗晕厥,大小便失禁及眼白内障超声乳化联合晶体植入术术后恢复等超适应症的问题;二是超剂量浓度,33例报告(13.81%)超出说明书中规定剂量用药,文献[7-8]也有报道,某37岁男性患者,因2型糖尿病入院。给予生理盐水250 mL+银杏达莫注射液30 mL静脉输入;另一73岁男性患者,因脑梗死使用银杏达莫注射液30 mL 静脉滴注等,均属于超剂量使用情况。超剂量用药是导致出现严重不良反应的1个重要因素,有研究显示,错误服用双嘧达莫或者用药剂量过大,静脉滴注速度过快,超过5 mg/min,均能引起中毒,严重者能发生心率失常、昏厥[9]。
4 提高该品种疗效减少不良反应的相关对策
4.1 规范使用环节,合理用药
4.1.1 严格按照银杏达莫注射液说明书适应症、用量用法用药 根据说明书其功能主治为预防和治疗冠心病、血栓栓塞性疾病。显然在抽搐伴意识障碍、大小便失禁、眼白内障超声乳化联合晶体植入术术后等的用药超出了药品说明书中记载的功能主治范围,均属于不合理用药范围。如果需要扩大适应症范围,应主动对相应适应证按规定开展相应的非临床及临床试验研究,主动向药品监督管理部门提交补有关充注册申请,通过审评审批注册、修改该药品说明书功能主治,不能在没有研究证据的情况下随意扩大适应证和使用范围。关于超剂量和浓度的问题,中药注射液的使用有安全范围,加大剂量,不良反应发生的很可能就会增大[10]。因此要加强对医生合理用药的宣传,杜绝随意选用与说明书不一致的溶剂或随意增大剂量浓度来增大药效的错误观点。根据功能主治,该疾病主要集中于中老年人群,老年人生理特点是随着年龄的增加,肝肾功能逐渐减退,对药物的代谢和排泄速度相对减慢,药物半衰期延长,因此严格控制药物剂量和浓度要尤为重要,特别是久病、年老、体弱及肝肾疾病患者。在临床使用中针对患者的具体情况,应个体化给药,减少不良反应的发生[11]。
4.1.2 特殊人群慎用或者禁用 临床医师要辨证用药,严格按照《中药注射剂临床使用基本原则》,要仔细阅读药品说明书,必须遵循中医辨证论治的理论原则,严格掌握中药注射剂的适应证与禁忌症,合理个体化给药;使用该药品开始时应该仔细观察,输液速度过慢或者过快都容易导致不良反应增加,故用药过程中应该严格控制滴速,开始时滴速宜慢,根据实际控制滴速[12],一旦出现不良反应,应该立即停药对症治疗。
4.2 加强中药基础研究 银杏达莫注射液处方成分较为复杂,其中复杂的植物大分子物质和双嘧达莫可能与该产品安全性问题有关。由于中药注射剂所用中药材产地不同,受气候、土壤、采收季节等多条件影响,中药材的有效成分存在很大差异。原药材质量的不稳定性,导致中药注射液各批次间存在差异,导致的不良反应也不尽相同。因此,应严格控制中药材的来源,尽可能使原药材质量稳定,减少批次之间的差异[13-15]。加强药学及非临床研究,提高该产品的质量标准,从本质上解决制剂的安全性问题。
4.3 加强上市后该药品不良反应监测 从药物研究开发周期来看,由于药品上市前的Ⅰ、Ⅱ和Ⅲ期临床试验的样本量有限,导致有些不良反应在药品上市使用后才能发现,建议该药品生产企业对本厂家所生产的产品积极主动开展上市后的临床疗效跟踪、安全监测和评价。根据国家药品监督管理局药品评价中心反馈的监测信息和本企业研究结果,建议企业主动修改该药品说明书警示内容,及时指导医生临床合理用药,提高疗效的同时避免不良反应的发生。这不仅为患者的健康负责,同时也是为该药品生产企业负责,是企业生存和发展的自觉要求也是提高企业核心竞争力的举措。
