不同产地菜籽油的HPLC-DAD指纹图谱建立
2019-11-19华姝雯饶桂维
华姝雯,王 磊,饶桂维*
(1.浙江树人大学 生物与环境工程学院,浙江 杭州 310015;2.杭州师范大学 钱江学院理工分院,浙江 杭州 310018)
油菜花(Brassica campestris)是十字花科薹属植物,主要集中在长江流域,其籽粒是浸制油脂原料主要品种之一[1]。近年来我国的种植面积已超过900万hm2,产量占全国油料总产量的30%以上,居世界首位[2]。菜籽油是世界第二大油料作物,同时也是重要的生物柴油来源之一[3-4]。
菜籽多酚是油菜籽独有的具有氧化活性的,有抗肿瘤、降血糖、抑菌、清除自由基作用的一类重要次级代谢产物[5]。我国主要将其加工为菜籽油,因此菜籽油富含菜籽多酚等多种功能活性成分[6],被评为“最健康的食用植物油之一”[7]。但随着工业化的发展,土壤中的重金属含量日益增加,由于各地区的工业化程度不同,其土质不同,因此如何有效的鉴定菜籽油的食品安全具有重大意义。不同区域的油菜品种,油菜籽的干燥方法和其榨油机械、加工过程和油脂精炼存在较大差异,因此菜籽油中菜籽多酚含量、磷脂含量以及产品品质有很大的不同[8-12]。且不同产地的油菜籽氨基酸组成和总酚含量也不同[5,13]。
由于HPLC具有分离效能高、选择性好、灵敏度高、分析速度快、应用范围广等特点,HPLC指纹图谱法已成为中药指纹图谱技术的首选方法[14-15]。本实验采用高效液相色谱法对18种不同产地的菜籽油进行指纹图谱研究,为不同地区菜籽油的初步鉴别和质量评价提供参考。
1 材料与方法
1.1 材料与试剂
材料:选取浙江、上海、苏州、安徽等地区出产的菜籽油,其样品编号和来源地见表1。

表1 供试菜籽油的产地及编号Tab.e 1 habitats and number of experimental rapeseed oil
试剂:乙腈(色谱纯):TEDIA,美国、甲醇(分析纯):永华化学科技、磷酸(分析纯):永华化学科技,使用水为超纯水。所用溶液使用前均用0.22 μm滤膜过滤。
1.2 仪器与设备
液相色谱仪(配有DAD检测器)Agilent 110系列:Agilent公司,美国;超低有机物型纯水系统Milli-Q:Millipore公司,美国;高速离心机LG10-2.4A:北京时代北利离心机有限公司;紫外分光光度计L6S:上海精科;电子天平PL402-L:梅特勒-托利多仪器有限公司;超声波清洗器JK-100:合肥金尼机械制造有限公司;玻璃仪器快速烘干器C型30:长城科工贸有限公司;漩涡混合器XW-80A:宁波新芝生物科技股份有限公司。
1.3 菜籽油提取方法
准确称取油样品5 g(精确至0.0001),置于50 mL离心管中,加入8 mL甲醇(提取溶剂)。旋涡混合3 min,放置2 min,以3000r/min离心5 min,取出上清液于25 mL容量瓶中,残余物每次用8 mL甲醇提取两次。三次的清液均合并于25 mL容量瓶中,并用甲醇定容,摇匀,得到样品溶液,再将溶液用0.22 μm有机滤膜过滤,得到样品供试液。
1.4 实验条件的选择
1.4.1 提取溶剂
按1.3节方法将其中的提取溶剂改为:甲醇、乙醇、乙腈。不同的溶剂提取各平行三次,通过色谱分析,将数据取平均值,以确定最佳提取溶剂。
1.4.2 色谱分析的波长
将18个样品按1.3节制备得到样品供试溶液,分别用移液枪移取500μL该溶液于10 ml容量瓶中,并用甲醇定容至刻度。将样品溶液分别置于比色皿中,利用紫外可见分光光度计扫描样品供试溶液,扫描波长范围为200 nm-300 nm,每个样品各扫描1次。
1.4.3 色谱流动相
为了确定好的分离条件,选择甲醇-水、乙腈-水、乙腈-0.1%磷酸、甲醇-0.1%磷酸溶液为流动相,分别对样品供试液进行色谱分析,选择分离效果最好的为实验的流动相。
1.4.4 色谱条件
色谱柱:Hypersil ODS C18(4.6 ×250 mm,5μm),流速:1 mL/min;柱温:35 ℃;进样量:10 μL。流动相:A相和B有机相;洗脱程序:0~10 min,10%~30%B;10~20 min, 30%~60%B;20~30 min,60%~90%B;30~40 min,90%B。 通过波长和流动相的确定,根据出峰情况需调整洗脱程序时间和流动相比例。
1.5 方法学考查
1.5.1 稳定性实验
取S18样品供试液,按1.4.4所提出的色谱条件,分别选择在0、3、6、9、12、15h进样,将峰值最突出的三个色谱峰为参照峰,计算各自的保留时间和峰面积的RSD值[16]。
1.5.2 精密度实验
取S18样品供试液,按1.4.4所提出的色谱条件,连续6次进样,将峰值最突出的三个色谱峰为参照峰,记录他们的保留时间和峰面积,计算各自的RSD值[16]。
1.5.3 重复性实验
按1.3节平行制备6份S18供试样品溶液,按1.4.4所提出的色谱条件,连续6次进样,将峰值最突出的三个色谱峰为参照峰,记录并计算各自的相对保留时间和相对峰面积的相对标准偏差[16]。
1.6 样品的测定
取18个样品,按1.3节的方法制备得到供试样品溶液,在1.4.4节的色谱条件下进行检测,采集18个油样品在45 min内的色谱图。
1.7 指纹图谱的数据处理
1.7.1 相似度分析
分别将18个供试样品的色谱图导入《中药色谱指纹图谱相似度评价系统(2004年A版)》,采用多点校正后匹配,建立18个不同产地菜籽油的指纹图谱,以生成的特征指纹图谱共有模式为对照,计算得出各地区油样品的相似度。
2 结果与分析
2.1 实验条件的确定
2.1.1 提取溶剂
用乙醇、甲醇、乙腈3个有机溶剂提取菜籽油样品,分别得到3个色谱图,根据谱图结果发现,以采用甲醇提取的色谱峰数目最多,分离效果较好,所以实验采用甲醇作为提取溶剂提取菜籽油样品。
2.1.2 色谱分析的波长
由图1可知,样品溶液在紫外波长为210 nm、270 nm和280 nm处吸收峰较高。由于210 nm处波长较短,溶剂效应较强,故排除210 nm为最佳吸收波长。通过预实验测得270 nm和280 nm波长下的图谱发现,波长为280 nm时的色谱峰数目比270 nm多,所以实验选择280 nm为色谱分析波长。

图1 样品紫外光谱扫描图Fig.1 UV spectrogram of sample
2.1.3 流动相的确定
分别用甲醇-水、乙腈-水、乙腈-0.1%磷酸、甲醇-0.1%磷酸溶液作为流动相对S18样品供试液进行色谱分析实验,通过对这四个谱图比较发现乙腈-0.1%磷酸溶液作为流动相的各峰分离效果较好,色谱峰形较好,故选择乙腈-0.1%磷酸溶液作为实验的流动相。
2.1.4 洗脱程序的优化和色谱条件的确定
色谱柱:Hypersil ODS C18(4.6 ×250 mm,5μm),流动相:0.1%磷酸溶液(A)和乙腈(B);经多次实验得出较为理想的梯度洗脱条件:0~15 min,10%~18%B;15~16 min,18%~30%B;16~26 min,30%B;26~31 min,30%~60%B;31~36 min,60%~90%B;36~40 min,90%B;40~45 min,90%~10%B,流速:1 mL/min;柱温:35 ℃;进样量:10 μL。
2.2 菜籽油指纹图谱的建立
2.2.1 指纹图谱的建立及相似度评价
将18个油样品色谱图导入《中药色谱指纹图谱相似度评价系统(2004年A版)》软件里,对样品图谱进行数据分析,设置S18为参照指纹图谱,时间窗宽度设为0.3 min,采用多点校正后进行匹配,建立18种菜籽油的HPLC指纹图谱共有模式(平均值法),根据匹配结果确定23个共有峰(图2), 并生成对照指纹图谱(图3)。
计算出各批次样品的指纹图谱相似度。根据相似度分析结果(表2),S1、S2、S3、S4、S5、S6、S7、S8、S10、S11、S12、S14、S16、S17样品相似度大于0.8;而S9、S13、S15、S18样品相似度较低,与其他样品相差较大。
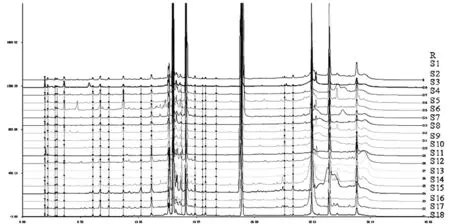
图2 18个样品的HPLC指纹图谱Fig.2 HPLC fingerprints of 18 samples

图3 菜籽油的对照指纹图谱Fig.3 rapeseed oil contrast fingerprints

表2 18种菜籽油相似度评价结果Tab.e 2 Similarity evaluation results of 18 kinds of rapeseed oil
2.2.2 指纹图谱中共有峰指认
对标准维生素E样品进行高效液相测定(图4),根据出峰时间顺序,确认1 2 3号峰分别为α-生育酚、β-生育酚、γ-生育酚。根据相对保留时间,并对照共有峰的保留时间,指认了指纹图谱23个共有峰中的α-生育酚(13号峰)、β-生育酚(19号峰)、γ-生育酚(22号峰)。19号峰β-生育酚峰形好,峰面积图谱中所占比例较大且稳定,并为18个样品所共有,相较于13号峰,19号峰与相邻色谱峰的分离度良好,易于识别,故选其为特征图谱的参照峰。以β-生育酚峰为参照峰,计算23个共有峰相对峰面积,结果见表3。由表中结果可看出统一保留时间共有峰相对峰面积的RSD值相差很大,说明不同地区因地理环境,种质资源等外界因素对菜籽油化学成分含量有一定差异,导致其质量存在差异。

1.α-生育酚;2.β-生育酚;3.γ-生育酚;1.α- Tocopherol 2.β- Tocopherol;3.γ- Tocopherol
图4 维生素E的对照图谱
Fig.4 Vitamin E contrast fingerprints

表3 共有峰的相对峰面积Tab.e 3 relative peak area of the common peak

表3(续)
2.4 方法学评价
2.4.1 稳定性
取S18样品供试液,在2.1.4色谱条件下分别在0、3、6、9、12、15h下进样,以13(α-生育酚峰)、19(β-生育酚峰)、22(γ-生育酚峰)为参照峰,记录各相对峰面积和相对保留时间,结果见表4。计算得出峰面积的平均RSD为2.18,保留时间的平均标准偏差为0.53,无论是个体或平均RSD均小于3,结果表明该方法具有良好的稳定性。

表4 稳定性实验结果Tab.e 4 stability test results
2.4.2 精密度
取S18样品供试液,按2.1.4节的色谱条件,连续6次进样,以13(α-生育酚峰)、19(β-生育酚峰)、22(γ-生育酚峰)为参照峰,记录各峰的相对保留时间、相对峰面积,结果见表5。计算得出峰面积的平均RSD为0.91,保留时间的平均RSD为0.31,无论是个体或平均RSD均小于3,结果表明该方法具有良好的精密度与准确度。

表5 精密度实验结果Tab.e 5 precision test results
2.4.3 重复性
将样品S18按1.3节平行制备供试样品溶液6份,按2.1.4节的色谱条件,连续进样6次,以13(α-生育酚峰)、19(β-生育酚峰)、22(γ-生育酚峰)为参照峰,记录各峰的相对保留时间、相对峰面积,结果见表6。计算得出峰面积的平均RSD为1.12,保留时间的平均RSD为0.52,无论是个体或平均RSD均小于3,结果表明该方法具有良好的重复性。

表6 重复性实验结果Tab.e 6 repeatability test results
3 结论
本实验通过HPLC-DAD法测得18个不同产地菜籽油的色谱图,并摸索出最适合菜籽油指纹图谱建立的色谱条件:以乙腈和0.1%磷酸为流动相,洗脱梯度为0~15 min,10%~18%B;15~16 min,18%~30%B;16~26 min,30%B;26~31 min,30%~60%B;31~36 min,60%~90%B;36~40 min,90%B;40~45 min,90%~10%B,色谱分析波长为280 nm,流速1 mL/min,进样量为10μL。在《中药色谱指纹图谱相似度评价系统(2004年A版)》建立18个不同产地菜籽油HPLC-DAD指纹图谱,以S18为对照指纹图谱计算出18个油样品的相似度,结果得出除S9、S13、S15、S18(盐城大丰、上海静安、温州乐清、宁波慈溪)外,其他油样品的相似度均大于0.8;并标示出23个共有峰,三个已确认成分,分别为α-生育酚(13号峰)、β-生育酚(19号峰)、γ-生育酚(22号峰)。本实验方法重现性好,具有一定的专属性,为不同地区菜籽油的初步鉴别质量评价提供了参考。
