五因素混水平正交实验优化鱼鳞胶原提取工艺
2019-11-19李泽民何生林丁云桥杨成功王荣浩张峥刘洪博
李泽民,何生林,丁云桥,杨成功,王荣浩,张峥,刘洪博
(齐鲁工业大学(山东省科学院) 化学与制药工程学院,山东 济南 250353)
胶原是细胞外基质(ECM)的结构蛋白质。它的基本结构是由3条分子质量约为95KDa的肽链,以三股螺旋方式相互缠绕而形成的分子质量约为300KDa的巨型蛋白质分子,大约有1000个氨基酸。胶原分子间相互联结成网状结构,形成富有弹性的组织构造[1]。胶原结构的有序性、取向性、功能性和可控性及其良好的生物活性、生物相容性,可降解,无毒,不引起异体免疫反应等优良性能,使其在化妆品、生物基新材料、医学和食品等行业有广泛的应用和市场前景[2-4]。
目前的胶原蛋白常来源于哺乳动物皮肌腱、骨骼等。考虑到疯牛病、口蹄疫等不安全因素的存在,一些发达国家目前正禁止从哺乳动物皮中提取胶原蛋白,他们积极寻找安全的胶原蛋白来源。鱼鳞中的胶原蛋白的纯度较高,来源广,价格低廉,生产环境卫生等,作为胶原蛋白的提取来源,有很高经济价值[5]。对鱼源胶原提取的工作,国内外有不少报道[6-7]。王哲平等研究表明,在40℃条件下,刺参胶原蛋白不仅三级螺旋结构打开,二级结构被破坏,一级结构也已经发生了变化,α链和β链发生降解,形成不同分子量的多肽链[8]。刘文涛等在黑鱼鱼鳞的结构中用透射电镜表明了鱼鳞中胶原纤维成正交式夹板结构分布,这个结果对以后提取鱼鳞中的胶原蛋白有一定的参考意义[9]。目前,常用的鱼鳞胶原提取方法有:酸法、碱法、盐法、酶法等。由于胶原分子在水中的溶解度较低。有一部分未能共价交联或者体内未成熟的胶原可用中性盐或稀酸溶液溶解而提取出来[1]。张俊杰等进行了鲤鱼酸溶性胶原蛋白提取的研究,发现脱钙前用碱处理鱼鳞,会提高提取率,并且胶原蛋白的提取率与温度成正比[10]。涂灿时等在对胶原蛋白提取用正交实验的方法发现在酸提取中,柠檬酸的提取率最高[11]。
胶原的酸法提取成本低,提取后的分子结构稳定,且提取过程中不生成有害物质。但是,相对于酶法等,酸法提取率较低。为了保证提取纯度,得到更高的胶原提取率,本试验采用草鱼鱼鳞等作为原料,使用酸法提取鱼鳞胶原。通过五因素混水平正交实验设计,进行提取工艺的优化,对提取的胶原蛋白进行结构与性质的分析与表征。我国淡水鱼产量丰富[12],但是淡水鱼的加工仅局限于对鱼肉的利用,对鱼鳞等下脚料的利用较少。大部分都被废弃,这不仅严重污染环境,而且造成资源的极大浪费[13]。因此,鱼源胶原的提取不仅可以减少环境污染,增加企业经济效益,对提高我国水产加工技术水平,促进渔业经济快速发展具有重要意义[14]。
1 实验部分
1.1 试剂与仪器
新鲜草鱼鱼鳞。
所用化学试剂均为分析纯。
DFY-5L40低温恒温反应浴,巩义市予华仪器有限责任公司;Centirfuge 5430R 冷冻离心机,德国Eppendof台式高速离心机; BSA124S赛多利斯高精度分析天平,上海锡为科学仪器有限公司;BSA124S赛多利斯分析天平,上海锡为科学仪器有限公司;MD 34mm Size 5m MW8000-14000的透析袋,Made In USA。
1.2 实验方法
新鲜鱼鳞用自来水清洗3~4次去除表面杂质,室温晾干12 h。称取12.5 g鱼鳞于250 mL 0.5 %的NaCl溶液中,对鱼鳞杂质再次清洗,时间为48 h,每12 h换一次溶液。低温(10 ℃)搅拌,转速20 r/min。
将除杂的鱼鳞放入250 mL 0.5 mol/L的Na2CO3溶液中,搅拌24 h,10 ℃低温搅拌,转速为20 r/min。
将清洗后的鱼鳞加入250 mL 0.5 mol/L pH值=7.5的EDTA-2Na缓冲液中对鱼鳞的进行脱钙处理;脱钙时间为48 h,每12 h换一次溶液。10 ℃低温搅拌,转速为15 r/min。脱钙后的鱼鳞加250 mL 0.1 mol/L pH值=8.03 PBS(Na2HPO4-NaH2PO4)缓冲液脱出鱼鳞中的杂蛋白48 h,每12 h换一次溶液。10 ℃低温搅拌,转速为15 r/min。
用250 mL 0.5 mol/L的醋酸溶液对处理好的鱼鳞进行胶原蛋白的提取;提取时间48 h,每12 h换一次溶液。10 ℃左右低温搅拌,转速为15 r/min。所得溶液汇集于1 L的广口烧瓶中并放入冰箱冷藏(冰箱冷藏室为5 ℃)。最后用滤布过滤收集的提取液,往提取液中添加NaCl粉末时逐渐有沉淀释出,NaCl浓度至5 %时停止添加。然后在5 ℃下冷冻离心二十分钟,转速为7500 r/min;取其沉淀再用0.5 mol/L pH值=3.50的醋酸缓冲液250 mL复溶解后再盐析,5 ℃下冷冻离心后收集沉淀,称重后加入0.5 mol/L pH值=3.50 约80 mL左右的醋酸缓冲液中溶解冷冻离心的沉淀。
把离心沉淀完全溶解后的溶液加入四个约13 cm长、截留分子量为10000 Da、直径为3.4 cm的透析袋中,将透析袋置入1 L的烧杯中,加入浓度为0.1 mol/L pH值=3.50的醋酸缓冲液(所加溶液量淹没透析袋为佳)中透析一天。再换用蒸馏水对透析袋中的样品透析3天,每12 h换一次蒸馏水。3天后取出透析袋中的样品放入培养皿中。称重后,放入冰箱冷冻室预冻;最后再用冷冻干燥机对样品冷冻干燥,冷冻干燥后得到产品并进行称重,放入干燥的试样管中密封低温冷藏保存。
以上操作换取相同溶液时没有用蒸馏水清洗过上次处理鱼鳞剩下的溶液;换取不同溶液时,都使用蒸馏水清洗2~3次,才加入新的配制溶液。
1.3 性能测试
1.3.1 胶原的分子量测定
SDS-PAGE电泳试验的谱图如下:

图1 草鱼鱼鳞的SDS-PAGE电泳谱图Fig.1 SDS-PAGE Electrophoresis Spectrum of Carp
标准蛋白Marker自上而下有8条带,如图1所示,分子量区间为300-40kDa。编号1、2均为提取的胶原蛋白。图1显示,有三条明显的谱带位于100-130kDa,计算得到三条带的数均分子量大致为116kDa,110kDa,104kDa,总数均分子量为330kDa。两条α谱带,α1分布非常宽,说明提取物中肽链的分子量及胶原本身的分子量分布有较大范围的分散。由此判断产物主要为I型胶原蛋白,还含有部分II型胶原蛋白。
1.3.2 胶原的元素分析

表1 草鱼鱼鳞胶原蛋白元素分析表Tab.e 1 Analysis Table of Collagen Elements in Grass Carp Scale
胶原蛋白的元素组成:C:50.0%~55.0%,H:6.5%~7.5%,N:15.0%~19.0%,S:0.2%~0.5%[15]。胶原蛋白的元素组成为C、H、N、S,由表可以看出H、S、N的含量均符合比例,C的含量有微小的差别,可能因为鱼鳞的种类不同造成的。
1.3.3 胶原的红外吸收光谱

图2 草鱼胶原蛋白IR谱图
Fig.2 IR spectra of grass carp collagen
提取物的红外测试如图2所示。酰胺A带位于对应的区间内。酰胺Ⅰ(1638 cm-1)对应于C=O的β-折叠区间,为胶原多肽组成的骨架,是胶原二级结构变化的特征区。酰胺Ⅱ(1449 cm-1)和酰胺III(1385 cm-1)也能证明胶原的三股螺旋结构。
1.3.4 胶原的粉末衍射图
粉末衍射使用的仪器是德国Bruker D8衍射仪,管电流40 mA,管电压40 kV,为Cu靶,步长0.03。/步,步速0.1秒/步,采用林克斯阵列式探测器。
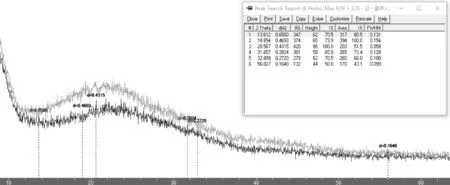
图3 草鱼胶原蛋白X射线衍射图
Fig.3 X-ray Diffraction of Collagen from Grass Carp
由Jade软件分析,按数学上的“二阶导数”否为0来自动寻峰。因最终确定的峰如上图,作表如下:

表2 草鱼X射线衍射图谱对应的D值Tab.e 2 D Value Corresponding to X-ray Diffraction Patterns of Grass Carp
经过后期对比分析,取 Å1、Å3、Å4三个角度为参考,分析得提取的草鱼鱼鳞的酸溶性胶原蛋白的分子链的间距为0.6500 nm,三条链簇成胶原蛋白分子的直径大约1.5nm,符合胶原常规结构,提取干燥后的胶原蛋白的分子间的范德华力和氢键效应减弱不大,生物稳定性良好。Å3峰对应的数值在理想的α-螺旋中,螺距为0.95 nm,相邻氨基酸残基的距离为0.15 nm。在胶原蛋白的螺旋结构中,每圈螺旋含有的氨基酸残基数与理想的α-螺旋氨基酸残基数目有所不同,实验样品得到的Å4峰对应的d值显示出胶原蛋白的螺旋结构上沿旋转中心轴相邻氨基酸残基之间的距离为0.2824 nm。说明实验得到的胶原蛋白保持了较好的生物活性与螺旋结构。
1.3.5 胶原的圆二色图

图4 胶原蛋白CD图Fig.4 Collagen CD Map
圆二色(CD)测试谱图如上,提取物在221nm波长处有正吸收峰,是左旋聚脯氨酸(P-II)构型肽链圆二色谱的典型特征,在波长197nm处出现负吸收峰,是胶原分子构像中无规则卷曲结构的特征,CD测试证明了提取胶原三股螺旋的完整性。综上测试分析证明,本实验提取产品为纯度较高的胶原蛋白纤维。
2 结果与讨论
2.1 五因素混水平实验设计
基于文献分析和对鱼鳞胶原提取影响因素的对比试验结果,拟采用酸的种类(A)、酸的浓度(B)、提取温度(C)、提取时间(T)和料液比(E)五个提取因素,为了更好的探究温度对鱼鳞对胶原蛋白的提取率的影响,将温度因素设定为四个水平,其余因素均设定为两个水平,详见表3。

表3 实验因素设计表Tab.e3 Design table of experimental factors
2.2 结果和讨论
2.2.1 正交实验表格
将每次试验的提取率填入表2的提取率对应的一列,并按照相应的算法对正交分析表中的数据进行计算,其中,Mij为对应的i水平下的各次实验提取率求和,yi为第i水平下提取率的平均值,R为每一个因素对应的yi的最大值与最小值的差值,此值的大小可以反映该因素对提取率影响的重要水平。
试验次数:8

表4 正交分析表Tab.e4 Orthogonal analysis table
注:

2.2.2 正交试验的结果分析
(1)直接比较明确实际优处理直接比较8个处理的结果显示第7个处理的提取率最高,即直接比较的的实际优处理是A4B1C2D2E1,其次是第5个处理, A3B1C2D1E2。它们是经过试验的实际处理,结果较为可靠,可进一步在小范围内试验及应用。
(2)优水平组合提出预测优处理
计算正交实验的数量结果,观察变化的趋势,找出更好的处理组合。求出各因素相同水平的试验反应变量指标和,将各因素最好的水平组合在一起,从而提出预测的优处理,以供进一步试验验证及下一步研究。例如,由表8可以看出,第一列因素A的三个产量之和为10.7064,而因素A第一个水平的平均值为2.6766,将五个因素影响最高的水平组合到一起,得预测的优处理,A4B1C2D2E1,即最佳的提取路线:25 ℃、0.5 mol/L的醋酸,以1∶20的料液比提取72 h。
3 极差分析
各水平的平均值y1、y2、y3中最大值减最小值求得极差R。极差大说明此因素的不同水平产生的差异较大,是重要的因素。按照R值大小排列出因素主次序如下表5。

表5 极差分析表Tab.e5 Range analysis table
可以看出,五种因素的主次关系为:C>D>B>A>E。
4 趋势图直观分析
用MiniTab软件作田口设计分析得到如下的主效应图5。
根据主效应图中各因素端点值差值得出影响的因素重要性依次是C>B>A>D>E。E的线段很缓,说明此因素影响不显著,在做方差分析时,可以剔除该因素。
5 方差分析
表6为正交实验方差分析表,用来分析各因素对提取率影响的差异。DF为变量的自由度,SS为离差平方和,MS为均方,F代表F统计值,F>Pr代表F统计值的显著性水平。为了得到更好的分析结果,把交互作用删除,然后再进行分析。利用SAS统计分析软件,按照各因素的主次关系,剔除E因素之后进行方差分析,得出F值为32.18,显著性水平为0.1341。为避免测试数量少对结果产生的影响,找到影响较大的因素及时删除不显著影响因素,避免因素间的交叉作用。由主效应图进一步剔除因素B,得到F值为1.29,显著性水平为0.4917;剔除因素A得到的F值为5.51,显著性水平为0.0664,模型显著性明显增加。在剔除其他的因素而分别保留剩余的三个因素的情况下的结果都没有只剔除A显著性高,查资料知[10],温度对胶原提取率的影响是成正相关关系,所以分析中剔除A因素属于理论上讨论范畴。根据分析结果,我们以剔除A的模型为参考,得到如表6的方差分析表。

图5 主效应图Fig.5 Main effect diagram

表6 方差分析表Tab.e4 ANOVA Table
注:

最后利用SAS统计分析软件进行参数估计,得到的拟合数学公式:
y=0.61177xa-2.73810xB+3.21370Xc+2.86310Xd+0.40810XE-1.80045
R2=0.8682
3 结论
五因素混水平的正交实验得到的最优的提取工艺为:25 ℃、0.5 mol/L的醋酸,以1∶20的料液比提取72h。通过统计分析构建的提取率和各因素的数学模型看出,提取率与提取温度、酸浓度、提取时间、料液比的关系是正相关;由模型系数的绝对值和极差分析结果得到各因素影响主次为酸浓度、提取时间、酸种类、提取温度、料液比。本结论具有统计学意义,能用于鱼源胶原基材料的设计和开发。
