外源激素对杜仲愈伤组织中绿原酸含量的影响
2019-11-18雷燕妮崔娇娇张小斌
雷燕妮,崔娇娇,张小斌
(1.商洛学院 生物医药与食品工程学院,陕西 商洛 726000;2.商洛学院 健康管理学院, 陕西 商洛 726000)
杜仲属杜仲科杜仲属,又名丝绵木、丝连木、扯丝皮[1],收录于《中国珍稀濒危保护植物名录植物(第一册)》[2],并成为国家的二级保护植物。传统医学以杜仲的树皮为药,近几十年国内外学者的大量研究表明杜仲叶和杜仲皮的化学成分基本一致,其中有效成分(如绿原酸)比杜仲皮中的含量要高,王亚琴[3]指出主要为木脂素类、环烯醚萜类、黄酮类、氨基酸、有机酸以及其他微量元素。当前查阅大多数文献显示杜仲对于人体肥胖、心脑血管疾病以及癌症的治疗都有一定的促进作用,其中比较显著的是对于机体消化道疾病的治疗;研究还发现杜仲的次生代谢产物绿原酸对肿瘤的治疗和防御有着显著的作用。因此杜仲逐渐被广泛应用在医疗和保健品的生产上。杜仲为木本的植物,组织培养的难度比较大[4],左春芬等[5]第一批进行杜仲组培的研究,将杜仲幼嫩的树枝当外植体,对于愈伤组织有诱导作用,然而无法获取再生的植株。1994年,夏启忠与宋太伟等[6]人将杜仲实生苗的茎尖当作外植体,可以获取杜仲再生的植株。在这之后,相应的报道逐渐呈现出来,杜仲组织培养技术开始进入初始发展阶段。笔者研究用不同外源激素配比对商洛杜仲愈伤组织进行处理,探讨影响绿原酸含量的最佳激素组合。以绿原酸含量为考察指标,通过高效液相色谱法测定,确定诱导杜仲愈伤组织形成的最佳外源激素和培养基,给杜仲离体的快速繁殖打下基础。
1 实验材料与仪器
1.1 实验材料
杜仲叶采于商洛市丹江公园,并经中国中医研究院商洛GAP科研工程中心鉴定为杜仲科杜仲属的叶子。
1.2 实验试剂
色谱试剂(一级)选择甲醇,水是纯化水,色谱纯乙腈,色谱纯磷酸,其他试剂均为分析纯。对照品选择绿原酸,选自中国药品生物制品的检定所 ,供含量测定用)。所用MS培养基﹙BR,选择上海宇涵生物科技有限公司,其批号为 );2,4-二氯苯氧乙酸 (CP,上海试四赫维化工有限公司,批号:080414﹚6-苄氨基嘌呤﹙6-BA)(BR,上海伯奥生物科技有限公司,批号:080212);萘乙酸(NAA,选自上海振企化学试剂有限公司,其批号为100415)。
1.3 实验仪器
HPLC(Agilent 1200,配备四元泵,柱温箱、VWD的检测器与真空脱气机);数控超声波清洗机(KQ-600DB);电子天平(Sartorius,精确度0.0001 g);过滤器(0.45 μm);冷冻干燥系统。
2 实验方法
2.1 培养基与培养条件
实验中采用MS培养基,将PH调整为6.0,分装后再在121℃,1.06 kg·cm-2的高压灭菌锅下灭菌20 min,在22±1℃条件下、光照强度为1 500~2 000 LX、一天进13 h的光照,形成愈伤组织,在20 d以后对诱导率进行统计,对愈伤组织的生长状态进行观察。
2.2 取材、消毒
实验前,先将杜仲嫩叶用自来水冲洗2 h,之后选用洗衣粉进行浸泡处理,浸泡时长20 min,选用清水冲洗20 min后将其置于已灭菌处理的烧杯中,向里面加入75 %(V/V)的酒精进行杀菌处理,时长2 min,完成后选用无菌水进行冲洗,频数3~4次,之后向里面加入0.1%wt的升汞溶液进行浸泡处理,时长为5 min,继续重复无菌水冲洗步骤,结束之后,经无菌滤纸吸干水分,备用。
2.3 不同植物生长激素对愈伤組织的诱导效应
选用的生长调节剂有2,4-D、6-BA和NAA,实验时选用的三种配方主要是上面三种。将植物的叶片作为外植体,经过上述杀菌消毒步骤处理后将其置于超净工作台上切割成相同大小的小块(5 mm×5 mm)留待备用,每瓶中放入4块切割好的小块。进行30 d的接种之后,对愈伤组织的诱导率进行统计。
2.4 设计正交实验
参照前人的单因素实验基础上,选择影响愈伤组织中绿原酸的含量多少的三个主要激素:2,4-D、6-BA和NAA,并取各自的不同水平进行正交实验。具体做法:准确称取粉末9份,选择不同浓度的2,4-D、6-BA和NAA为参试因子,以绿原酸的含量为衡量指标,增殖培养基的筛选采用L9实验设计表布置实验 。

表1 正交实验的因素水平
2.5 色谱条件
HPLC色谱柱为HypersilC18-ODS柱(规格:250 mm×4.6 mm,5 μm),其中乙腈-水-磷酸溶液(12∶87.9∶0.1)作为流动相;在327 nm条件下进行样品的检测;分别控制流速和柱温为1.0 mL·min-1和25℃;一次性进样量控制在10 μL,选用面积外标法测定含量。
2.6 对照品溶液的制备
对绿原酸的标准品进行精密称取,称取2.5 mg,放置在50 mL的容量瓶之中,选用甲醇溶解定容,溶液摇匀。此时得浓度为0.050 mg·mL-1标准绿原酸样品,避光保存备用。
2.7 供试样品溶液的制备
杜仲叶愈伤组织60 ℃烘干至恒重,粉碎过60目筛,精密称取杜仲愈伤组织各0.2 g置于10 mL容量瓶中,向里面加入9 mL 50%(V/V)的甲醇,将其置于超声波清洗机中60 min进行提取处理,完成后提出将其置于室温,摇匀,进行过滤操作。将滤液定容至10 mL容量瓶中,选用微孔滤膜对样品进行过滤处理,此时即得目标溶液[7]。
2.8 方法学考察
2.8.1 线性关系考察 精密量取绿原酸0.050 mg·mL-1,作为对照液1、2、3、4、5、6、7、8、9、10 mL,在10 mL的容量瓶之中经甲醇进行稀释,稀释到刻度,混匀。将已稀释不同浓度的标准样品溶液进行吸取,测定。横坐标、纵坐标分别是绿原酸的浓度与峰面积,将标准曲线绘制完成。
2.8.2 精密度试验 在同份对照品中准确吸取溶液,重复进样,频数为5次,每次10 μL,将其置于HPLC下进行测定并记录下样品的峰面积。
2.8.3 稳定性试验 在同份对照品中准确吸取溶液,在0、2、8、16、20 h分别进样,进样量10 μL,记录色谱峰面积。
2.8.4 重复性试验 根据记录供试品的溶液制备方式,在同等条件下制备5分样液,进样,每份样品10 μL,并分别记录色谱峰面积。
2.8.5 准确度考察 准确度的考察选用加样回收实验来验证,精密称取5份已经制备好的绿原酸样品,每份样品中加入 0.2 g,另做一对照性试验,依照2.7的方法进行样品溶液的制备,一次10 uL的进样量,对色谱峰的面积进行记录。
3 实验结果与分析
3.1 愈伤组织中绿原酸含量的测定
3.1.1 系统适用性试验 分别精密吸取对照品溶液、杜仲愈伤组织的同一供试品溶液进样,测定。从图1、图2可见图谱。
供试品中绿源酸色谱峰与对照品色谱峰保留时间一致,并与其他峰的分离度大于1.5,达到基线分离。
3.1.2 线性关系 精密量取50 μg·mL-1L的绿原酸对照液1,2,3,4,5,6,7,8,9,10 mL,在10 mL的容量瓶之中经甲醇进行稀释,稀释到刻度,混匀,将液相色谱仪注入,浓度与峰面积的比值见图3。
由图3可以得出,绿原酸回归方程为:Y=35765X-21065,R2=0.9992。结果表明绿原酸在5.0~50.0 μg·mL-1范围内线性关系良好。
3.1.3 精密度试验 精密称取10 μL浓度为50 μg·mL-1的绿原酸对照品溶液,重复五次,按照色谱条件优化结果进行检测,测得结果为表2。

图1 对照品HPLC色谱

图2 供试品HPLC色谱
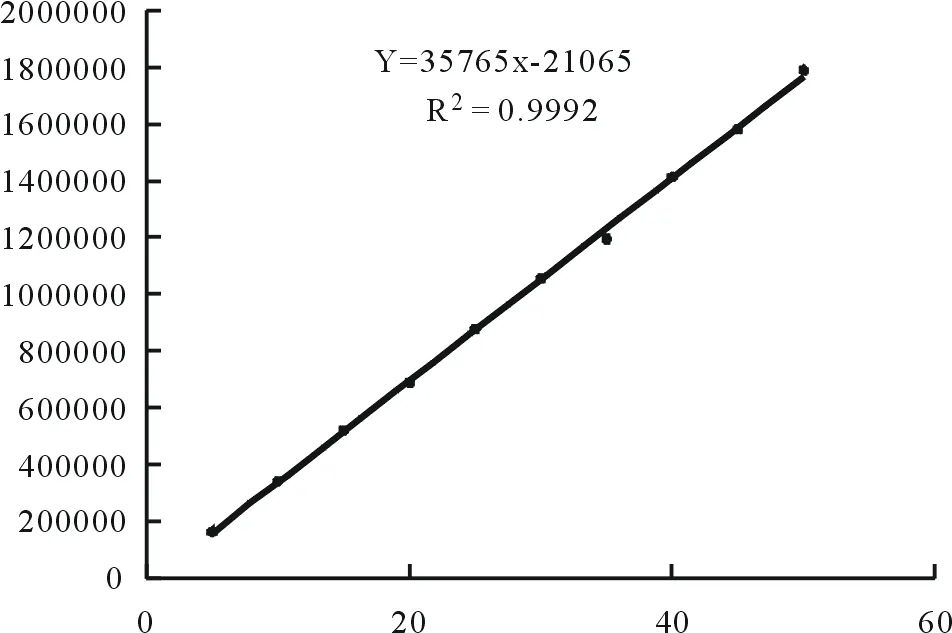
图3 标准曲线
由表2可看出,绿原酸平均峰面积积分值为1808127.2,RSD为0.25%,精密度良好。
3.1.4 稳定性试验 在同份对照品中准确吸取溶液,在0、2、8、16、20 h分别进样,进样量10 μL,记录色谱峰面积,测得结果如表3所示。
由表3的数据分析出,绿原酸的平均峰面积值为1708001.3,RSD为1.9%。表明供试品溶液稳定。
3.1.5 重现性试验 依照2.7中溶液的制备方法制备五份样品,每一份样品选10 μL进样检测,记录色谱峰面积。结果如表4所示。
由表4可以得到,绿原酸的含量平均值1.25 mg·L-1,RSD%为1.8%。该结果显示选用本方法有着良好的重现性。
3.1.6 加样回收率试验结果 选择加样回收实验,对绿原酸含量0.2 g样品称取,重复称取五次,向里面加入一定量的绿原酸对照品进行样品溶液的制备。一次10 uL的进样量,对色谱峰的面积进行记录。结果见表5。
由表5可见,经高效液相色谱方法分析绿原酸的含量,得出回收率平均值98.23%,而相对标准的偏差是1.11%,说明系统有较好的回收率,稳定性较强。
3.1.7 正交试验设计结果 将选用的供试品按顺序进行编号之后,依照相对应的制备方法进行制备处理。依次精密量取不同编号的样品溶液10 μL,依据色谱条件的优化结果测定进样,测得结果见表6。

表2 精密度试验结果(n=5)

表3 稳定性试验结果(n=5)

表4 重现性试验结果(n=5)

表5 加样回收试验结果(n=5)
极差分析 以绿原酸作为指标时,影响因素的大小顺序为:B>C>A。则对绿原酸含量影响的激素作用为:2,4-D>6-BA>NAA。
从表6看出最佳培养基激素的条件为A3B3C2,即6-BA的浓度为1 mg·L-1,2,4-D的浓度1.0 mg·L-1,NAA的浓度为0.5 mg·L-1。在MS培养基中,激素为浓度为1 mg·L-1的6-BA、1 mg·L-1的2,4-D、0.5 mg·L-1的NAA时,将得到绿原酸的最高含量为1.58 mg·g-1。
实验研究查阅了大量相关文献,采用正交实验分析法对三种激素的种类及其浓度进行筛选,此次试验经HPLC法对愈伤组织之中的绿原酸含量进行测定,同时实施加样回收的试验、系统适用性的试验与精密度试验等,使实验数据更为准确。
4 结论和讨论
研究采用MS培养基对杜仲愈伤组织进行培养,经高效液相色谱方法对杜仲愈伤组织之中的绿原酸含量进行测定。测得绿原酸含量在0.05~0.5 mg·L-1范围内具有良好线性关系(Y=35765X-21065,r=0.9992)。正交试验结果表明:影响杜仲愈伤组织的诱导顺序:综合分析杜仲叶片诱导愈伤组织最佳培养基为:MS +1 mg·L-1·2,4-D + 1 mg·L-1·6-BA + 0. 5 mg·NAA,在外源激素浓度1.0 mg·L-1的6-BA、1.0mg·L-1的2,4-D、0.5 mg·L-1的NAA时,测定愈伤组织中绿原酸的含量,测得最高的绿原酸的含量达到1.58 mg·g-1。

表6 正交实验设计(L9正交设计)
注:K为绿原酸的计算值;R为绿原酸的极差值。

表7 绿原酸条件优化结果
