基于ATR-FTIR和1H NMR研究高温对牡丹籽油品质特性的影响
2019-11-15李秀丽戢小梅陈志伟戴志刚陈法志翟敬华
李秀丽 戢小梅 陈志伟 陈 镇 戴志刚 陈法志 翟敬华
(武汉市农业科学院林业果树研究所1,武汉 430075) (湖北省耕地质量与肥料工作总站2,武汉 430070)
牡丹(Paeoniasuffruticosa)属于芍药科(Paeoniaceae)芍药属(Paeonia)牡丹组(Paeoniasect. Moutan DC.)植物,是世界著名花卉,也是中国十大名花之一,具有较高的观赏和药用价值[1]。近年来,牡丹的油用价值也备受关注[1]。牡丹籽油不饱和脂肪酸的质量分数为85%~92%,尤其是α-亚麻酸(α-linolenic acid, ALA, 18 ∶3)质量分数为32%~66%,远远高于目前主要食用油如大豆油(6%~7.95%)和橄榄油(0.73%)等,属于高档食用油[2, 3]。然而,油脂的氧化速率与其不饱和度有关,不饱和度越高越容易被氧化,其中油酸、亚油酸和亚麻酸之间的自氧化速率之比约为1 ∶45 ∶100[4, 5]。油脂的高不饱和度和高亚麻酸含量导致牡丹籽油的氧化稳定性极差[6]。此外,牡丹籽油的烟点在240~270 ℃之间,高于其他常用食用油的烟点值,可以用于高温烹饪,如制作糕点通常需要180~200 ℃加热1 h。高温能够促进脂肪酸失去氢原子,产生氧化速率高于自氧化的热氧化现象[7, 8]。然而,高温处理对牡丹籽油品质影响方面的研究仍然有待深入。
油脂氧化产生的低分子质量异味化合物使油脂的颜色和气味等感官指标发生改变,诱导脂肪酸化学结构改变并产生有毒化合物和氧化聚合物[9]。气相和液相色谱法在油脂检测中特异性较差,存在样品预处理及标准样测定等复杂的环节而非常耗时耗力[10]。值得注意的是,油脂发生热氧化后,将导致许多化学基团在中红外光谱特定波长下的振动峰发生改变,同时引起红外光谱吸光值比值的改变。因此,可借助衰减全反射-傅里叶变换红外光谱(attenuated total reflectance-fourier transform infrared spectroscopy, ATR-FTIR)判断油脂的氧化程度[11]。此外,油脂热氧化会造成化学键的断裂,引起各结构式对应的H化学位移上各类质子的相对含量发生变化,导致不饱和度降低[10, 12],依据1H 核磁共振(nuclear magnetic resonance, NMR)技术可以对热氧化过程中各类质子的动态变化进行深入分析。本实验在色谱测试分析的基础上,进一步采用ATR-FTIR和1H NMR技术,以化学基团的中红外光谱特性及各类质子的相对含量的变化为切入点,深入研究高温对牡丹籽油品质特性的影响。
1 材料与仪器
1.1 实验材料
牡丹籽油(国色坊)为物理压榨植物油,采购后置于低温、干燥、避光的环境中保存备用。核磁共振专用试剂氘代氯仿(CDCl3)和三甲基硅烷(trimethylsilane, TMS);其他化学试剂均为分析纯。
1.2 实验仪器
YLSB076气相色谱仪、YLSB012液相色谱仪、VERTEX 70傅里叶变换红外光谱仪、AV400 核磁共振波谱仪。
2 实验方法
2.1 牡丹籽油热处理
将200 mL牡丹籽油分别放入3个瓷坩埚中,然后放入恒温干燥箱中热处理1 h,共设置4个温度梯度:(25 ± 1)、(100 ± 1)、(150 ± 1)、(200 ± 1) ℃。热处理过程中将瓷坩埚的盖子斜盖,漏出一个小口,使牡丹籽油周围气体的氧含量始终为大气的含氧量,约21%。热处理完成后,从干燥箱中取出牡丹籽油,待其冷却至室温后倒入棕色广口瓶中,置于4 ℃环境中,避光保存。热处理实验重复3次。
2.2 牡丹籽油理化性质的测定
基于GB 22460—2008测定色泽;基于GB 5009.229—2016测定酸值;过氧化值测定的测定参考GB 5009.227—2016;依据GB 5009.168—2016测定不同温度处理条件下牡丹籽油脂肪酸组成;维生素E含量的测定参考GB 5009.82—2016。本节实验均委托农业部油料及制品质量监督检验测试中心进行测定。
2.3 ATR-FTIR表征
在红外光谱测定前24 h,取出牡丹籽油样品并放置于室温、干燥、避光的环境备用。红外光谱测试在室温下进行,所用仪器为装有ATR配件的红外光谱仪,为保证结果的准确性,在每次测量样品前,先测定背景的红外吸收峰,排除空气的干扰峰。取0.1 mL牡丹籽油滴于样品台上,选用4 cm-1的分辨率,扫描128次,波数范围是600 ~ 4 000 cm-1[11]。每个处理3次重复。
2.4 核磁共振(nuclear magnetic resonance, NMR)表征
取0.1 mL牡丹籽油置于5 mm的核磁共振样品管中,再加入0.5 mL的CDCl3,混合均匀后备用。1H NMR的测试参数为:温度:298.0 K;观察频率:600.25 MHz;脉冲序列:zg30;氢谱谱宽:12 019.23 Hz;每次自由感应衰减扫描次数:16;虚拟扫描次数:2;信号检测时间:2.73 s,恢复时间:1 s。化学位移以TMS(δ=0)为标准校正[10]。
2.5 数据拟合及分析
借助Excel2010、SPSS19.0对数据进行统计和显著性分析,显著水平为P<0.05,并利用Origin 8.0统计软件对数据作图,实验数据均为重复3次的平均值。为了更详细地借助FTIR分析热处理对牡丹籽油化学物质动态变化的影响,参考Raba等[11]对咖啡油FTIR图谱中物质变化规律的研究,对FTIR图谱中4种峰值(A)的比值进行了探讨。包括:RⅠ=A 3 009 cm-1/ A 2 924 cm-1,RⅡ=A 3 009 cm-1/ A 2 855 cm-1,RⅢ=A 3 009 cm-1/ A 1 744 cm-1,RⅣ=A 1 744 cm-1/ A 2 924 cm-1[11]。借助Brucker TopSpin2.1软件处理NMR图谱数据,根据质子数与峰面积成正比的特点,对各类质子的积分值进行归一化处理,即将各特征峰的峰面积除以总峰面积,计算出各类质子的相对含量[10]。
3 结果与讨论
3.1 牡丹籽油的基本理化性质
高温处理影响着牡丹籽油的基本理化性质,包括色泽、稳定性、脂肪酸组成和维生素E的含量,结果详见表1:随着加热温度的增加,牡丹籽油色泽逐渐加深,如色红的增加。酸值和氧化程度也呈升高趋势,同时高温诱导了脂肪酸组成的改变:与未加热处理相比,150 ℃加热1 h时饱和脂肪酸的含量无明显变化,200 ℃加热1 h后小幅度上升;单不饱和脂肪酸中的棕榈一烯酸和油酸随温度升高呈先降低后升高趋势,其他单不饱和脂肪酸含量逐渐降低;属于多不饱和脂肪酸的花生二烯酸在100 ℃加热1 h时含量降低,当温度升高至150 ℃和200 ℃时,其含量稳定在0.178%;高温处理并没有影响亚油酸的含量(27.8%);亚麻酸的含量在在200 ℃加热1 h时呈下降趋势。油脂中的抗氧化物质维生素E在100 ℃加热1 h时呈现小幅上升,之后下降,总体呈下降趋势(表1)。酸值和过氧化值是油脂生产、储存和销售中评价油脂稳定性的常用衡量指标[11],酸值是用来显示油脂中游离脂肪酸含量的计量单位,酸值的增加表明高温诱导牡丹籽油形成了更多的游离脂肪酸;过氧化值是通过测定油脂中总氧化物的数量来评估油脂的氧化程度;高温能改变植物油的脂肪酸组成,并降低油脂中活性物质的含量,使油脂品质恶化[13]。本研究表明:高温降低了牡丹籽油中抗氧化物质维生素E的含量,诱导脂肪酸组成发生改变,最终导致油脂的酸值和过氧化值的增加,使牡丹籽油的物理化学性质恶化。
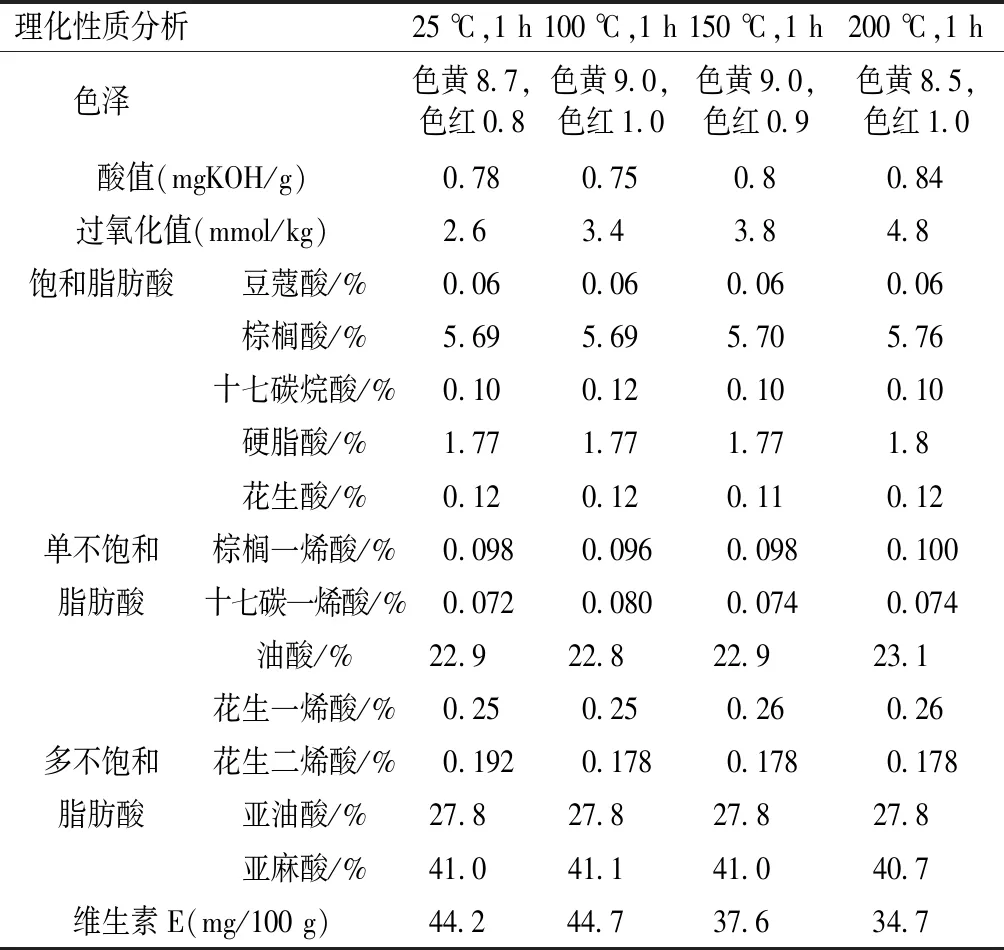
表1 高温处理对牡丹籽油基本理化性质的影响
3.2 牡丹籽油的ATR-FTIR分析
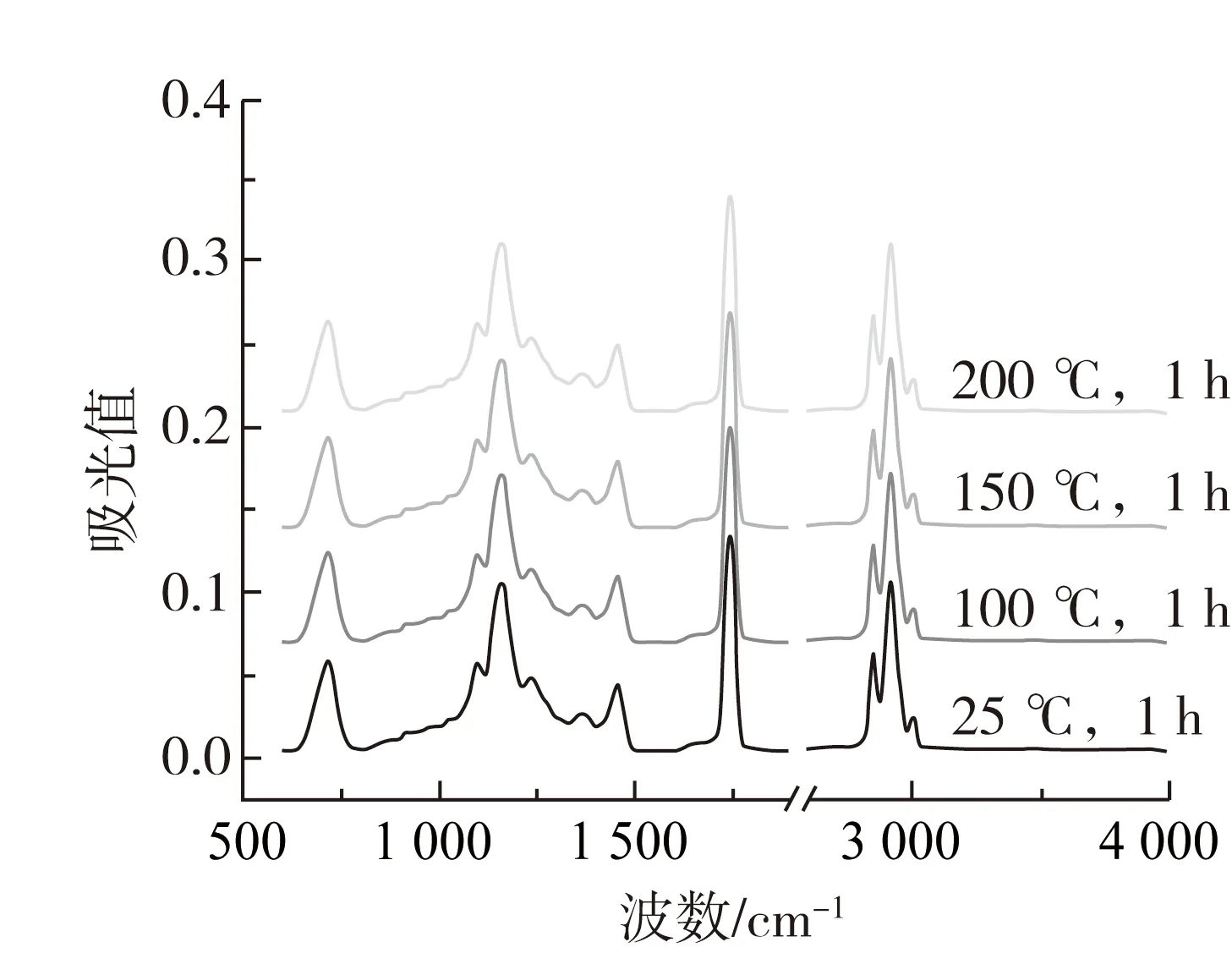
图1 不同温度处理下牡丹籽油的ATR-FTIR图谱
本研究借助ATR-FTIR技术,对高温处理前后牡丹籽油有机官能团的特性和热稳定性进行了深入研究。图1显示了常温及高温处理后牡丹籽油的特征谱带,其差异性主要表现为吸收峰强度的不同,其位置并无明显变化。红外光谱的吸收峰位置及其对应的官能团如表2所示:牡丹籽油ATR-FTIR图谱主要包括指纹区域(600~1 300 cm-1)、C—H键变形和弯曲振动区域(1 350~1 500 cm-1)、双键伸缩振动区域(1 730~1 760 cm-1)、氢伸缩振动区域(2 800~3 050 cm-1)。
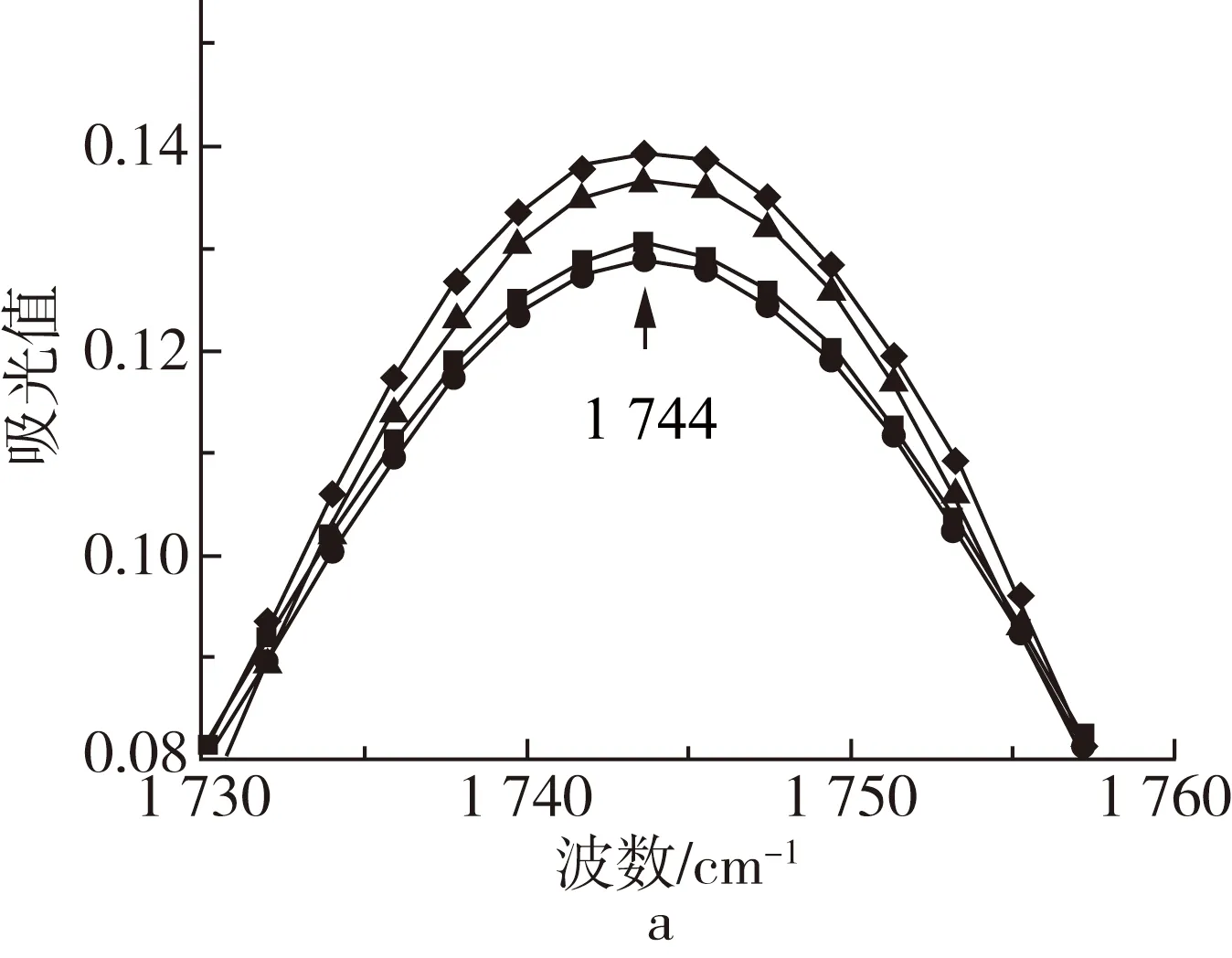
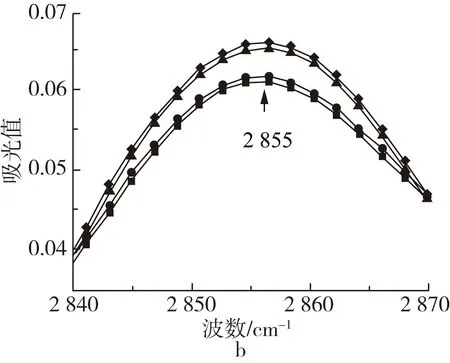
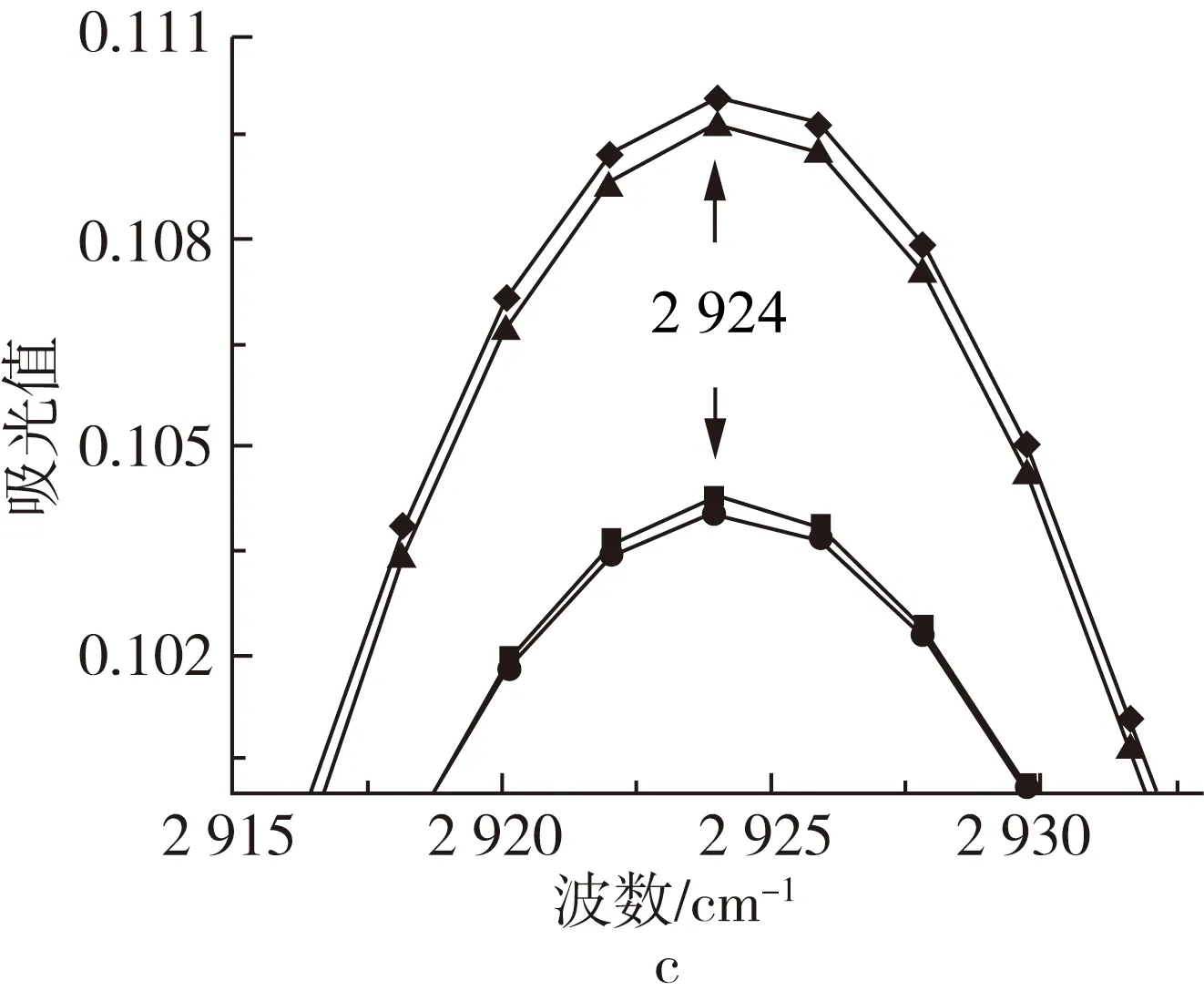
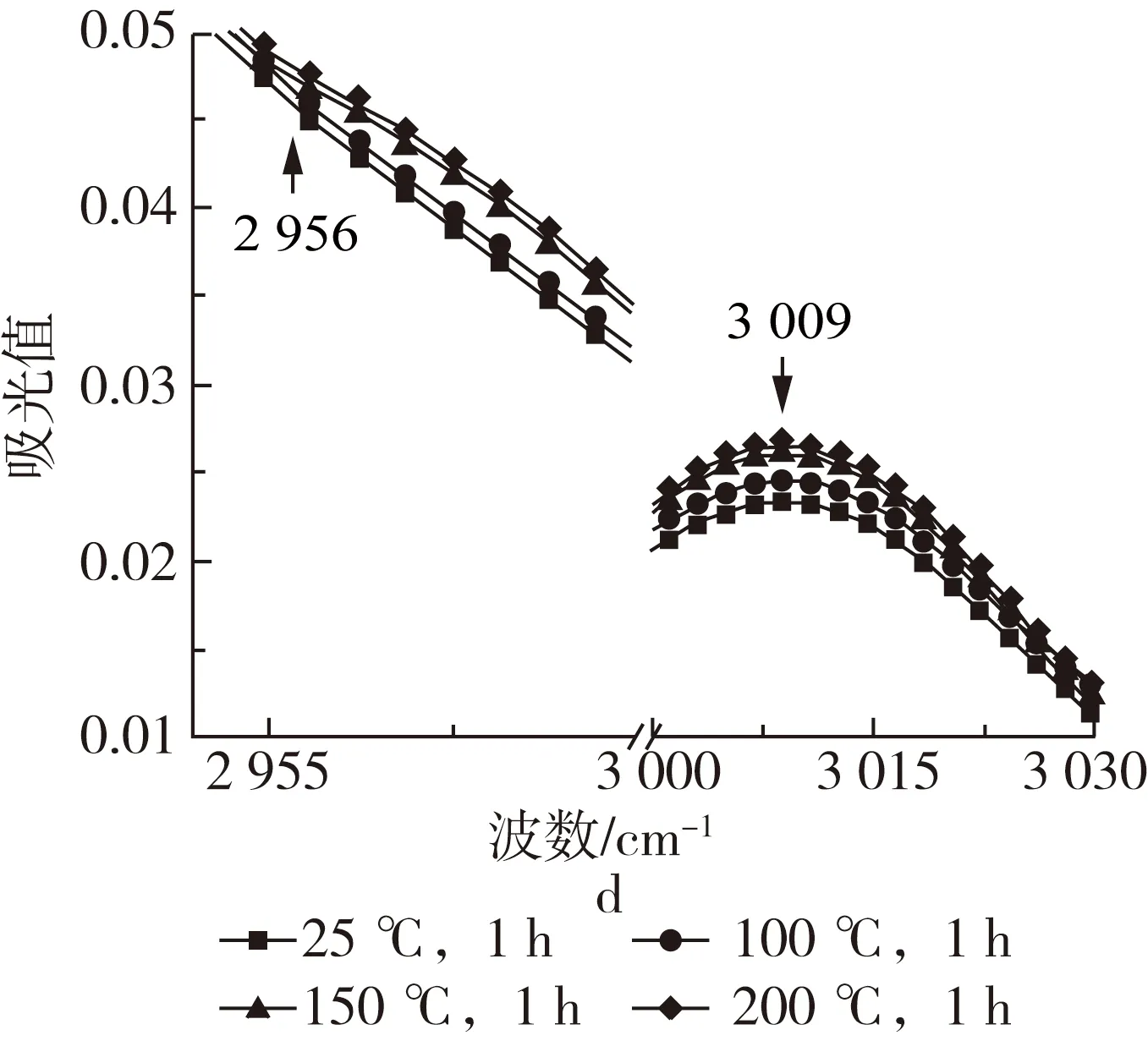
图2 不同波数范围牡丹籽油的ATR-FTIR图谱
牡丹籽油三酰甘油酯羰基的振动尖峰出现在1 744 cm-1处,经高温处理后,1 744 cm-1振动峰随着温度的升高谱带宽度略微加宽,峰强增强。这主要是由于高温诱导油脂发生热氧化,产生醛或其他的次级氧化产物(如:醇、酮和酸),这些氧化产物的羰基存在高吸收性,与1 744 cm-1处甘油三酯的酯羰基官能团发生了强带重叠,同时,也导致1 744 cm-1处谱带变宽至较低的频率[14, 15]。牡丹籽油脂肪酸中存在大量的CH2和CH3基团,其C—H键的伸缩振动在2 855和2 924 cm-1处形成2个主吸收峰,并在2 956 cm-1处形成肩部吸收峰。此外,牡丹籽油中存在不饱和脂肪酸,其顺式双键的C—H伸缩振动在3 009 cm-1处产生吸收峰,油脂热氧化过程中往往会消耗顺式双键,使其异构化成反式基团或分解产生次级氧化产物[11, 16],然而牡丹籽油此处峰值的峰强却随着高温的增强而加强,表明牡丹籽油在热氧化过程中形成了含有顺式双键的初级氧化产物[15, 17]。
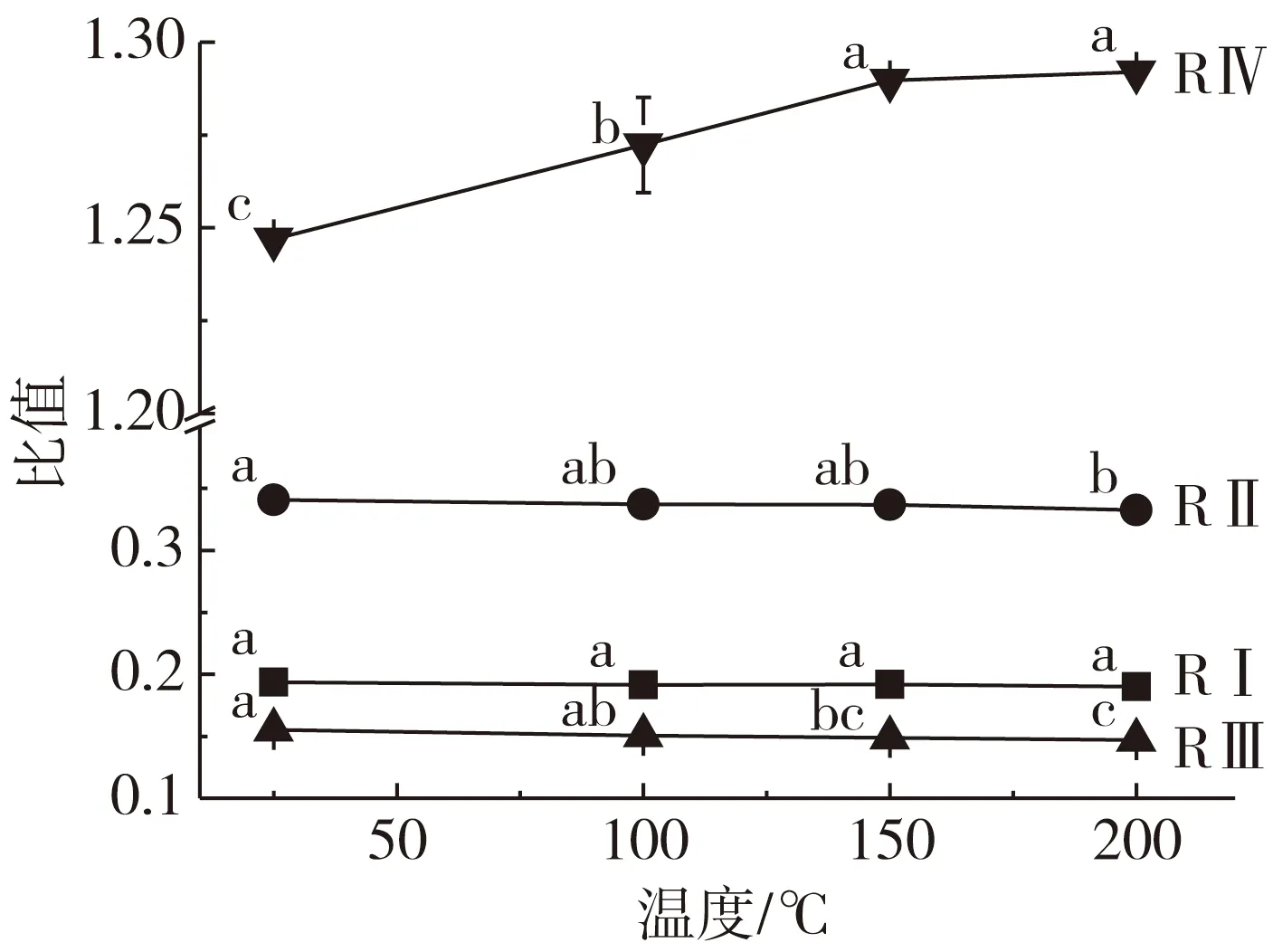
图3 牡丹籽油的吸光值比值
一般情况下,很难界定油脂特性与其抗氧化性间的关系,有报道称植物油脂的氧化程度与吸光值比值存在相关性[11, 15]:A 3 009 cm-1/A 2 924 cm-1(RⅠ),A 3 009 cm-1/A 2 855 cm-1(RⅡ)和A 3 009 cm-1/A 1 744 cm-1(RⅢ)的比值与油脂不饱和度呈正相关;A 1 744 cm-1/A 2 924 cm-1(RⅣ)比值与油脂热氧化程度呈正相关。图3显示了高温处理对牡丹籽油吸光值比值(RⅠ-Ⅲ)的影响:在高温处理下,牡丹籽油的吸光值比值RⅠ-Ⅲ呈现逐渐降低的趋势,比值RⅡ虽缓慢升高,但不存在显著性差异(P<0.05),整体上处于平稳状态。进一步表明:牡丹籽油在热氧化过程中油脂不饱和度逐渐降低,并产生了具有顺式双键和共轭双键的初级氧化产物[15, 17]。图3中吸光值比值RⅣ,随着温度的升高,呈现逐渐增加的趋势,这一结果与其他植物油存在相似性[11],表明在一定温度范围内,高温诱导牡丹籽油发生了热氧化现象,形成了富含羰基基团的次级氧化产物如醛、醇、酮和酸等。

表2 牡丹籽油的红外光谱分析
3.3 牡丹籽油的1H NMR分析
食用油的化学本质是以甘油为骨架,通过酯键连接起来的甘油三酯,其主要营养价值在于脂肪酸种类的不饱和度。高温会造成化学键断裂(酯键)和双键加成,形成新的结构式,使脂肪酸的不饱和度降低,导致油脂氧化变质,NMR技术在植物油脂结构分析上具有独特的优势[10, 18],本研究进一步借助1H NMR技术,对高温处理前后牡丹籽油的品质进行了评估。图4显示了常温及高温处理后牡丹籽油的1H NMR特征峰及其编号,从高场到低场共出现11个特征峰,每个特征峰的化学位移(δ)及其对应的质子归属[10, 12, 18, 19]见表3所示,各类质子的相对含量如图5所示。
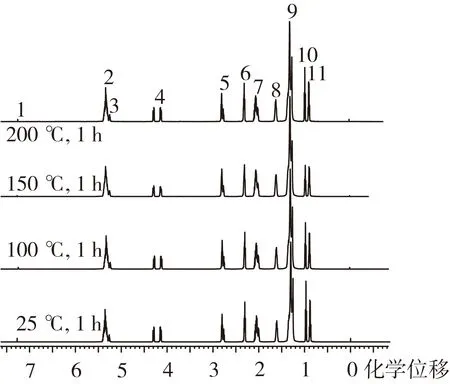
图4 不同温度处理下牡丹籽油的1H NMR 图谱
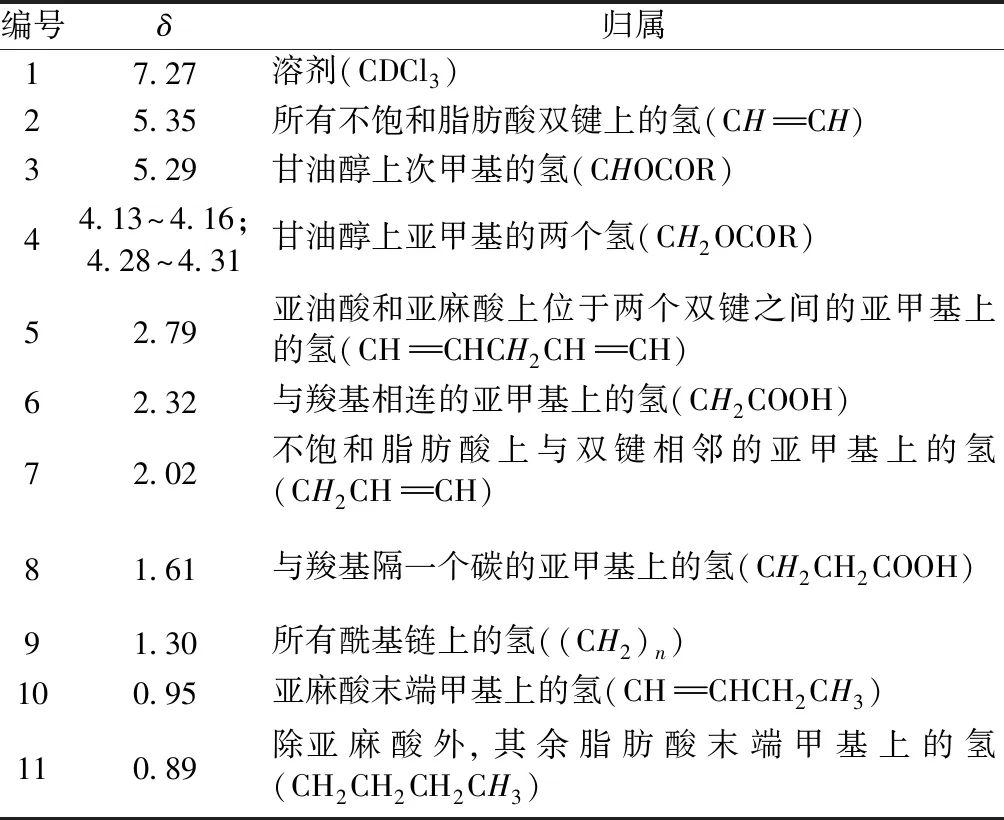
编号δ归属17.27溶剂(CDCl3)25.35所有不饱和脂肪酸双键上的氢(CHCH) 35.29甘油醇上次甲基的氢(CHOCOR)44.13~4.16; 4.28~4.31甘油醇上亚甲基的两个氢(CH2OCOR)52.79亚油酸和亚麻酸上位于两个双键之间的亚甲基上的氢(CHCHCH2CHCH)62.32与羧基相连的亚甲基上的氢(CH2COOH)72.02不饱和脂肪酸上与双键相邻的亚甲基上的氢(CH2CHCH)81.61与羧基隔一个碳的亚甲基上的氢(CH2CH2COOH)91.30所有酰基链上的氢((CH2)n)100.95亚麻酸末端甲基上的氢(CHCHCH2CH3)110.89除亚麻酸外,其余脂肪酸末端甲基上的氢(CH2CH2CH2CH3)
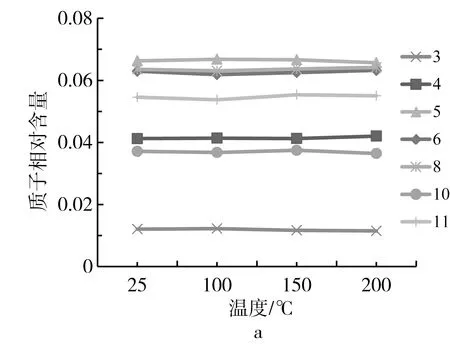
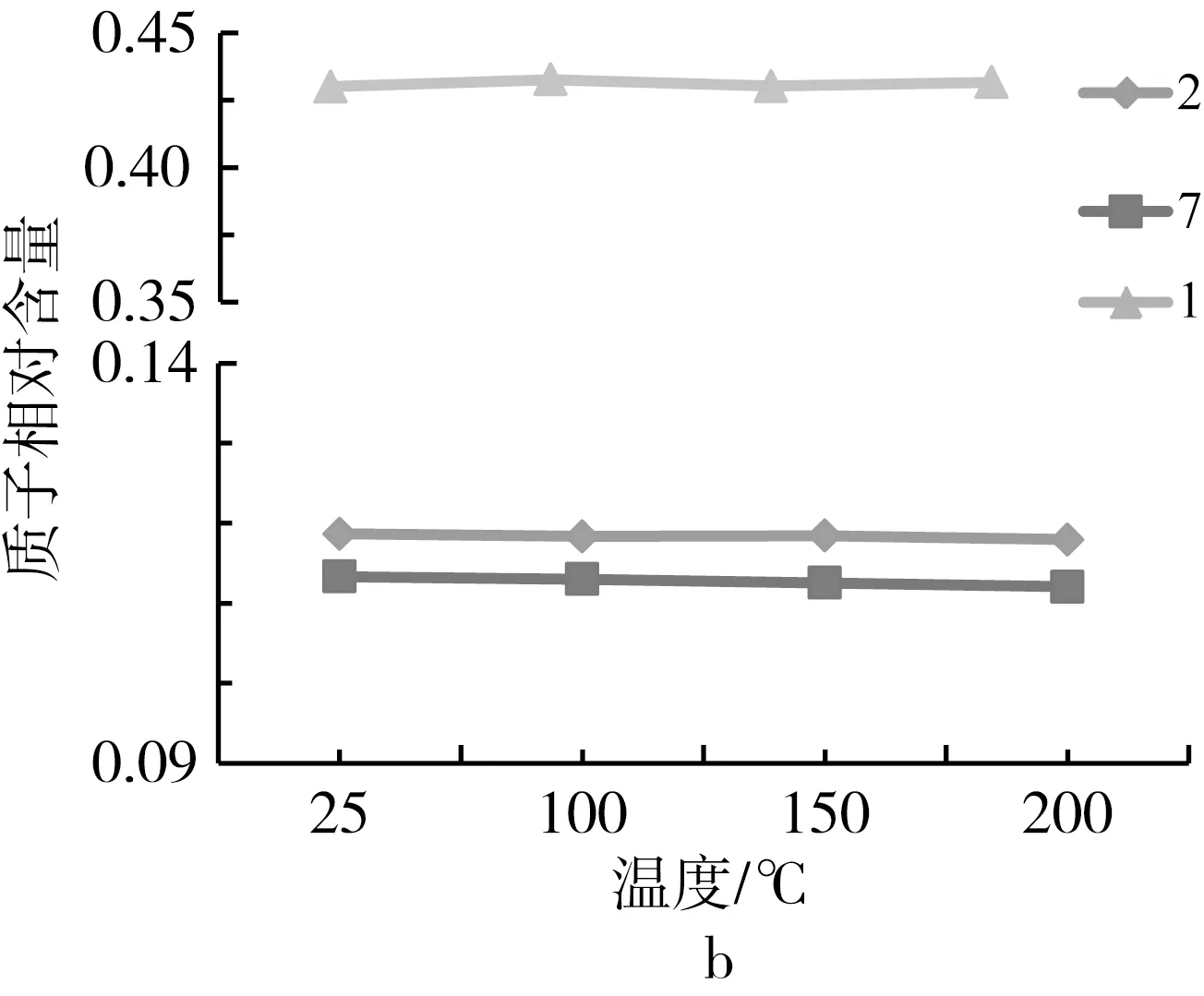
注:图例对应的编号与表3的一致。图5 各类质子的相对含量
根据各质子峰的归属,δ=0.95的特征峰来源于亚麻酸末端C18上的甲基氢,亚麻酸的双键位于C9、C12和C15上,其末端的甲基氢的化学位移高于其他脂肪酸[10],因此将10号峰归属为亚麻酸的特征峰。从图5a可以看出,从室温到150 ℃加热1 h时,δ=0.95处的10号H谱峰较为平稳,当温度继续升高至200 ℃加热1 h时,该峰呈现下降趋势,说明高温使亚麻酸结构发生降解,导致其含量减少,降低了该处H谱峰的强度,因此该处H含量可作为鉴别牡丹籽油热氧化程度的一个重要指标。此外,δ=2.79的5号峰为亚油酸和亚麻酸上位于两个双键之间的亚甲基的特征峰,包含了亚油酸和亚麻酸;δ=5.35的2号峰为所有不饱和脂肪酸双键的特征峰,包含了油酸、亚油酸和亚麻酸。从图5可以查看出,在高温处理过程中5和2号峰均存在平稳中有轻微下降趋势,说明高温处理降低了脂肪酸的双键含量。δ=2.02的7号峰为与单个双键共轭的碳上的H化学位移,进一步表明高温导致牡丹籽油的双键含量降低(图5b)。δ=1.30的9号峰为酰基链氢的化学位移,随着温度升高,牡丹籽油的双键含量降低,导致酰基链上CH2累积量高,该处H含量呈现升高趋势(图5b),也是鉴别牡丹籽油热氧化程度的一个重要指标。
4 结论
本研究在色谱法的基础上,进一步借助ATR-FTIR和1H NMR技术对高温诱导的牡丹籽油氧化特性进行了分析。本研究发现高温诱导牡丹籽油发生了热氧化,氧化程度随着温度的增加而增加。ATR-FTIR结果表明牡丹籽油在高温作用下脂肪酸的不饱和度降低,形成了含有顺式双键的初级氧化产物以及醛和其他的次级氧化产物。1H NMR结果显示,高温使亚麻酸结构发生降解,并降低了脂肪酸的双键含量,同时导致酰基链上CH2累积量高,提出位于δ=0.95、δ=2.02和δ=1.30处的氢化学位移可作为鉴别牡丹籽油热氧化程度的重要指标。
