非小细胞肺癌患者癌组织中HMGB1、MMP-9和FOXP3表达水平及临床意义
2019-11-14金超超赵梅凤
金超超 金 诺 梅 芬 赵梅凤
目前,临床上对于非小细胞肺癌(NSCLC)的首选治疗手段为手术切除,术后辅助放化疗为其治疗原则,但随着NSCLC患者的逐渐增多,有研究显示,予以相同方案进行治疗的不同NSCLC患者其治疗效果和预后情况也可存在一定的差异,故除去治疗方案外,探讨影响NSCLC患者预后的相关因素是目前临床上一个值得重视的问题[1]。随着研究的不断深入,有资料显示,在不同治疗效果和预后的NSCLC患者间其相关蛋白及细胞因子等均存在着一定的差异[2],故有学者认为相关蛋白和细胞因子的表达可能与NSCLC患者的预后有着密切联系,但具体指标尚未阐述清楚[3]。本文通过回顾性分析100例NSCLC患者的临床及随访资料,旨在探讨NSCLC患者癌组织中高迁移率族蛋白B1(HMGB1)、基质金属蛋白酶-9(MMP-9)和叉状头/翅膀状螺旋转录因子(FOXP3)表达水平及临床意义。
1 资料与方法
1.1 一般资料
选取2008年至2012年我院收治的100例NSCLC患者作为研究对象,其中男性76例,女性24例,年龄为36~80岁,平均年龄为(62.02±9.52)岁。纳入标准:①所有患者均符合2004年世界卫生组织(WHO)中肺癌明确诊断标准[4];②所有患者均在完善术前准备后行手术治疗且术后均经病理学检查确诊为NSCLC;③本研究经医院伦理委员会批准;④所有患者均知情同意本研究并签署知情同意书。排除标准:①存在严重原发性肝肾功能不全者;②除去NSCLC外存在其他肺部疾病者;③存在其他恶性肿瘤者;④临床及随访资料不完整者。
1.2 研究方法
选取100例NSCLC并行手术治疗患者,并于术中收集其切取的NSCLC癌变组织100份作为研究组,另在手术过程中收集100份癌旁正常组织作为对照组,2组组织标本均采用免疫组织化学方法进行HMGB1、MMP-9和FOXP3水平的检测。所有患者出院后均进行5年时间的随访,随访率为100%。
免疫组化所需试剂:HMGBl抗体购Ih abcam公司(79823),MMP-9抗体,浓缩的人类FOXP3型鼠抗单克隆抗体原液,氯仿、无水乙醇、异丙醇均为国产分析纯级试剂,DEPC水购自碧云天,即用型ChemMate EnVision兔/鼠通用型免疫组化试剂盒、3%H2O2离子水、DAB显色试剂盒、磷酸盐缓冲液(PBS)、乙二胺四乙酸(Tris.EDTA)、丙氨基三乙氧基硅烷(APES)、丙酮(AR)、无水乙醇(AR)、95%乙醇(AR)、二甲苯(AR)、苏木精体细胞快速颜色液、pH试纸、盐酸(AR)和氨水(AR)。检测方法:HMGB1、MMP-9和FOXP3均采用免疫组织化学染色(PV-9000 二步法),一抗分别为HMGBl(1∶100)、 MMP-9(即用型)和Foxp3(1∶40),用PBS替代一抗做阴性对照,试剂商提供的阳性片做阳性对照。
1.3 观察指标及标准
根据其资料及检测结果记录所有患者的性别、年龄等一般临床资料及肿瘤情况、HMGB1、MMP-9和FOXP3的水平及预后,并比较不同预后患者间HMGB1、MMP-9和FOXP3水平等相关资料的差异性。HMGB1、MMP-9和FOXP3阳性判定标准:HMGB1和FOXP3[5]:采用IHS=A×B来表示,其中A为阳性细胞数分级,阳性细胞数在0~1%之间为0,阳性细胞数在>1%~25%之间为1,阳性细胞数在>25%~50%之间为2,阳性细胞数在>50%~75%之间为3,阳性细胞数在>75%~100%之间为4;B为阳性细胞显色强度,无着色=0,淡黄色=1,棕黄色=2,棕褐色=3,IHS≥3分为阳性表达,其中0~2 分为(-),3~4 分为(+),6~8 分为(++),9~12 分为(+++)。MMP-9[6]:表达于细胞质,阳性染色呈棕黄色颗粒,且在显微镜下观察细胞内应清晰可见、定位准确,而背景不着色。在高倍镜下取4个不同的视野,并数200个癌细胞,根据MMP-9 阳性细胞所占的百分率判定 MMP-9 表达强弱。阴性(-):无阳性细胞或阳性细胞数比例小于10%;弱阳性(+):阳性细胞数比例为 10%~25%;中度阳性(++):阳性细胞数比例为 25%~50%;强阳性(+++):阳性细胞数比例>50%。
1.4 统计学方法
2 结果
2.1 2组组织标本中HMGB1、MMP-9和FOXP3表达水平比较
NSCLC患者其癌变组织中HMGB1、MMP-9和FOXP3的阳性表达率均显著高于癌旁正常组织,比较差异均具有统计学意义(P<0.05),见表1。
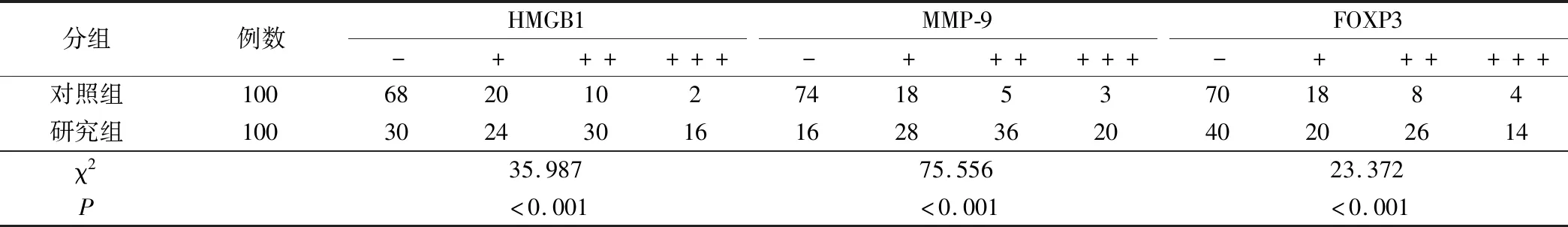
表1 2组组织标本中HMGB1、MMP-9和FOXP3表达水平比较/例
2.2 预后生存情况
研究100例NSCLC患者中,自出院后至随访结束存活1~50个月,中位生存时间为42个月,出院后1年生存率为90.00%(90/100),3年生存率为82.00%(82/100),5年生存率为68.00%(68/100)。HMGB1阴性患者和阳性患者其5年总生存率分别为86.67%(26/30)和60.00%(42/70),MMP-9阴性和阳性患者其5年总生存率分别为93.75%(15/16)和63.10%(53/84),而FOXP3阴性和阳性患者其5年总生存率分别为85.00%(34/40)和56.67%(34/60),比较差异间均具有统计学意义(χ2=6.863,P=0.009;χ2=5.804,P=0.016;χ2=8.854,P=0.003)。
2.3 影响预后的单因素分析
经非条件单因素Cox 比例风险回归模型显示,吸烟、肿瘤低分化、出现淋巴结转移以及HMGB1、MMP-9、FOXP3阳性表达和临床分期为Ⅲ+Ⅳ期的NSCLC患者其5年生存率均显著降低(P<0.05),见表2。
2.4 影响预后的多因素分析
经多因素Cox比例风险回归模型分析显示肿瘤低分化、临床分期为Ⅲ+Ⅳ期、出现淋巴结转移及HMGB1、MMP-9、FOXP3阳性均为影响NSCLC患者预后的独立危险因素(P<0.05),见表3。
3 讨论
本组研究结果显示,在NSCLC患者当中,其癌变组织中的HMGB1、MMP-9和FOXP3表达水平均显著高于癌旁正常组织,由此可见HMGB1、MMP-9和FOXP3与NSCLC疾病的发生和进展有着一定的联系。本组研究结果还显示,吸烟、肿瘤低分化、出现淋巴结转移以及HMGB1、MMP-9、FOXP3阳性表达和临床分期为Ⅲ+Ⅳ期的NSCLC患者其5年生存率均显著降低,由此则进一步表明HMGB1、MMP-9、FOXP3在机体中的表达与NSCLC患者疾病进展和预后有着密不可分的关系,但关于其具体机制尚未完全报道。结合以往生化学研究[7]可知,HMGB1被认为是一种与肿瘤疾病发生和进展有着密切相关的促癌基因,其可一定程度上促进肿瘤细胞的增殖生长,加强肿瘤细胞的迁徙和转移能力。故本研究认为,随着HMGB1表达水平的增加,其阳性率越高,则可增加肿瘤细胞的数量,从而进一步加速病情发展和提高转移风险,从而导致患者出现肿瘤细胞转移和病情恶化,进而缩短生存时间[8]。而MMP-9属于基质金属蛋白酶的一种,其对细胞外基质的所有成分具有一定的降解作用,从而可导致肿瘤细胞沿着缺失的基膜向周围组织浸润,促进癌细胞向周围正常组织侵袭,进一步加重机体的损伤导致其功能出现不可逆的下降和减退直至坏死[9]。另一方面,还有资料显示,MMP-9对相关毛细血管的内生具有一定的促进作用,从而造成新血管给肿瘤细胞进行血氧营养成分的供给而促进其生长[10]。FOXP3属于FOX家族的一员,其可一定程度上调控CD4+和CD25+的表达,从而对T细胞的分化和活化等具有一定的调控作用,出现免疫应答被抑制等情况,从而导致肿瘤细胞逃离相关免疫作用而继续生长[11]。由此可见,HMGB1、MMP-9和FOXP3与NSCLC的生长均有着密切联系,随着其表达水平的上升,肿瘤进展越快对机体损害越大从而导致生存时间越短。且本文也经多因素Cox 比例风险回归模型分析进一步证实肿瘤低分化、临床分期为Ⅲ+Ⅳ期、出现淋巴结转移及HMGB1、MMP-9、FOXP3阳性均为影响NSCLC患者预后的独立危险因素。
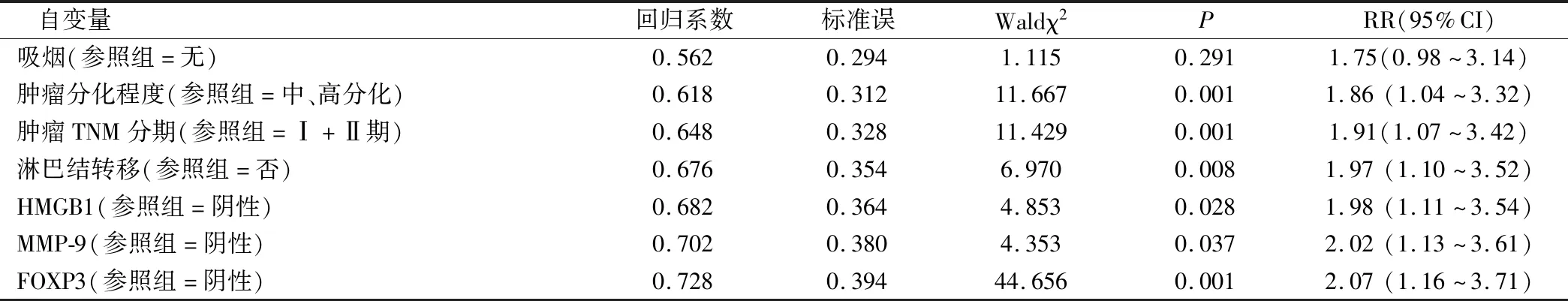
表3 影响预后的多因素分析
综上所述,HMGB1、MMP-9和FOXP3在NSCLC患者癌组织中均以较高水平表达,且其阳性表达联合肿瘤低分化、临床分期为Ⅲ+Ⅳ期和出现淋巴结转移均为影响NSCLC患者预后的独立危险因素。
