EMI1高表达与结直肠癌临床病理特征及不良预后的相关性
2019-11-14王艳华刘仁鹏宋荣峰唐建军
王艳华 熊 彦 刘仁鹏 宋荣峰 唐建军
结直肠癌(colorectal cancer,CRC)在全球癌症中发病率居第4位,患者5年生存率为64.3%,当晚期CRC发生远处器官转移时,5年生存率仅为5%~8%[1-2]。50%~60%CRC患者就诊时已发生转移,其中80%~90%已不可手术切除,治疗手段非常有限[3]。目前,CRC发生及转移的机制尚不清楚,研究转移性CRC中异常表达分子在CRC转移中的作用及调控机制,有助于进行准确的CRC分子分型。新的肿瘤标志物和潜在的治疗靶点的发现,有助于转移性CRC的早期诊断和生存期的延长。
EMI1又名早期有丝分裂抑制物(Emi1),属于F-box家族蛋白,可参与组成Skp1-Cul1-F-box-protein (SCF)泛素连接酶,介导蛋白的泛素化降解[4]。EMI1(Emi1)在肿瘤中的表达及功能有待研究。
1 材料与方法
1.1 主要试剂
Cocktail 蛋白酶抑制剂(Calbiochem),丙烯酰胺(Bio-Rad),TEMED(Sigma addrich),PVDF膜(Roche),BSA(Promega),Anti-EMI1 antibody(HPA029048),sigma aldrich)。 5×SDS-PAGE上样缓冲液:取1 mol/l Tris-HCl (pH 6.8) 1.25 ml,0.5 g SDS,2.5 ml甘油,25 mg溴酚蓝加去离子水定容至5 ml,每只500 μl分装,用前每小份加入25 μl β巯基乙醇。5×SDS-PAGE 电泳缓冲液:称取15.1 g Tris base,94 g甘氨酸,5.0 g SDS,加入800 ml去离子水,搅拌溶解,定容至1 000 ml。膜转移缓冲液:称取5.8 g Tris base,2.9 g甘氨酸,0.37 g SDS,加入600 ml去离子水,搅拌溶解,定容至800 ml,加入200 ml甲醇。10×TBE:540 g Tris 碱与275 g硼酸溶于1000 ml 0.5 mol/l EDTA 中。1.2 % Agarose:Agarose 1.2 g,溶于1×TBE 50 ml中,微波加热沸腾后制胶。0.5 mol/l EDTA缓冲液(pH 8.0):700 ml水中溶解186.1 g EDTA·2H2O,用10 mmol/l NaOH调至pH 8.0,加去离子水至1 000 ml。
1.2 主要方法
1.2.1 RT-PCR 采用RNeasy Mini试剂盒分离纯化总RNA,分光光度法测定计算提取的总RNA含量及浓度。参照OneStep RT-PCR试剂盒实验操作说明进行RT-PCR,总反应体积50.0 μl,其中5× OneStep RT-PCR buffer 10.0 μl,dNTP Mix 2.0 μl,OneStep RT-PCR Enzyme Mix 2.0 μl,5×Q-Solution 10.0 μl,RNase inhibitor 10 U,RNA 1.0 μg,引物 0.6 μmol/l。扩增条件为:50 ℃逆转录30 min,95 ℃初始化15 min,94 ℃变性1 min,55 ℃ 1 min,72 ℃ 1 min,30~35个循环,72 ℃10 min。扩增引物为:5'-GCTGTCATGTATTGGGTCACC-3' (forward),5'-GTCTACTGGTCTCTAGTGCTTCT-3' (reverse),扩增产物大小为:146 bp,取RT-PCR产物10.0 μl,加上样缓冲液2.0 l,在2%琼脂糖凝胶上电泳,70 V 40 min,凝胶图像成像系统拍摄保存实验结果。
1.2.2 Western Blot ⑴SDS-PAGE电泳:样品中加入1/5体积的5×SDS-loading buffer,99 ℃煮5 min充分变性。将凝胶固定于电泳装置上,加入电泳缓冲液。每空约50 μg的总蛋白量上样。浓缩胶稳压80 V,分离胶120 V,电泳至溴酚蓝达分离胶底部时,关闭电源。
⑵转膜:PVDF膜纯甲醇浸泡饱和30 s,按海绵→滤纸→胶→膜→滤纸→海绵,每层放好后,用玻璃棒赶去气泡。胶放于负极面(黑色面)。将转移槽置于冰浴中,将夹子夹好放入转膜槽,加转移缓冲液,200 mA恒流2~4 h。
⑶封闭以及抗体孵育:用镊子小心夹出PVDF膜放入5%的脱脂奶粉中室温封闭2 h。一抗孵育:弃去封闭液,TBST清洗2次,用3%的BSA稀释Anti-EMI1 antibody (HPA029048,sigma aldrich),与膜一起4 ℃孵育过夜。用TBST洗膜3次,每次10 min。二抗孵育:HRP偶联的二抗用5%的脱脂奶粉/TBST按1∶10 000稀释,室温孵育1 h。TBST洗膜3次,每次10 min。
⑷显色、X光片压片,显影、定影。
1.2.3 免疫组织化学技术(IHC) 收集2004年5月至2009年11月中山大学肿瘤防治中心收治的240例结直肠癌患者手术病例相关临床病理资料,切片后按以下步骤免疫组织化学染色(IHC)。(1)脱蜡:0.45 μm石蜡切片60 ℃温箱烤片2 h;将切片取出后立即放置新鲜二甲苯缸中,浸泡10 min:重复一次;(2)梯度水化:将脱蜡后的切片依次经100%乙醇,95%乙醇,80%乙醇,60%乙醇,蒸馏水中梯度浸泡各3 min;(3)去除内源性过样化物酶的活性:将玻片甩干,置于3% H2O2中,室温孵育30 min;(4)高压抗原修复:将组织切片放入盛有的EDTA修复液(1 mmol/l pH 8.0)高压锅中,高压3~4 min,从高压锅气阀弹起冒气时开始计时;自然冷却1 h;取出放入蒸馏水中,浸泡3 min;(5)PBS洗涤3次,每次5 min;(6)IHC油性笔绕组织切片周围划圈,圈好后滴加羊血清封闭30 min。(7)一抗孵育:Anti-EMI1 antibody(HPA029048,sigma aldrich)按1∶100稀释,覆盖整张组织切片区域,4 ℃孵育过夜;(8)PBS缓冲液洗涤4次,每次3 min;(9)二抗孵育:滴加二抗,室温孵育1 h;(10)PBS洗涤4次,每次3 min;(11) PBS洗涤4次,每次3 min;(12)DAB显色2~3 min,清水冲洗终止反应;(13)苏木精复染1~2 min,盐酸酒精分化1~3 s;(14)脱水干燥:30%乙醇,70%乙醇,100%乙醇梯度脱水,37 ℃温箱烤片10~20 min;(15)中性树脂封片,观察。 阳性结果判定标准:两名临床病理医师双盲法分别对染色情况进行评分。细胞内呈棕色颗粒者为阳性染色,根据染色细胞所占百分比和染色强弱的程度进行评分。阳性细胞率计分分为4个等级:0分(≤10%),1分(>10%~25%),2分(>25%~50%),3分(>50%~75%),4分(>75%)。染色强弱的强度分为4个等级:1分(浅棕色),2分(棕色),3分(深棕色)。最后总的染色情况按二者的乘积分数分为4个等级:0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。结果判断:将(-)和(+)定为阴性表达,(++)和(+++)定为阳性表达。
1.3 统计学处理
应用SPSS 16.0统计软件分析。其中P<0.05视为差异有统计学意义。Pearson Chi-Square和Kruskal-Wallis检验分析EMI1表达与临床病理学指标的相关性,Kaplan-Meier method和log-rank test分析临床预后,Cox regression回归模型进行单因素和多因素分析。
2 结果
2.1 EMI1在结直肠癌中表达升高
采用RT-PCR和Western blot检测EMI1在结直肠癌的癌组织和癌旁组织临床标本中的mRNA和蛋白的表达。如图1所示,PCR结果显示,6例配对标本中,与相应配对的癌旁组织相比,癌组织中标本中的EMI1的mRNA表达明显升高(图1A)。Western blot结果显示,12例配对标本中,与相应配对的癌旁正常组织相比,癌组织中EMI1的蛋白表达也明显升高(图1B)。

N为癌旁正常组织;T为癌组织。
2.2 EMI1表达与结直肠癌临床病理特征的相关性
免疫组织化学技术检测240例确诊的具有临床病理和预后资料的结直肠癌患者石蜡标本中EMI1的表达,病理医生评分后,根据ROC曲线得出cut off值为5,以IHC评分值是否大于5分为高表达和低表达组,Pearson Chi-Square 和 Kruskal-Wallis 检验统计学方法分析EMI1表达与临床病理学特征的相关性,结果显示EMI1表达与结直肠癌患者的临床病理特征密切相关:临床分期 (P=0.004),T分期 (P=0.011),M分期 (P=0.003)。EMI1表达高的结直肠癌患者临床分期越高,远处器官转移的发生率越高(表1)。
2.3 EMI1高表达与结直肠癌患者的预后
进一步采用Kaplan-Meier analysis和the log-rank test统计学分析EMI1表达和结直肠癌患者预后的关系,图2可见,EMI1高表达的结直肠癌患者的总生存期和无瘤生存期比EMI1表达低的患者短(P<0.001),EMI1高表达预示结直肠癌患者预后差。

表1 EMI1表达与结直肠癌临床病理特征及预后的相关性/例
2.4 结直肠癌患者预后相关因素分析
单因素分析显示,与结直肠癌患者总生存期明显相关的因素包括:EMI1表达(P<0.001),T分期(P<0.001),N分期(P<0.001),M分期 (P<0.001)和病理分化(P=0.001)。如表2的多因素回归分析结果显示,EMI1表达,N分期和M分期是结直肠癌患者总生存期的独立预后因素,EMI1表达(P=0.041),N分期(P<0.001)和M分期(P=0.001)。
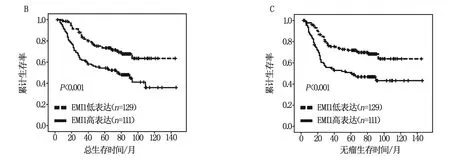
图2 EMI1表达与结直肠癌患者预后的关系

变量 例数单因素分析总生存时间/月P多因素分析HR95%CIPEMI1表达<0.0011.5581.019~2.3840.041 低表达129109 高表达11179年龄0.4610.9370.617~1.4230.761 ≤508990 >5015187性别0.8180.8680.576~1.3080.499 男性13195 女性10986T分期<0.0011.2060.871~1.6710.259 T1+T248103 T36683 T412678N分期<0.0012.8871.781~4.681<0.001 N0113119 N+(N1andN2)12770M分期<0.0012.6951.741~4.173<0.001 M018597 M15551分化0.0011.4200.976~2.0670.067 良23106 中等16097 差5771
3 讨论
EMI1是E2F转录因子的靶基因,是一个关键的细胞周期调节蛋白,为聚集有丝分裂期周期蛋白和S和G2期其他的重要细胞周期调控因子所必须的[5-6]。EMI1在一些癌中高表达且发挥重要功能。慢性髓细胞样白血病(CML)中,Bcr-Abl 增强Emi1的磷酸化和稳定性,进而阻止SKP2的降解促进CML细胞的增殖[7];在肝细胞癌中Emi1促进增殖,调控SKP2稳定性和p27降解[8]。Emi1与卵巢透明细胞癌的高FIGO分期和不良预后相关[9]。乳腺癌中,Emi1与组织学级别和预后相关,影响PI3K/Akt细胞增殖通路[10]。敲除Emi1增强肿瘤细胞对阿霉素和X射线辐照敏感性[11]。EMI1在结直肠癌中的表达及临床意义尚不清楚。
在此项研究中,我们发现EMI1在结直肠癌中存在表达失调,与正常癌旁组织相比,肿瘤组织中EMI1在mRNA和蛋白水平的表达都有上调的趋势,并且临床分期越高的结直肠癌患者EMI1表达水平越高;病理分化越差的结直肠癌患者EMI1表达水平也越高。EMI1高表达的结直肠癌患者的生存期比EMI1表达高的患者短。EMI1高表达预示结直肠癌患者预后不良。对于EMI1在结直肠癌发展中的作用及其具体分子机制,有待于将来进一步采用基因敲除或过表达等手段进行功能研究。在我们目前的在结直肠癌患者临床标本上检测EMI1的表达,分析其与临床病理学特征和预后的关系,提示EMI1在结直肠癌上可能会具有癌基因作用,可能与CRC的转移有关。阐明EMI1在结直肠癌上的预后意义,不仅有助于结直肠癌的早期诊断和治疗,并且对深入探究EMI1在结直肠癌发生发展中的生物学功能能起到一定的提示作用。
结直肠癌的发生发展是一个多基因、多步骤、多阶段的过程,涉及多种癌基因的激活和抑癌基因失活等一系列的变化。K-RAS体细胞突变、APC基因、p53、BRAF、PIK3CA、SMAD4、FBXW7和PTEN等基因突变表达失调和染色体不稳定和微卫星不稳定是结直肠癌发生发展、预后和药物治疗反应敏感性方面密切相关的分子遗传学变化[12-13]。研究结直肠癌发生发展的病理过程中异常表达的生物大分子,有助于阐明结直肠癌发生的分子机制以及发现结直肠癌药物治疗靶点。我们在CRC上对EMI1分子的研究结果可以为结直肠癌诊断的分子分型以及个体化治疗提供一定的理论依据,也可为CRC的治疗提供潜在的治疗靶点。我们的研究具有一定的提示作用,然而EMI1在结直肠癌上的具体生物学功能及分子机制有待将来进一步的细胞分子生物学研究,比如在结直肠癌细胞株中敲低或过表达EMI1后观察细胞的增殖或转移能力的变化,以及相关分子生物学技术手段明确EMI1下游靶基因。
综上所述,EMI1在结直肠癌中表达失调升高,EMI1高表达与结直肠癌转移密切相关,且预示结直肠癌患者的不良预后。EMI1可能可以作为结直肠癌的一个新的预后指标。
