慢性乙型肝炎患者血清IL-12、IL-18水平和外周血单个核细胞FOXp3基因水平研究*
2019-11-13朱凌云张茂海崔莎莎张秋萍
朱凌云,张茂海,崔莎莎,张秋萍
乙型肝炎是由乙型肝炎病毒(hepatitis B virus,HBV)感染引起的以肝实质病变为主的一种传染病。慢性乙型肝炎(chronic hepatitis B,CHB)呈全球分布,是一个非常严重的公共卫生问题[1,2]。寻找新的治疗CHB的靶点是现今急需深入研究的问题。CD4+CD25+调节性 T 细胞 (regulatory T cell,Treg)是一种具有独特免疫调节功能的T淋巴细胞亚群,具有免疫无能性和免疫抑制性两大特性,在维持自身稳定和对外来抗原的免疫耐受过程中扮演着重要的角色[3,4],也对CHB病程和预后产生影响。叉头蛋白 P3(forkhead/winged helix transcription factor,Foxp3)是CD4+CD25+Treg细胞生长发育和功能维持的关键性调控因子,是Treg细胞表达的特异性免疫标志物,常被用于辨别CD4+CD25+Treg细胞[5],也被认为是CD4+CD25+Treg细胞发挥功能的主开关[6]。越来越多的研究显示,其在免疫相关性疾病的发病过程中起作用,如慢性乙型肝炎发病机制可能涉及Treg细胞与效应T细胞之间的免疫失衡,并与HBV感染慢性化有关。白细胞介素-12(interleukin-12,IL-12)和IL-18也是近年来研究的热点。我们检测了CHB患者外周血单个核细胞Foxp3及血清IL-12和IL-18水平,现将结果报道如下。
1 资料与方法
1.1 一般资料 2015年7月~2018年3月期间我院收治的CHB患者78例,男48例,女30例;年龄24~57岁,平均年龄为(39.9±6.2)岁。符合慢性乙型肝炎防治指南的诊断标准[7],纳入患者未接受过免疫调节剂和抗病毒治疗。排除标准:合并甲、丙、丁、戊型肝炎,合并严重的心肺功能损伤,妊娠或哺乳期妇女,其他原因引起的肝病。另选同期健康体检者25例,男20例,女5例;年龄25~55岁,平均年龄为(38.2±6.3)岁。本研究已通过我院医学伦理委员会批准,受检者签署知情同意书。
1.2 检测方法 清晨空腹抽取静脉血10 mL,加入EDTA抗凝管,置于-70℃冰箱保存待检。使用淋巴细胞分离液(北京索莱宝科技有限公司)常规分离外周血单个核细胞,以Trizol法常规提取淋巴细胞总 RNA,上游引物和下游引物分别为 5’-TCACCTACGCCACGCTACT-3’和5’-ACTTCAGGG TTGTGGCGATGG-3’,以Foxp3 mRNA特异引物行RT-PCR(美国Fermetas公司)检测,扩增片段为226 bp,将扩增目的基因在琼脂糖凝胶上进行电泳,在紫外灯分析仪上观察结果,以β-actin为内参照,扩增片段为448 bp,以Foxp3/β-actin作为半定量指标。采用ELISA法(罗氏公司)检测血清IL-12和IL-18水平;使用美国贝克曼库尔特公司生产的AU5800全自动生化分析仪检测血生化指标;采用荧光定量PCR法(湖南圣湘生物科技有限公司)检测血清HBV DNA水平。
1.3 肝穿刺 患者取仰卧位,右手臂上抬弯曲置于枕后,局部皮肤常规消毒,用2%利多卡因行局部麻醉,逐层穿刺皮肤、肋间肌和肝包膜,快速推动切割式针芯进入肝实质,切割肝组织并快速拔针,无菌纱布覆盖并固定穿刺部位,多头腹带紧束肋部及上腹部,加压包扎。
1.4 统计学分析 应用SPSS 20.0软件对数据进行处理分析。计量资料以(±s)表示,组间比较采用t检验,多组间比较采用F检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 不同肝组织炎症活动度分级患者血生化指标和HBV DNA水平比较 G4组患者肝功能指标ALT和AST水平显著高于G1、G2和G3组患者,差异具有统计学意义(P<0.05,表1)。
表1 不同肝组织炎症分级患者血生化和HBV DNA 水平(±s)比较
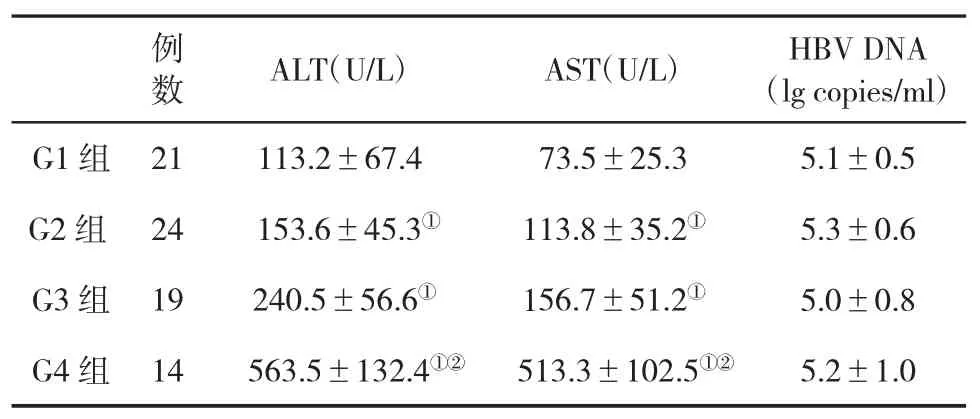
表1 不同肝组织炎症分级患者血生化和HBV DNA 水平(±s)比较
与G1组比,①P<0.05;与G2和G3组比,②P<0.05
数 ALT(U/L) AST(U/L) HBV DNA(lg copies/ml)G1 组 21 113.2±67.4 73.5±25.3 5.1±0.5 G2组 24 153.6±45.3① 113.8±35.2① 5.3±0.6 G3组 19 240.5±56.6① 156.7±51.2① 5.0±0.8 G4组 14 563.5±132.4①② 513.3±102.5①② 5.2±1.0例
2.2 CHB患者与健康人血清IL-12、IL-18及Foxp3基因水平比较 CHB患者血清 IL-12、IL-18及Foxp3基因水平显著高于健康人,差异具有统计学意义(P<0.05,表2)。
表2 两组血清细胞因子和单个核细胞Foxp3 mRNA水平(±s)比较

表2 两组血清细胞因子和单个核细胞Foxp3 mRNA水平(±s)比较
数 IL-12(pg/ml) IL-18(pg/ml) Foxp3 mRNA CHB 78 198.3±19.6 408.6±91.2 4.5±0.7健康人 25 64.5±10.9 127.3±15.7 3.3±0.4 t 43.010 26.063 8.139 P<0.001 <0.001 <0.001例
2.3 不同肝组织炎症分级CHB患者血清IL-12、IL-18及Foxp3 mRNA水平的比较 G4组患者血清IL-12、IL-18及Foxp3基因水平显著高于G1、G2和G3组,差异具有统计学意义(P<0.05,表3)。
表3 不同炎症分级CHB患者血清IL-12、IL-18及Foxp3 mRNA 水平(±s)比较
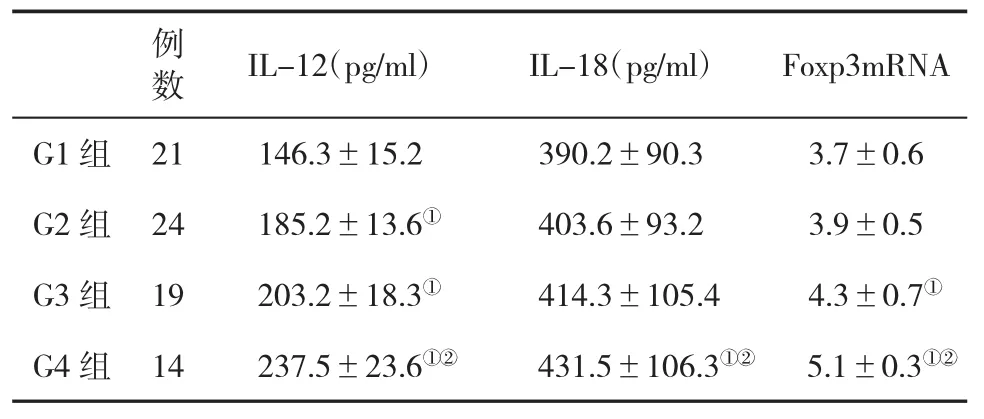
表3 不同炎症分级CHB患者血清IL-12、IL-18及Foxp3 mRNA 水平(±s)比较
与G1组比,①P<0.05;与G3组比,②P<0.05
数 IL-12(pg/ml) IL-18(pg/ml) Foxp3mRNA G1 组 21 146.3±15.2 390.2±90.3 3.7±0.6 G2组 24 185.2±13.6① 403.6±93.2 3.9±0.5 G3组 19 203.2±18.3① 414.3±105.4 4.3±0.7①G4组 14 237.5±23.6①② 431.5±106.3①② 5.1±0.3①②例
3 讨论
CHB感染呈全球性分布,我国CHB感染率高达10%以上,CHB可发展成为肝硬化、肝衰竭及肝细胞癌等疾病,严重困扰着患者及临床工作者[8]。CHB会导致患者肝功能受损。本研究中CHB患者肝功能指标AST和ALT显著高于健康人,差异具有统计学意义,这也提示了CHB对机体损伤的严重性。目前,临床上对于CHB的发病机制研究结果未明确,且临床抗病毒治疗效果较差,其主要原因还是由于抗病毒药物并不能完全清除HBV DNA,且CHB患者或多或少存在着对HBV不同程度的免疫耐受。免疫耐受是指人体对于外来抗原刺激表现出特异性的免疫不应答,对不引起耐受的其他抗原仍然可以产生很好的免疫应答,这就被称之为免疫耐受[9,10]。
Sakaguchil第一次通过清除机体自然产生的CD4+CD25+调节性T细胞后发现会导致自身免疫性疾病,而增加该细胞则能够防止其发生。Tregs是一群拥有负调控作用的T细胞亚群,具有独特免疫调节功能,能够抑制机体的免疫反应,对于维持机体免疫稳态、抗肿瘤免疫和移植免疫耐受方面有着决定性的作用,在病毒感染性疾病中,其一方面可以抑制过度免疫病理损伤,另一方面也可能有利于病毒的持续感染,当机体构成免疫耐受时,HBV很难被免疫系统清除,并且促使HBV感染持续向着慢性化发展,相关研究也显示,CHB患者体内CD4+Tregs明显增高,并抑制抗病毒免疫应答,提示着Tregs与HBV感染所致的免疫耐受有关,并可能导致HBV感染向慢性化进程发展[11-13]。CD4+CD25+Treg现已成为当今研究自身免疫病的新的靶点之一。
Foxp3是翼状螺旋转录因子超家族成员之一,被认为是调节性T细胞的发展和功能的主要调节因子。在以往研究中,在Foxp3基因缺陷的小鼠中无法检测到CD4+CD25+Treg,这说明了Foxp3是衡量CD4+CD25+Treg区别于其他CD4+CD25+Treg的特异性标志。Foxp3也可使初生CD4+CD25+T细胞转化为CD4+CD25+Treg,是在此转化过程中获得免疫调节特性的关键转录调节因子。Foxp3基因定位于Xp11.23,含有84个氨基酸残基的foxhead结构域,C2H2锌指结构和一个亮氨酸拉链,该基因家族编码蛋白具有相似的保守结构,均通过其Foxhead结构域与DNA特定位点结合,调节目的基因的活化和表达[14,15]。目前,已在淋巴组织和肝细胞中检测到其存在,并与肝细胞癌有关,但其作用尚未明确[16],Foxp3在肿瘤细胞中表达并参与肿瘤行为的调控,Foxp3可通过转化生长因子-β/smad2/3信号通路抑制肝癌的进展,Foxp3作为一种预后因素和新的靶点,为治疗肝癌提供了有用的治疗方法[17,18]。
IL-18是机体内一种炎性细胞因子,是由活化巨噬细胞、T细胞、NK细胞等产生,具有多种生物学功能,可以增强NK细胞的细胞毒作用,诱导产生T细胞[19]。IL-18早已被证实其在CHB患者肝脏损伤中发挥着重要的作用且与CHB的疾病进展密切相关[20]。IL-12和IL-18具有相同的抗病毒感染作用,IL-12和IL-18可通过增强CTL和NK细胞的活性以及释放炎性细胞因子,从而参与机体对HBV的免疫清除过程。IL-12和IL-18可有效判断CHB患者病情的发展及预后。本研究中CHB患者血清IL-12和IL-18水平显著高于健康人,差异具有统计学意义,其机制可能是由于Th1/Th2细胞失衡所导致的结果,G4组患者血清IL-12和IL-18水平显著高于G1、G2、G3组患者,差异具有统计学意义,这也说明了IL-12和IL-18参与了CHB患者肝脏炎性化的过程,且随着炎性程度的加重,IL-12和IL-18水平也在不断升高。
本研究结果显示,CHB患者 PMBC Foxp3 mRNA水平显著高于健康人,差异具有统计学意义,说明Foxp3 mRNA过度表达所导致的机体免疫应答下降,产生免疫耐受,使HBV不能被快速清除,而导致感染慢性化。慢性乙型肝炎肝组织严重炎症损伤(G4)患者Foxp3 mRNA水平显著高于其他各组,差异具有统计学意义,说明Foxp3的异常升高可能与慢性乙型肝炎炎性反应程度有关,具体机制可能为慢性乙型肝炎患者炎性反应较为严重,使TGF-β含量增高,在外周刺激CD4+CD25+Treg细胞增殖和成熟,诱导Foxp3的表达,导致Foxp3 mRNA水平异常升高。
Foxp3 mRNA的异常升高代表着CD4+CD25+Treg细胞的活性增强,从而抑制了效应T细胞的免疫反应,使机体的免疫应答能力下降,最终导致HBV不能被有效清除而对机体产生持续感染,并使疾病朝着慢性化的方向发展。深入研究PBMC Foxp3-mRNA与IL-12和IL-18等细胞因子的相互作用,对深入研究CHB的发病机制有积极的意义。
综上所述,血清IL-12和IL-18参与了机体对HBV感染的清除过程,早期检测体内IL-12、IL-18及Foxp3基因水平有利于对CHB患者病毒复制情况及肝组织炎性程度的有效判断,对于CHB患者的诊断和治疗具有十分重要的意义。由于检测PBMCs上分子标记物需要高技术支撑和试剂的稳定,本研究结果还需要更多后续研究证据的支持。
