丹酚酸B对非酒精性脂肪性肝病细胞模型自噬功能的影响*
2019-11-13任俞霏陈小青孔维宗王迎春
任俞霏,陈小青,孔维宗,王迎春
随着肥胖、糖尿病和代谢综合征的患病率不断攀升,非酒精性脂肪性肝病(nonalcoholic fatty liver diseases,NAFLD)已成为我国第一大慢性肝病。NAFLD的特征是大量肝细胞发生脂肪变性,其疾病谱包括非酒精性肝脂肪变(non-alcoholic hepatic steatosis)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝硬化和肝细胞癌(hepatocellular carcinoma,HCC)[1,2]。自噬是细胞应激和平衡的一种反应,通过自噬途径可以降解肝细胞内的脂滴[3,4]。本实验旨在细胞水平研究Sal B是否通过诱导自噬对模型细胞脂肪变起到了治疗作用。
1 材料与方法
1.1 细胞与试剂 人肝癌细胞HepG2(大连理工大学细胞库);棕榈酸(palmitic acid,PA,上海阿拉丁公司);Sal B(大连美仑生物科技有限公司);噻唑蓝(MTT,大连宝生物工程有限公司);检测甘油三酯(TG)和总胆固醇(TC)试剂盒(南京建成生物科技公司);3- 甲基腺嘌呤(3-Methyladenine,3-MA,美国Medchemexpress公司);抗LC3B抗体(美国Cell Signaling Technology公司);荧光抗P62抗体(美国Proteintech公司);Cy3标记的山羊抗兔 IgG、TritonX-100、二脒基苯基吲哚(diamidino-phenyl-indole,DAPI,碧云天生物技术公司);山羊血清、抗荧光淬灭剂(上海索莱宝生物科技公司);油红O染剂、BCA蛋白浓度测定试剂盒、全蛋白提取试剂盒、检测谷草转氨酶(AST)和谷丙转氨酶(ALT)试剂盒、羊抗兔IgG-HRP、内参抗β-actin、抗P62抗体和ECL发光液(沈阳万类生物科技公司)。
1.2 细胞培养 取HepG2细胞,在含有10%胎牛血清和1%双抗的高糖DMEM培养基,于37℃、5%CO2培养箱培养,2~3 d换液1次。待细胞生长达到80%~90%左右,用PBS洗2次,以0.25%胰酶消化并离心,按1:2进行传代。
1.3 PA和Sal B浓度筛选 采用MTT法,待细胞达到对数生长期,以3×103细胞/孔接种于96孔板,培养24 h。待细胞贴壁后,分别加入不同浓度(0、0.25、0.5、0.75、1 mM) 的 PA和不同浓度(0、5、10、25、50 μM)的 Sal B,继续培养 24 h。然后,加入MTT 20 μl/孔,培养4 h,在酶标仪490 nm处测定光密度(optical density,OD)值。
1.4 细胞内脂滴观察 取HepG2细胞,分为对照组(完全培养基培养)、模型组、干预组和抑制剂组,其中模型组用0.5 mM PA干预24 h;干预组用0.5 mM PA干预24 h,再给予10 μM Sal B干预24 h;在抑制剂组,预先加入5 mM 3-MA处理2 h,接着加0.5 mM PA干预24 h,再加入10 μM Sal B继续培养24 h。将HepG2细胞以2.0×105个细胞/孔接种于6孔板,PBS洗涤5 min,×3次,用4%多聚甲醛固定液在室温下固定30 min;PBS洗涤2~3遍,加油红O,避光、37℃染色20 min,去除油红O,加60%异丙醇冲洗;PBS洗至透明,显微镜下观察细胞内脂滴。之后,将每组细胞溶解在500 μl/孔异丙醇中10 min,在酶标仪上测510 nm处OD值。
1.5 细胞上清生化指标测定 在药物分组干预后,收集细胞。将细胞沉淀重悬于PBS中,超声处理并裂解,离心10 min,取上清液,按照试剂盒说明检测。
1.6 细胞自噬蛋白表达检测 采用免疫荧光染色法,根据上述实验分组干预细胞,用4%多聚甲醛固定15 min,除去固定液,PBS洗5 min×3次;滴加0.1%TritonX-100,室温孵育30 min,去除0.1%TritonX-100,PBS洗5 min×3次;滴加山羊血清覆盖细胞,室温15 min;加一抗,在4℃孵育过夜,除去一抗,PBS洗5 min×3次;在室温下加免疫荧光二抗,孵育1 h(避光),用PBS洗5 min×3次;加DAPI复染核,清除DAPI,PBS清洗;将载玻片置于有淬灭剂的载玻片上,在荧光显微镜下观察细胞的荧光强度并拍照。随机选取每组免疫荧光图片4个视野,应用IPP软件对图片进行积分光密度(integrated optical density,IOD)量化分析,求取平均值,作为该蛋白的表达强度。
1.7 细胞LC3B蛋白表达检测 采用Western Blot法,消化收集各组处理的细胞,用RIPA 200 μL充分裂解提取蛋白,BCA法测样品蛋白浓度,计算每组蛋白浓度,上样至泳道,电泳80 v恒压2.5 h,凝胶分离,转至PVDF膜上,5%脱脂奶粉封闭过夜,加入不同稀释度的一抗(1:1000),于4℃孵育盒中封闭过夜,加二抗孵育1 h。以化学发光法显示结果并拍照。
2 结果
2.1 筛选药物浓度情况 与对照组比,经0.75 mM和1.0 mM PA处理,显著地抑制了细胞活力(P<0.05),而低于0.5 mM的PA浓度对细胞活力无明显影响。因此,选择0.5 mM处理细胞24 h为PA最佳造模浓度;不同浓度的Sal B处理HepG2细胞24 h,结果表明,经10 μM Sal B处理,对细胞活力无明显的抑制作用。所以,选定10 μM Sal B处理24 h为最佳干预浓度(表1)。
表1 不同浓度药物处理细胞活性(OD值,±s)比较
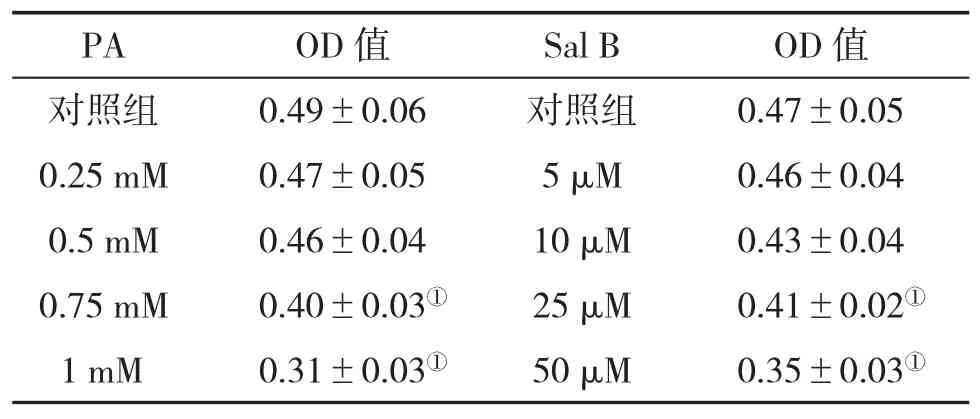
表1 不同浓度药物处理细胞活性(OD值,±s)比较
与对照组比,①P<0.05
PA OD值 Sal B OD值对照组 0.49±0.06 对照组 0.47±0.05 0.25 mM 0.47±0.05 5 μM 0.46±0.04 0.5 mM 0.46±0.04 10 μM 0.43±0.04 0.75 mM 0.40±0.03① 25 μM 0.41±0.02①1 mM 0.31±0.03① 50 μM 0.35±0.03①
2.2 各组生化指标比较 与对照组比,PA模型组生化指标显著升高(P<0.01);Sal B干预组和抑制剂组生化指标较模型组显著降低,而经抑制剂处理,生化指标又有所升高(P<0.05,表2),提示Sal B可明显改善细胞脂质蓄积。
2.3 各组细胞脂滴变化比较 模型组OD值为(0.666±0.009),较对照组的(0.247±0.011)显著升高;干预组OD值为(0.477±0.013),抑制剂组为(0.507±0.002),较模型组显著降低,而较干预组显著升高,差异有统计学意义(F=1018.832,P<0.001,图1)。
2.4 各组细胞自噬蛋白表达比较 在荧光显微镜下,与对照组细胞LC3B表达荧光强度(1.00±0.00)比,模型组为(1.15±0.15),荧光强度增加,但差异无统计学意义(P>0.05);干预组细胞LC3B荧光强度为(6.60±0.01),比模型组显著增强(P<0.01),而抑制剂组为(3.34±0.12),比干预组显著减弱(P<0.05,图2、图3)。
表2 各组培养上清生化指标(±s)比较
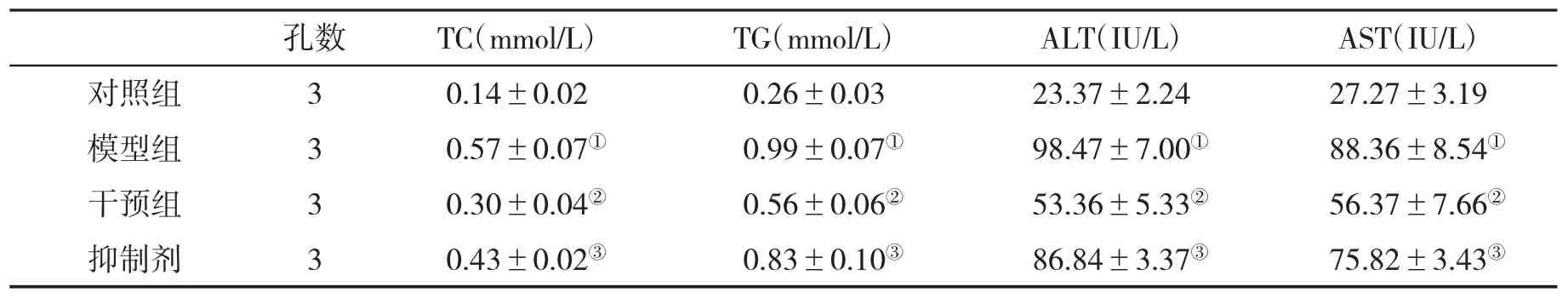
表2 各组培养上清生化指标(±s)比较
与对照组比,①P<0.01;与模型组比,②P<0.05,③P<0.05;与干预组比,③P<0.05
孔数 TC(mmol/L) TG(mmol/L) ALT(IU/L) AST(IU/L)对照组 3 0.14±0.02 0.26±0.03 23.37±2.24 27.27±3.19模型组 3 0.57±0.07① 0.99±0.07① 98.47±7.00① 88.36±8.54①干预组 3 0.30±0.04② 0.56±0.06② 53.36±5.33② 56.37±7.66②抑制剂 3 0.43±0.02③ 0.83±0.10③ 86.84±3.37③ 75.82±3.43③

图1 各组细胞脂滴变化(油红O染色,400×)
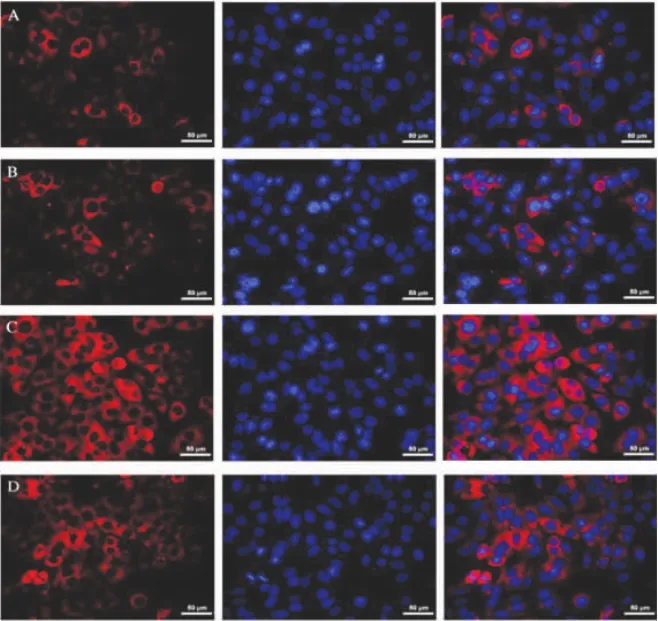
图2 不同细胞组荧光强度比较 各组显示红色荧光为自噬蛋白LC3B表达,蓝色荧光为核染色DAPI表达,Merge为红色荧光LC3B与蓝色荧光DAPI的融合表达(400×)
2.5 各组细胞LC3B蛋白表达比较 与对照组细胞LC3B蛋白相对表达量(0.18±0.02)比,模型组为(0.22±0.02),差异无统计学差异(P>0.05);干预组细胞LC3BⅡ/Ⅰ表达量为(0.97±0.01),比模型细胞显著增强(P<0.01),而抑制剂组为(0.44±0.05),有所降低(P<0.05,图4、图5)。
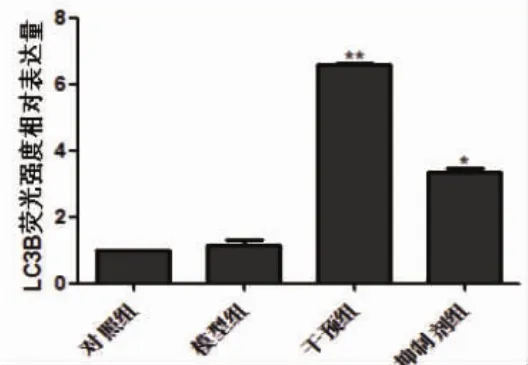
图3 各组细胞LC3B表达相对荧光强度比较
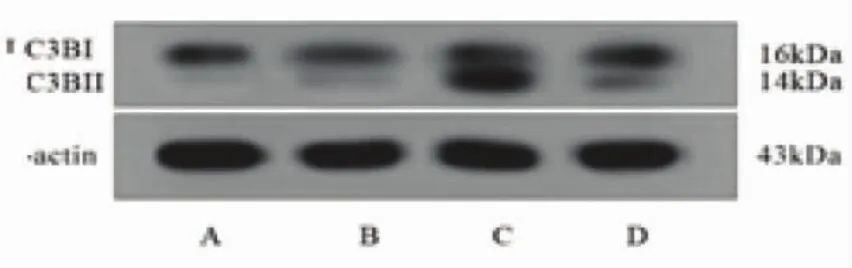
图4 不同组细胞LC3B蛋白表达强度比较

图5 各组细胞LC3BⅡ/Ⅰ蛋白表达半定量分析
3 讨论
本研究结果显示Sal B具有保护肝细胞的作用,与国内其他学者的研究结果一致[3-6]。Sal B是丹参中水溶性单体的有效成分,可有效降低高脂饲养大鼠血清转氨酶水平[2]。Sal B可能是通过PI3K/Akt/Nrf2途径抑制氧化应激[5-9]。研究发现Sal B可有效抑制肝细胞凋亡,其机制可能与调节死亡受体和线粒体通路相关[10-13]。Sal B是一种新型自噬诱导剂,通过抑制AKT/mTOR途径在结肠直肠癌细胞发挥其抗肿瘤活性[14,15]。由于PA诱导的自噬促进肝细胞内脂质代谢而减少脂质堆积,从而减少PA引起的脂质毒性,即自噬可降解脂滴[16,17]。
为了验证Sal B对细胞脂滴的作用机制是否是通过自噬,我们应用3-MA预先干预实验细胞,再用Sal B处理,结果发现Sal B的治疗作用与其增强细胞自噬有关。在体外培养的大鼠肝细胞,增强自噬可以减少细胞脂肪的沉积,而抑制自噬可增加甘油三酯的储积[18]。自噬可选择性地隔离和降解功能失调的线粒体,以防止细胞内过多的活性氧蓄积和细胞死亡[19]。在脂肪性肝炎时,受损的线粒体功能不能及时处理氧化应激反应,脂质介导的自噬抑制可能不再保护线粒体功能,进一步导致细胞死亡[20]。
目前,研究自噬在 NAFLD领域还处于起步阶段,自噬激动剂和抑制剂在临床应用的合理性尚无理论和经验的论证支持。
