肝纤维化诊断及治疗共识(2019年)
2019-11-13中华医学会肝病学分会中华医学会消化病学分会中华医学会感染病学分会
中华医学会肝病学分会 中华医学会消化病学分会 中华医学会感染病学分会
肝纤维化(hepatic fibrosis)或肝硬化(cirrhosis)在国际疾病分类-11(international classification of diseases,ICD-11)为DB93.0。肝纤维化是指肝脏细胞外基质(即胶原、糖蛋白和蛋白多糖等)的弥漫性过度沉积与异常分布,是肝脏对慢性损伤的病理性修复反应,是各种慢性肝病向肝硬化发展过程中的关键步骤和影响慢性肝病预后的重要环节。肝纤维化进一步发展可引起肝小叶结构紊乱,肝细胞结节性再生,形成假小叶结构即肝硬化,临床上出现肝功能减退和门静脉高压症表现。肝纤维化组织学上是可逆的,肝硬化逆转较为困难,但仍有少部分可逆转[1]。
目前,肝活组织检查(简称肝活检)仍然是肝纤维化诊断的“金标准”。尽管一些血清学诊断模型和瞬时弹性成像等无创性检测方法对肝纤维化有较高的诊断价值,但仍有待进一步完善。肝纤维化治疗方面,尚未有公认特异有效的化学药物和生物制剂。在药物临床研究方面,对于其目标人群、适应证、疗程、疗效判断标准及替代指标等方面尚待完善和统一。因此,肝纤维化的诊断和治疗及药物开发研究等方面仍有不少分歧和争议,尚缺乏共识。2002年中华医学会肝病学分会肝纤维化学组在曾民德、王泰玲和王宝恩等教授组织下,制定了《肝纤维化诊断及疗效评估共识》[2]。该共识对指导临床医师肝纤维化诊治提供了很大的帮助。近年来,肝纤维化基础和临床及其认识方面有不少进展,广大临床医师及相关人员迫切需要相关的知识,以指导临床诊疗、科研和学术交流,为此我们组织了国内本领域相关专家,对相关资料进行整理和分析,形成《肝纤维化诊断及治疗共识》(2019年),以便更好地指导临床医师进行合理的诊断和治疗肝纤维化。随着肝纤维化诊断和治疗研究的不断深入,本共识将适时更新。
本共识采用共识分级的评估、制定和评价(GRADE)系统,对循证医学证据质量和共识级别(表1)进行评估[3]。在形成共识时,不仅考虑到证据质量,还要权衡干预的利弊与负担、患者偏好与价值观的可变性,以及资源合理利用、推荐措施的公平性与可实施性等。
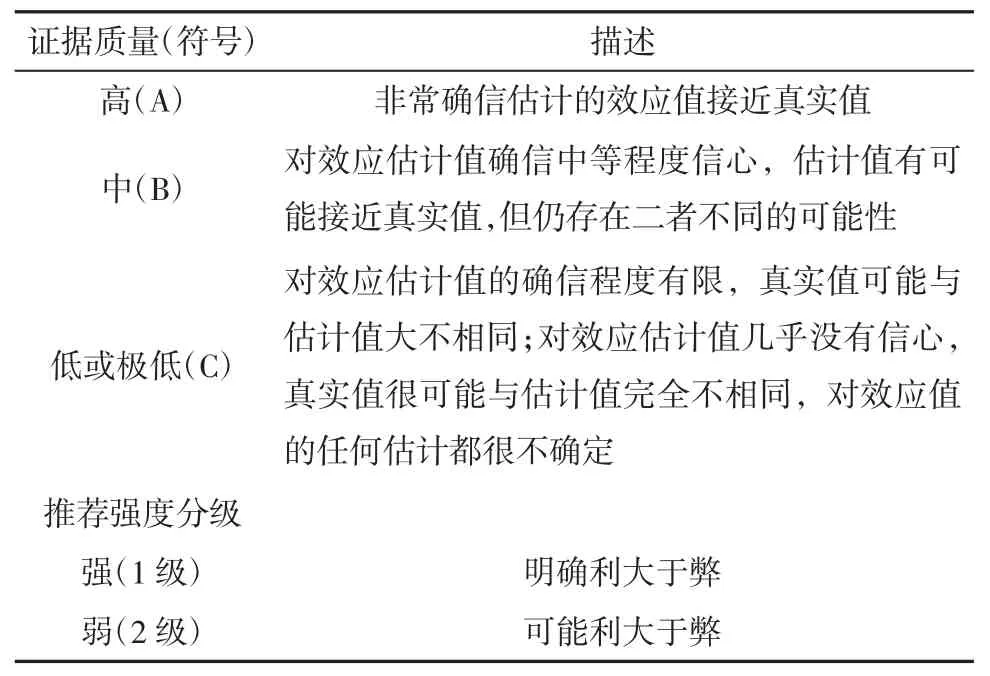
表1 证据质量分级和推荐强度分级标准
一、肝纤维化诊断和评估
(一)肝活检组织病理学
目前,肝活检组织病理学检查仍是肝纤维化诊断的“金标准”。由于肝活检属于创伤性检查,少数病例可能会发生并发症,如疼痛、出血、感染甚至死亡,不易被患者接受和费用较高等缺点,限制了其普遍应用。为进一步降低肝活检的风险,建议需严格把握适应证和禁忌证,并推荐在影像学引导下的肝活检。当存在腹水、凝血功能异常或血小板<60×109/L时,经皮肝活检的风险较大,此时可选择经颈静脉肝活检。在组织病理学诊断方面尚存在观察者内和观察者间的差异。
1.肝活检组织病理学检查的基本要求:病理组织学检查是明确诊断、衡量炎症活动度、纤维化程度,以及判定药物疗效的重要依据。为避免因肝穿刺组织太少给正确诊断带来困难,应力求用粗针穿刺(最好用16G),标本长度须在1.0 cm以上(1.5~2.5 cm),至少在镜下包括6个以上汇管区。肝穿刺标本应作连续切片,常规作苏木精-伊红、网状纤维和/或Masson三色染色,以准确判断肝组织内炎症活动度、结构改变及纤维化程度,并根据需要增加免疫组织化学染色或病毒的抗原或核酸原位杂交检测,以及聚合酶链反应法(PCR)、酶学和金属含量检测等,以进一步满足基础和临床研究以及评估药物治疗效果的需要。病理学医师应力求对病变定性准确,划分程度恰当,并密切与临床相结合,保证病理学诊断的准确性[4]。
2.肝组织炎症分级和纤维化分期:肝组织损害程度以炎症分级(grading,G)和纤维化分期 (staging,S)来表示。分级是依据坏死和炎症的程度,评估病变的活动程度;分期是依据纤维化程度和肝硬化的形成,表示疾病进展情况,与病程有关,并影响治疗及预后。但任何一个评分系统中的数字都只代表对某种病变类型的半定量评估,而非绝对定量,对界面肝炎、汇管区炎症及肝细胞损伤等不同损伤程度的界定都不是线性相关。1981年Knodell等[5]最早提出半定量评分系统诊断慢性肝炎,将分级和分期的结果分别进行计分,获得组织学活动指数(histological activity index,HAI)。Knodell评分系统主要缺点在于将炎症坏死和纤维化合并,但组织学上这两种病变并非平行发生;且HAI是加权计数,会导致计数不连贯。因此,Knodell评分系统目前已较少应用。目前常用的有Scheuer、METAVIR以及Ishak评分系统。
Scheuer评分系统将肝纤维化分为0~4期[6]。该方法也存在缺陷,对于严格区别1期(汇管区扩大)和2期(汇管区周围纤维化)部分病例有一定困难。同样,对于3期描述“纤维间隔伴小叶结构紊乱”的具体定义也不明确。
Ishak评分系统是Knodell评分系统的改良版,将肝纤维化评估分为0~6期[7];是目前国际上用于前后病例对照研究评估肝纤维化变化最敏感和最常用的方法。可区分1、2期的“短纤维间隔”和3、4期的完全纤维间隔形成,该分期还可以明确分辨汇管区-中央静脉桥接纤维和汇管区-汇管区桥接纤维,但该系统中定性描述语言如“少数”和“大多数”无明确定义,从而具有一定主观性。近期国内外学者为了减少人为的误差,对Ishak评分中的“少数”和“大多数”进行了量化,并根据纤维间隔和假小叶的数目进行了分期,“少数”是指1~3条纤维间隔,超过3条为“大多数”。因此,Ishak评分系统对肝纤维化分期表述如下:Ⅰ期:无纤维间隔;Ⅱ期:1条纤维间隔;Ⅲ期:2~3条纤维间隔;Ⅳ期:4条纤维间隔;Ⅴ期:4条或以上纤维间隔+明确1~3个假小叶;Ⅵ:超过3个以上假小叶[7-8]。
METAVIR系统将肝纤维化分为0~4期[9];该系统未将汇管区-汇管区和汇管区-中央静脉桥接纤维间隔区分分类,并且对于“纤维间隔”也未指明是否包括不完全纤维间隔和桥接纤维间隔。一般认为,完全桥接纤维化应作为明确的病理学特征,可定义为2期。
上述介绍的多种评分系统是半定量而非定量的,作为一种数字概念仅代表某一病理学模式的分类,并非绝对定量。例如某一特征的评分为2,并不等同于2个1之和,或者4的一半,其仅为介于1和3之间的计数,故评分不能用于相互比较或者换算。表2和表3列出4个评分系统关联性及优缺点并进行了比较,这些评分系统均重视纤维间隔(桥接纤维化)的出现对病变进程的判断意义[10]。组织学分期按S0~S4区分。S0为无纤维化;S1为轻度纤维化;S2为中度纤维化;S3为进展期肝纤维化;S4为肝硬化。目前,临床病理学分期诊断中,普遍注重判别有无显著纤维化的意义,以S0-1表示无显著纤维化,以纤维间隔或桥接纤维化出现,即Scheuer和METAVIR≥S2或Ishak≥S3定义为显著纤维化(significant fibrosis,SF),Scheuer和METAVIR≥S3或 Ishak≥S4定义为进展期肝纤维化(advanced fibrosis,AF)。
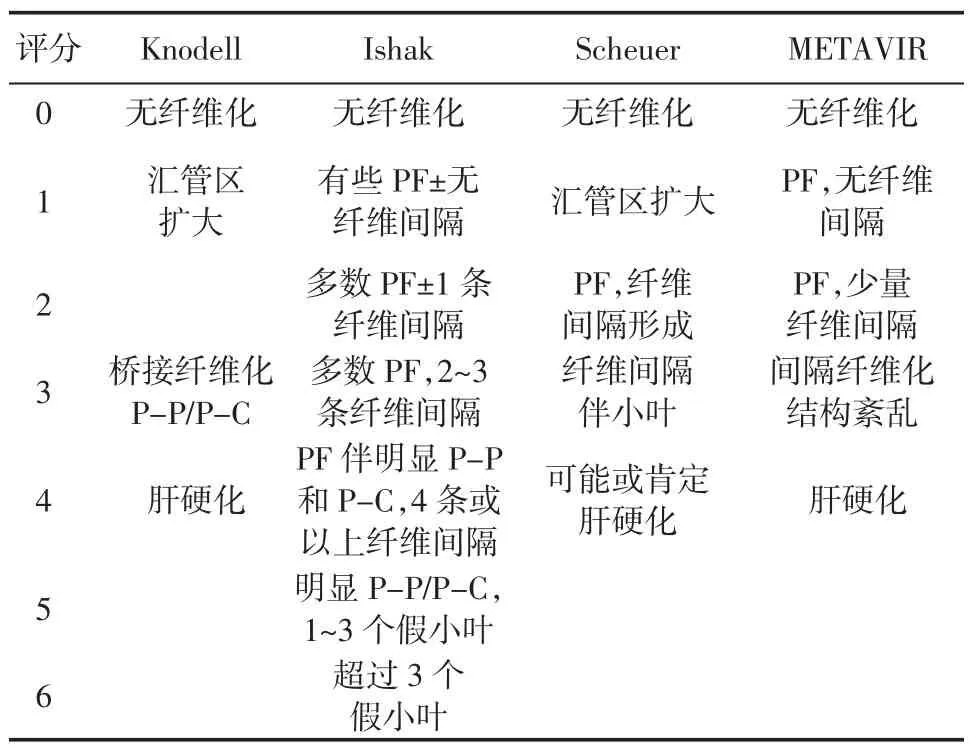
表2 四种肝纤维化分期半定量评分系统及其关联性

表3 各评分系统的优缺点比较
1995年国内学者以Scheuer评分系统为基础修订了慢性肝炎的病理学诊断标准(表4),并在临床广泛应用。近期有学者提出了评估肝纤维化/肝硬化逆转的病理学新分类,称为P-I-R分类,该分类对有纤维间隔(Ishak≥3期)作了进一步分析,根据纤维间隔的所占比例不同,将肝纤维化分为进展型(progressive,P)、逆转型 (regressive,R)和不确定型(indeterminate,I)三类[11]。并且进一步提出了肝纤维化评价新标准,即“北京标准”。此标准包含炎症活动度、肝纤维化分期和P-I-R三部分。加入P-I-R评分后,不仅为评估肝纤维化动态变化提供了依据,也有助于评估治疗前后肝纤维化分期无变化者,使用P-I-R分类可细分出具有纤维化逆转趋势的患者,是对传统肝纤维化分期标准的有益补充,在组织学上进一步明确了肝纤维化逆转的定义。
3.图像分析对肝组织进行定量评估:传统染色的图像分析计算胶原比例区(collagen proportionate area,CPA)有价值,设备简单容易推广。最近发展起来的非染色成像技术,结合数字病理学的自动量化系统组织图像定量技术能够对肝脏病理学图像进行自动分析,在肝小叶特定部位提取超过100个胶原蛋白特征参数用于肝纤维化量化评估,为病理学专家提供精确与客观的数据[12]。非染色组织纤维化成像系统肝组织样本无需染色处理,具有精确、客观、便捷和可重复性等特点。基于此技术建立的肝纤维化评估新方法qFibrosis可用于定量评估肝纤维化严重程度。qFibrosis是由组织胶原蛋白87个特征参数构造而成,具有高精确性和可重复性,可修正由观察者自身偏差引起的误差,并且优于CPA测定方法。qFibrosis能够有效区分Ishak评分所确定的S5和S6的差异,可监测非肝硬化到肝硬化的转变现象。该技术未来可用于临床肝纤维化诊断及药物疗效等评估,有很好的应用前景。
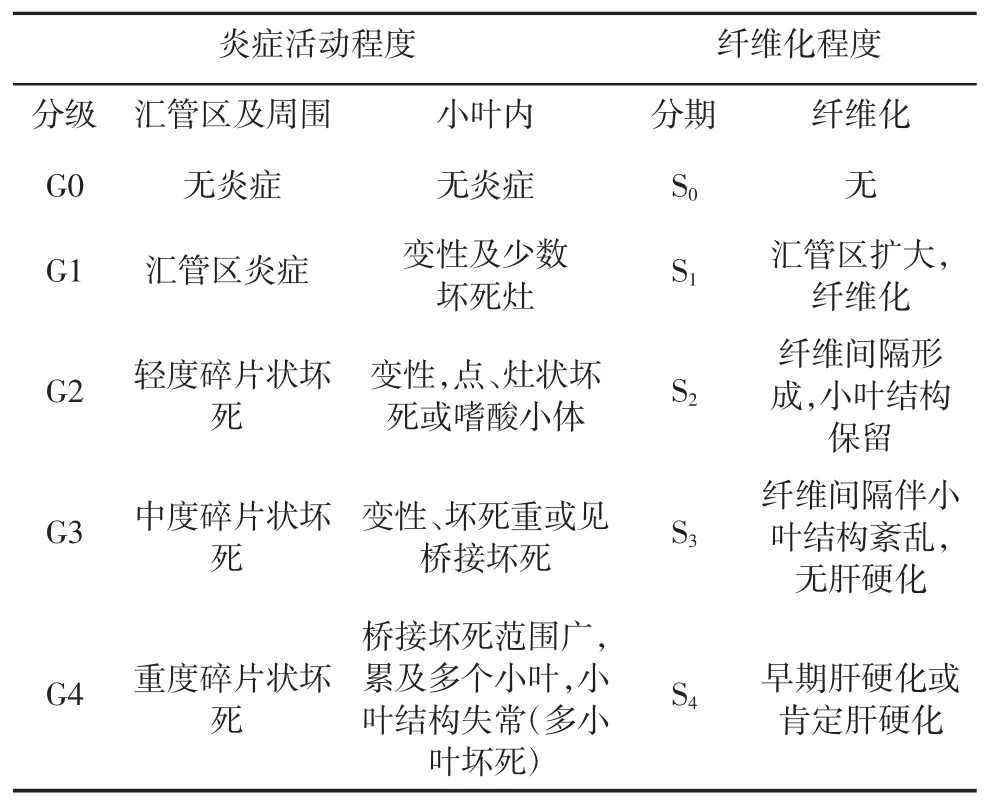
表4 慢性肝炎分级分期标准(1995年,北京)[11]
4.组织病理学诊断的局限性:肝活检属于创伤性检查,不易被患者接受,约0.3%患者肝穿刺后发生严重并发症,因此限制了其临床应用。此外,肝纤维化不均匀性分布常导致组织学评估错误[13];非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)的纤维化不均匀性较慢性丙型肝炎(chronic hepatitis C,CHC)明显,这与肝脏不同区域肝实质损伤后愈合的差异有关。慢性肝病的炎症活动性病理学分级诊断准确性一般都相对高于纤维化的分期诊断,分级诊断可仅误差1级,而分期(S3和S4)可误差1~2期。应用METAVIR系统评估肝脏左右叶之间的炎症和纤维化可发现炎症分级至少差异1级者为24%,而纤维化分期至少差异1期者为33%[13]。传统的合适肝活检标本指长度1.5 cm并含4~5个汇管区,近来普遍不能接受此标准。应用半定量系统评估肝纤维化的标本长度应≥2.0~2.5 cm,宽度>1.2~1.4 mm,含 11~15 个汇管区。METAVIR系统标本长度至少2.5 cm;Ishak系统标本长度至少2.0 cm,宽度1.4 mm,含至少11个汇管区[13]。肝活检获取的2.0 cm肝组织仅是整个肝脏的5万分之一,标本太小可出现纤维化分期低估、肝硬化的漏诊可达15%~30%[14]。标本长度不够和标本破碎造成的标本错误是病理学诊断失败的常见原因,由其引起的分级和分期假阴性分别占10.1%和4.5%,主要与标本太小有关;而纤维化分期的假阳性发生率3.5%,则主要与标本破碎有关[15]。组织学分析活检标本需要经验和技能,但仍然存在主观倾向,易在观察者内和观察者间产生差异。肝脏病理学家对纤维化分期诊断在观察者内的一致性为60%~90%;在观察者间的一致性为70%~90%[4]。
推荐意见1 肝组织病理学检查是肝纤维化诊断的金标准(A1)。肝组织标本长度须1.0 cm以上(1.5~2.5 cm),至少在镜下包括6个以上汇管区(B1)。
推荐意见2 临床上肝组织炎症和纤维化病理学诊断采用Scheuer评分系统,药物治疗前后肝纤维化疗效评估应采用Ishak评分系统(B1)。必要时应用图像分析对肝组织进行纤维化定量评估(B2)。
(二)肝静脉压力梯度 (hepatic venous pressure gradient,HVPG)
HVPG是肝静脉楔压和肝静脉自由压之间的差值,反映了门静脉与腔静脉之间的压力差;对于窦性原因导致的门静脉高压,HVPG可以间接反映门静脉压力。HVPG≥10 mmHg是诊断临床显著性门静脉高压(clinically significant portal hypertension,CSPH)的金标准,提示肝硬化代偿期患者发生静脉曲张、失代偿事件(静脉曲张出血、腹水、肝性脑病等)和肝癌的风险升高。HVPG≥12 mmHg是发生静脉曲张出血的高危因素。HVPG≥16 mmHg提示肝硬化门静脉高压患者的死亡风险升高。HVPG≥20 mmHg提示肝硬化急性静脉曲张出血患者的止血治疗失败率和死亡风险升高。因此,基于HVPG指导的肝硬化危险分层和个体化治疗是目前该领域的前沿热点[16]。此外,HVPG能够反映肝脏整体结构和功能的改变,避免了肝活检的取样误差,可作为肝活检的有效补充[17]。研究结果表明,HVPG和肝纤维化分期显著相关。随着肝纤维化程度愈重,慢性肝病患者的HVPG值愈高,CSPH及肝硬化失代偿事件发生率也愈高。然而,HVPG对操作技术水平有一定要求,且属于创伤性检查,窦前性等不同部位性质病变对其值测定有影响,因此,应加强HVPG标准化检测,以及无创替代技术的研发和转化应用价值[18]。
推荐意见3 HVPG与进展期肝纤维化程度相关,是肝硬化门静脉高压诊断和危险分层的金标准,其标准化检测及无创替代技术在肝硬化治疗目标评估中具有重要价值(B1)。
(三)血液生物化学指标
目前,尚缺乏血清特异性肝纤维化诊断指标[19-20];依单一血液指标对肝纤维化评估作用有限,联合检测和评估可提高诊断价值。目前已对数个以血液学检查结果为参数的肝纤维化无创诊断模型进行了评价,部分模型诊断价值较高(表5),无创诊断模型只能在一定程度上替代肝活检,可减少约30%~40%的肝活检需要。需要注意的是这些诊断模型大多来自慢性乙型肝炎(chronic hepatitis B,CHB)和CHC,且只对无纤维化或有极重度纤维化的患者有价值,对中间程度肝纤维化和其他原因所致的肝纤维化分期的预测价值尚不尽人意[21]。目前,较简单且有临床应用价值的主要有APRI[APRI=AST×100/血小板]和FIB-4[FIB-4=(年龄×AST)/(血小板×ALT1/2)][22-23]。APRI指数的构建源于CHC患者,成人APRI≥2预示发生肝硬化,APRI<1用于排除肝硬化,近年的研究结果显示该指数对CHB诊断价值并不高。FIB-4可用于CHB患者,≥3.25用于诊断METAVIR≥F3,FIB-4<1.45用于排除METAVIR≥F3的诊断效能较高。
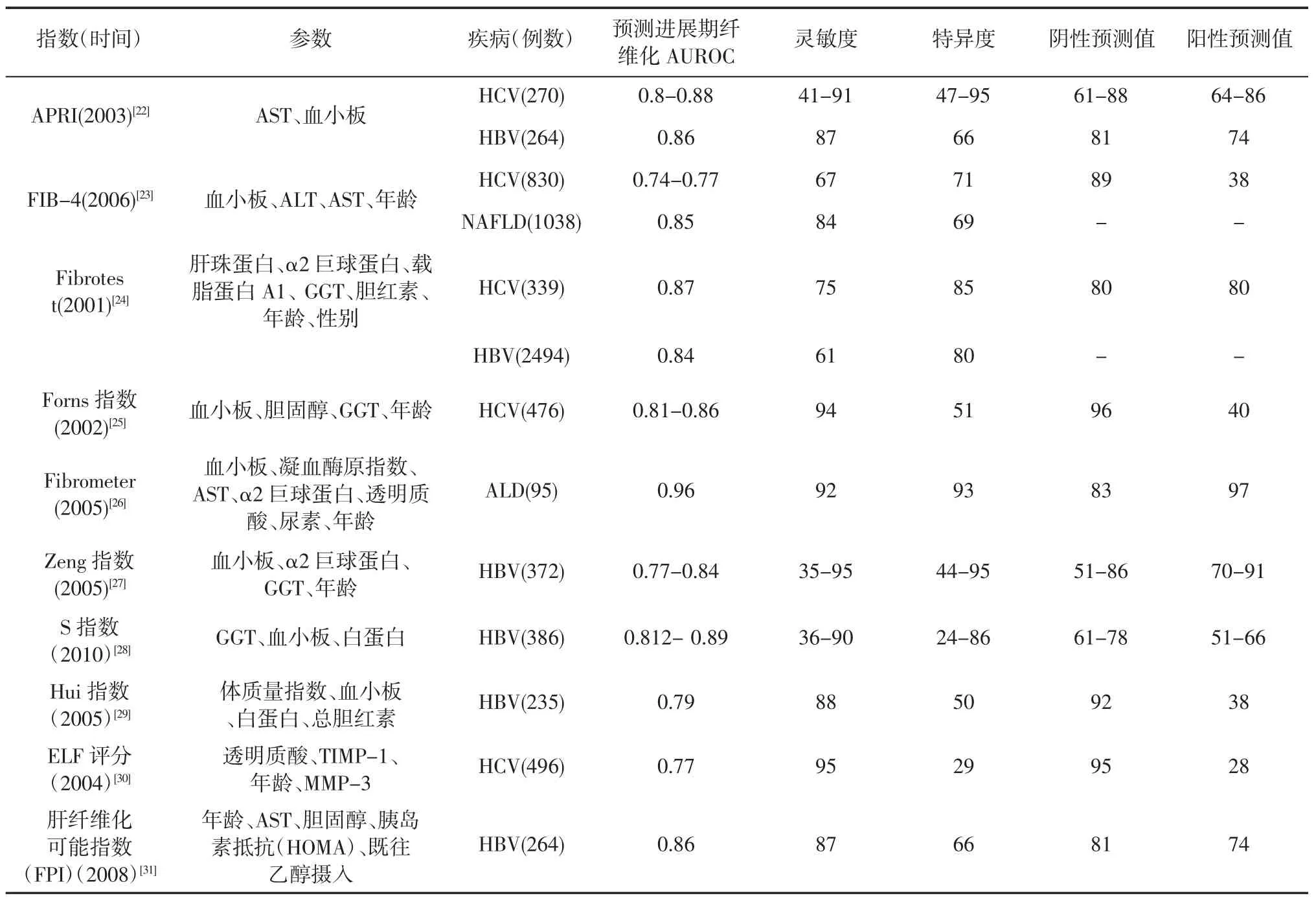
表5 血清标志物诊断价值
推荐意见4 目前尚缺乏准确性高的肝纤维化血液学诊断指标,FIB-4和APRI等对诊断有一定的帮助,可减少约30%~40%的肝活检需要(B2)。
(四)影像学评估
影像学诊断因无创、重复性高等优势,逐渐用于评估肝纤维化程度。常规超声、CT、MRI对于早期肝纤维化常无特征性发现,因此,对肝纤维化的早期诊断意义不大。瞬时弹性成像和磁共振弹性成像已成为目前无创性诊断和评估肝纤维化较有前景的方法[32]。声脉冲辐射力(acoustic radiation force impulse,ARFI)弹性成像和二维剪切波弹性成像 (twodimensional shear wave elastography,2D-SWE)尚在临床研究阶段。
2.CT和磁共振成像:常规CT/磁共振成像检查包括平扫和增强扫描,可观察肝脏的形态学改变,但难以对早期肝纤维化进行定量评估,对肝硬化和肝占位有较大的价值[34]。
推荐意见5 常规超声、CT、磁共振成像在早期肝纤维化无特征性发现,对肝纤维化早期诊断意义不大,但有助于诊断肝硬化和发现肝占位(C2)。
3.弹性成像:
(1)瞬时弹性成像(transient elastography,TE):TE 是一种较新的无创性诊断肝纤维化技术,通过测定肝脏的弹性评估肝纤维化程度,目前已临床应用的是FibroScan和FibroTouch。基本原理为利用特殊探头震动产生一个瞬时低频脉冲激励,使肝组织产生瞬间位移和剪切波,跟踪并采集剪切波可获得组织弹性模量,通过肝脏硬度测定 (liver stiffness measurement,LSM)评估肝纤维化程度。剪切波速度越大,LSM值越高,检测区内肝组织越硬。TE检查需严格按标准程序实施,患者取仰卧位,右手放在头后,右上肢充分外展,暴露肝右叶区的肋间隙。通常取剑突水平线、右腋中线及肋骨下缘所包围的区域为检测区域。探头垂直紧贴于皮肤,于肋间隙选定测量位置。操作者应接受规范培训并严格遵守操作规程,操作经验最好在500次以上;操作人员不宜频繁更换。有效检测需满足以下条件:同一检测点至少成功检测10次,检测值四分位数差距与中位数比值<0.3。肝脏炎症和胆红素水平可影响LSM值。因此,患者应在血清胆红素51 mol/L情况下,空腹或餐后3h接受检测,过量饮酒者应戒酒1周后接受检测;诊断界值选择需参照病因及血清ALT水平,并排除右心衰竭可能[35-37]。
在胆红素正常、ALT<5×正常值上限(ULN)的CHB患者中,TE诊断肝硬化的受试者工作特征曲线下面积(area under receiver operation characteristic,AUROC)为 0.90~0.94;确定诊断建议界值13.1~21.3 kPa,特异度0.93~0.97、阳性似然比(positive likelihood ratio,PLR)8~19;排除诊断建议界值 8.4~11.6 kPa,灵敏度 0.90~0.98、阴性似然比(negative likelihood ratio,NLR)0.02~0.12[37-38]。诊断进展期肝纤维化 (S3)的AUROC 为 0.87~0.94,确定诊断建议界值 10.0~12.4 kPa,特异度 0.92~0.98、PLR 10.5~25.5;排除诊断建议界值 5.8~8.1 kPa,灵敏度 0.86~0.96、NLR 0.07~0.16。诊断显著肝纤维化的AUROC 为 0.82~0.86,确定诊断建议界值 9.0~9.8 kPa,特异度 0.95~0.97,PLR 6.4~17.3[39]。在 ALT 正常患者中,TE 诊断CHB肝硬化的AUROC为0.96;确定诊断建议界值12.0 kPa,诊断特异度0.95、PLR 12.9;排除诊断建议界值9.0 kPa,诊断灵敏度1.0、NLR 0;诊断进展期肝纤维化AUROC为0.90,确定诊断建议界值9.0 kPa,诊断特异度1.0;排除诊断建议界值6.0 kPa,诊断灵敏度0.93、NLR 0.15。基于CHB患者LSM检测受炎症等因素影响,怀疑LSM假性升高患者可考虑非同日再次检测确认。核苷酸类似物抗乙型肝炎病毒(HBV)治疗78周后,LSM数值的下降提示肝脏炎症程度明显改善[40-41]。
推荐意见6 在CHB患者中,胆红素正常、ALT<5×ULN的CHB患者LSM≥17.0 kPa时考虑肝硬化,LSM≥12.4 kPa(1×ULN<ALT<2×ULN 时 10.6 kPa) 考虑进展期肝纤维化;LSM<10.6kPa排除肝硬化可能;LSM≥9.4 kPa考虑显著肝纤维化;LSM<7.4 kPa排除进展期肝纤维化;LSM在7.4~9.4 kPa的患者如无法确定临床决策,考虑肝活检;胆红素异常患者应进行动态评估 (A1)。胆红素、ALT正常的CHB患者LSM≥12.0 kPa考虑肝硬化,LSM≥9.0 kPa考虑进展期肝纤维化,LSM<9.0 kPa排除肝硬化,LSM<6.0 kPa排除进展期肝纤维化,LSM在6.0~9.0 kPa者如无法决定临床决策,考虑肝活检(B1)。
TE诊断CHC患者肝硬化的AUROC为 0.90~0.97,确定诊断建议界值 12.5~14.6 kPa,特异度 0.85~0.95、PLR5.1~16.6;排除诊断建议界值 9.3~14.6kPa,灵敏度 0.72~0.94、NLR 0.07~0.31[42-43]。诊断进展期肝纤维化的 AUROC 为 0.83~0.95,确定诊断建议界值 8.6~9.6 kPa,特异度 0.80~0.97、PLR3.6~21.5,不同研究建议界值证据强度缺乏一致性;排除诊断建议界值 7.3~8.6 kPa,对应灵敏度 0.94~0.80、NLR 0.07~0.2。诊断显著肝纤维化的AUROC为0.73~0.86,建议确定诊断界值6.8~8.8kPa,特异度 0.75~0.91,PLR2.3~6.8,缺乏足够证据强度确定诊断,合理诊断界值应高于9.0kPa。
根据职业教育分专业进行教学的特殊性以及学生层次不一、学习风格各异的特点,职中语文教学要彻底冲破传统观念的束缚,充分尊重学生的需要,遵循市场经济规律,体现语文教学的专业性色彩。
推荐意见7 CHC患者LSM?14.6 kPa考虑肝硬化,LSM<10.0 kPa可排除肝硬化;LSM<7.3 kPa排除进展期肝纤维化,目前缺乏进展期肝纤维化、显著肝纤维化的可靠诊断界值(A1)。
五项较大样本研究涉及TE诊断成人非酒精性脂肪性肝病患者肝纤维化。Cassinotto等[44]纳入了肝穿刺活组织长度仅10~15 mm的受试者,可能存在肝纤维化低估、肝硬化漏诊而导致界值阳性预测值、PLR降低;Siddiqui等[45]报道肝活检与TE非同步进行,时间差长达12个月,结果显示TE可较好地鉴别进展期和早期肝纤维化。成人非酒精性脂肪性肝病中,LSM≥15.0 kPa考虑肝硬化,LSM≥11.0 kPa考虑进展期肝纤维化,LSM<10.0 kPa考虑排除肝硬化,LSM<8.0 kPa考虑排除进展期纤维化;LSM处于8.0~11.0 kPa的患者需接受肝活检明确肝纤维化状态。涉及TE诊断酒精性肝病肝纤维化的研究均包含肝穿刺活组织长度10~15 mm病例。LSM 19.7 kPa诊断肝硬化的特异度90%、PLR 9.7[46]。酒精性肝病患者LSM≥20.0 kPa考虑肝硬化,LSM<12.5KPa排除肝硬化,LSM<9.5 kPa排除进展期肝纤维化。自身免疫性肝炎肝纤维化无创性诊断Meta分析中,LSM 16.0~19.0 kPa诊断肝硬化的PLR为5.1~92.3,中位数12.4 kPa排除诊断的NLR为0.14;LSM中位数10.7 kPa诊断进展期肝纤维化的PLR为7.7,中位数8.5 kPa排除诊断的NLR为0.24;LSM 在9.0~110.1 kPa诊断显著肝纤维化的PLR为14.6。建议自身免疫性肝炎肝纤维化诊断界值可参照ALT<2ULN的CHB的标准,目前,对于原发性胆汁性胆管炎(primary biliary cholangitis,PBC)尚缺乏可靠诊断界值[47]。
推荐意见8 成人非酒精性脂肪性肝病中,LSM≥15.0 kPa考虑肝硬化,LSM≥11.0 kPa考虑进展期肝纤维化,LSM<10.0 kPa考虑排除肝硬化,LSM<8.0 kPa考虑排除进展期纤维化;LSM处于8.0~11.0 kPa的患者需接受肝活检以明确肝纤维化状态(B2)。酒精性肝病患者LSM≥20.0 kPa考虑肝硬化,LSM<12.5 KPa排除肝硬化,LSM<9.5 kPa排除进展期肝纤维化(C2)。自身免疫性肝炎肝纤维化诊断界值参照ALT<2?ULN的CHB的标准;目前对于PBC尚缺乏可靠诊断界值(C2)。
(2)磁共振弹性成像 (magnetic resonance elastography,MRE):MRE是在MR技术基础上再加入应变声波 (波长)检测系统,从而将组织弹性程度和MR图像相结合的一门新的成像技术,也是近年来肝纤维化无创性诊断技术的研究热点。目前已有研究结果表明,MRE评估肝纤维化具有很高的可信度。Singh等[48]收集12项研究、对697例慢性肝炎患者进行meta分析,显示MRE诊断纤维化≥S1、≥S2、≥S3和S4期的 AUROC 分别为 0.84 (0.76~0.92)、0.88 (0.84~0.91)、0.93(0.90~0.95)和0.92(0.90~0.94),诊断准确性不受患者年龄、性别、肥胖和肝脏炎症活动程度的影响。
与TE技术相比,MRE有其独特的优点[49]:首先它不受采集声窗和检查路径的限制,可扫描整个肝脏,对其进行全面评估,避免了抽样误差;其次实施MRE时还可添加其他MRI技术对腹部脏器进行全方位、一站式检查;再次MRE相对不受患者腹水和肥胖等因素的影响,对操作者依赖性也较低。但MRE的实施需要配备额外的硬件,检查相对耗时,检查费用也较超声高和尚未有统一的不同病因肝纤维化MRE的肝弹性值等,限制了MRE的普及与临床应用。
推荐意见9 MRE是目前对肝纤维化分期诊断效能较高的无创性评估方法,其总体诊断效能优于TE(B1),但尚未建立统一的不同病因肝纤维化MRE肝弹性值。
二、肝纤维化治疗
目前,临床上尚无特异有效的抗肝纤维化治疗方法,主要通过治疗引起肝损伤的基础疾病来缓解肝损伤和炎症,并对肝纤维化进行防治。
(一)治疗目标
肝纤维化治疗旨在阻止或逆转肝纤维化,改善患者的肝脏功能与结构,延缓肝硬化及其失代偿期的发生,改善患者生活质量与延长其生存期[50-51]。
(二)治疗方法
肝纤维化治疗包括肝纤维化病因治疗和抗肝纤维化治疗两个方面。
1.病因治疗:肝纤维化治疗目前最重要的是病因治疗。有效抑制和清除慢性肝炎病毒(HBV和HCV)、药物根除血吸虫感染、解除胆汁淤积或治疗相关的病因、非酒精性脂肪性肝病患者控制体质量及改善相关的代谢紊乱、酒精性肝病患者戒酒、血色病患者进行放血治疗、自身免疫性肝病患者应用激素和免疫抑制剂治疗等,均可减轻肝脏持续损伤,从而促进纤维化肝组织的修复。
临床上关于肝硬化患者病变消退的报道越来越多,近期临床研究的证据支持肝硬化可以逆转的结果令人鼓舞[52]。Marcellin等[53]的随机双盲对照研究结果显示,替诺福韦酯治疗CHB患者,能够实现肝纤维化和肝硬化的逆转,经过5年的替诺福韦酯治疗后,将近四分之三在基线水平肝硬化的HBV感染患者不再出现肝硬化。该研究样本量相对较小、缺乏对照、且第二次肝活检的患者较少。有不少报道提示,一些患者虽有较好的病毒学应答但仍有肝纤维化的存在或进展,相关研究尚需进一步加强。单纯抗病毒治疗不能完全解决病毒性肝炎肝纤维化的问题。
尽管有效的病因治疗可以减缓甚至逆转部分肝纤维化,但仅少部分患者肝硬化可逆转。某些肝病目前缺乏病因治疗方法,如自身免疫性肝炎和PBC等自身免疫性肝病无法消除病因,某些遗传代谢性肝病也不能对因治疗。故病因治疗并不能完全治疗肝纤维化,也未改善肝纤维化患者结局,因此,需要有效的抗肝纤维化治疗[54]。
推荐意见10 治疗肝纤维化的病因是肝纤维化治疗的基础,肝纤维化/部分肝硬化患者经病因治疗后肝纤维化可以逆转(A1)。
2.抗肝纤维化治疗:肝纤维化是肝组织抗损伤的修复过程,早期对肝组织的损伤修复有重要的防御作用。因此,在肝纤维化发生的早期阶段,此时以病因治疗及抗炎保肝治疗为主,进展期和显著肝纤维化期以及肝硬化期时需要进行抗肝纤维化治疗。慢性炎症反应是纤维化形成的前提及进展的驱动力,抑制肝脏炎症、肝细胞保护和抗氧化是抗肝纤维化的重要措施[55-56]。甘草酸类制剂衍生于甘草的主要活性成分甘草酸和甘草甜素,目前,甘草酸类制剂发展到了第四代,代表药物为异甘草酸镁注射液和甘草酸二铵肠溶胶囊。甘草酸类制剂具有类似糖皮质激素的非特异性抗炎作用,而无抑制免疫功能的不良反应,可改善肝脏生物化学指标、肝组织炎症和纤维化[57]。水飞蓟素是提取自水飞蓟的黄酮类物质,在肝脏中具有抗炎和抗纤维化的作用[58]。糖皮质激素可以抑制炎症及免疫反应,多年来用于治疗自身免疫性肝炎。熊去氧胆酸具有抗炎、促进胆汁分泌和抗凋亡的作用,是治疗PBC的主要药物,可以改善肝组织纤维化[59]。奥贝胆酸也有利胆和肝细胞保护作用,增加胰岛素敏感性,调节脂肪代谢,发挥抗炎和抗肝纤维化作用。在NASH临床试验中,奥贝胆酸可明显减轻NASH肝纤维化[60]。多烯磷脂酰胆碱具有抗氧化和抗纤维化双重作用,因酒精性肝病常与氧化应激有关,氧化应激可以导致脂质过氧化、细胞损伤、炎症反应和纤维化,故多烯磷脂酰胆碱在酒精性肝病的治疗中备受关注[61]。这些药物在动物实验中显示有较好的抗肝纤维化作用,但人体研究数据还有限,需待进一步深入研究[54]。
推荐意见11 目前,尚无有效和公认的抗肝纤维化化学药物或生物制剂,肝细胞保护、抗炎、抗氧化及利胆类药可能有一定的治疗作用(C2)。
国内已有一些中成药显示有一定的抗肝纤维化作用,并用于临床治疗。一些研究结果显示可改善肝组织病理学、减少肝硬化静脉曲张出血发生率等。临床上广泛使用的主要有扶正化瘀胶囊(片)[62]、安络化纤丸[63]、复方鳖甲软肝片[64]等。但尚需进一步加强中药产品质量控制,开展更多多中心规范临床研究,尤其是“头对头”比较研究临床结局,如肝纤维化进展、逆转、肝硬化失代偿发生和死亡等,以进一步证实其确切疗效、安全性与作用特点。
推荐意见12 中医中药在抗肝纤维化治疗方面有其独特的功效,加强中药质量控制并开展多中心大型临床研究,有助于进一步确认其疗效和安全性(C2)。
正在研究开发的抗肝纤维化治疗的靶点和试验药物很多,主要的有抵抗肾素-血管紧张素系统的血管紧张素转换酶抑制剂或血管紧张素受体拮抗剂(如厄贝沙坦和洛沙坦)、趋化因子受体CCR2及CCR5双重拮抗剂 (Cenicriviroc)、小分子泛半胱天冬酶抑制剂(Emricasan)、凋亡信号调节激酶1抑制剂(Selonsertib)、瘦素的天然反向调节剂脂联素、PPAR-γ核受体的合成配体噻唑烷二酮类、胰高糖素样肽-1类似物Liraglutide、抑制TGF-β1及可溶性受体拮抗剂或蛋白酶(如羟尼酮)、脯氨酰羟化酶抑制剂、基质金属蛋白酶组织抑制因子-1抗体、松弛素(Serelaxin)、内皮素-1拮抗剂或受体拮抗剂、赖氨酰氧化酶样蛋白2(LOXL2)抗体(GS-6624)、肝细胞保护剂肝细胞核因子1α和4α等[54,65]。这些药物尚在临床前和临床试验阶段,期待着有好的疗效和安全性[53,65]。
三、肝纤维化治疗药物临床开发应用
目前,抗肝纤维化药物开发仍面临很大的挑战,主要是由于肝纤维化的形成过程和机制复杂,影响因素众多,且个体之间存在较大差异,因此,迄今尚无有效的化学药物和生物制剂用于临床治疗。目前,临床试验存在的主要问题有:慢性肝病肝纤维化一般病程较长,临床试验不易将生存获益或临床失代偿事件发生减少作为临床终点;发现新的药物需要时间长(8.5~14.0年)和大量经济投入;现在的抗纤维化药物试验仍需要肝活检判断疗效,亟需理想的生物标志物和影像学检测技术以缩短试验间期和无创性评估等[66-67]。
1.抗肝纤维化药物临床试验患者的选择:确定抗纤维化治疗候选者入选标准是一个复杂的问题,由于NASH目前没有有效的病因治疗药物,目前正在进行或计划进行的大多数临床试验都是针对NASH。选择哪些患者参加临床试验,将主要由候选药物的作用机制决定。例如,在肝硬化形成之前,抗炎药在肝纤维化形成中间阶段可能有效,而促进基质降解的药物在更晚期的纤维化中可能有效。患者分层也将基于肝纤维化进展速率和风险、肝纤维化分期和/或纤维化含量,以及需要考虑患者的年龄、病因、性别、乙醇摄入量、代谢综合征等因素。所以选择显著纤维化、进展期肝纤维化或早期肝硬化(Ishak 3~5期)患者,可能会易于观察到药物的疗效。
2.关于基础治疗及合并用药:在治疗肝纤维化新药临床研究中,要充分考虑到病因治疗对于抑制甚至逆转肝纤维化进程的重要性,应以治疗原发病或去除致病因素为基础,并根据目前肝纤维化及其原发病规范的、公认的治疗原则,制定合理的治疗方案。针对病因的治疗应科学、规范。同时,应充分考虑到基础治疗中不同药物或给药方法对于疾病可能带来的不同影响。因此,在相关新药的研究中,对于目标人群、药物、剂量以及无法耐受或产生耐药后的后续治疗方案等均应有明确、合理的限定,做到固定、统一治疗方案和治疗流程,以尽量消除对于药物疗效分析评价的可能干扰和不利因素。研究结束后,也应充分评估患者基础治疗对于疗效分析的影响。一般认为目前应用的抗炎保肝药物如甘草酸类和水飞蓟素类等药物具有一定的抗肝纤维化作用。新药的临床研究中,对于是否可以合并使用这类药物以及用药的时长应有明确、统一的规定,并应充分考虑到合并使用上述药物对于新药疗效评价可能的混杂影响。同时应详细记录所有伴随用药的通用名、单次服用剂量和单位、服药频率和给药途径、开始和结束日期及给药原因等。
推荐意见13 以治疗原发病或去除致病因素为基础,应选择显著肝纤维化、进展期肝纤维化或早期肝硬化(Ishak 3~5期)患者观察药物的疗效(B1)。
3.对照组设置及对照药物选择:因目前尚无公认有效的肝纤维化治疗化学药物和生物制剂,无“阳性药物”对照,因此,临床研究可设立安慰剂对照。
4.疗程:肝纤维化发生、发展是一个缓慢的过程,其逆转也同样需要较长时间,因此,抗肝纤维化药物治疗给药周期及观察疗程应不少于12个月,或者更长的时间[66-67]。
推荐意见14 抗肝纤维化疗程不少于12个月,或者更长的时间,最好设立安慰剂对照(B1)。
5.主要指标、次要指标及相关要求:疗效确证性试验中,应以肝组织病理学改变作为主要指标进行疗效研究和评价。次要指标可考虑以治疗原发病或去除致病因素为基础,采用肝纤维化血清学相关指标及超声、CT、MRI、TE等检查。进行肝组织病理学研究的病例数应符合统计学要求,临床研究总病例数还应符合相应的法规要求。
6.疗效评估:肝纤维化药物疗效评估最主要和重要的方法是肝活检观察组织病理学变化。主要疗效评估可采用肝纤维化组织病理学半定量方法,建议采用国际公认的Ishak肝纤维化评分系统。治疗后肝纤维化分期下降1期及以上为逆转,增加1期及以上为进展,纤维化无变化且炎症分级不增加为稳定。同时评估肝脏病理学炎症分级、瞬时弹性值及相关的血清生物化学指标等变化。近来有用肝纤维化组织病理学非染色图像定量评估的方法,显示有很好的应用前景[68]。
推荐意见15 肝纤维化药物疗效评估以肝组织病理学为主要指标,采用Ishak评分系统,治疗后肝纤维化分期下降1期及以上为逆转,肝纤维化增加1期及以上为进展,肝纤维化无变化且炎症分级不增加为稳定。抗肝纤维化治疗药物有效率可定义为逆转和稳定的比例(B1)。
7.不良反应观察:对接受了受试药物的所有受试者都要进行安全性评价。停服受试药物、发生不良事件、伴随用药以及实验室检查的数据都要列出并加以总结。注意区别不良事件的严重程度和强度,研究者应对不良事件和研究药物以及合并药之间可能存在的关联作出评估。
四、未满足的要求
1.科学挑战:肝纤维化发病机制的认识有了很大的进步,但仍存在如下一些基本问题尚待阐明:(1)肝脏为什么会再生?(2)肝纤维化和再生之间有什么联系?随着肝纤维化的进展,肝再生能力减弱,控制这两种不同反应的机制和可能关联是什么?(3)在明显肝纤维化和肝硬化时肝癌很易发生,这种关联的潜在机制是什么?(4)干细胞在正常肝、肝纤维化、肝再生和肝癌中起什么作用?(5)肝纤维化与免疫之间以及肝纤维化对肝损伤的保护意义是什么?
2.临床挑战:肝纤维化无创性诊断和有效干预尚不尽人意。肝脏炎症是肝纤维化进展的驱动力,抗炎症和肝细胞保护对肝纤维化进程和作用及地位如何?纤维化过程存在于我们机体的各个组织器官,也是机体的抗损伤修复过程。因此,新药的肝脏靶向性及治疗的时机尚需要积累更多的证据和经验。肝纤维化过程有多种细胞及因子参与,有时单一药物的疗效可能有限,可能需要联合及多靶点尝试治疗。联合治疗首先需要证据证明各个组成部分都有一定的疗效。抗肝纤维化药物疗效、纤维化进展和程度评估仍需要肝活检病理学证据,目前还缺乏相关的无创性标志物及检测方法。以上这些问题均是目前需要努力的方向,期待新的无创性诊断和有效治疗方法问世。
