小麦粒重相关基因TaCYP78A5功能标记开发及验证
2019-11-13司文洁吴林楠郭利建周梦蝶刘香利赵惠贤
司文洁 吴林楠 郭利建 周梦蝶 刘香利,2 马 猛,2,* 赵惠贤,2,*
研究简报
小麦粒重相关基因功能标记开发及验证
司文洁1吴林楠1郭利建1周梦蝶1刘香利1,2马 猛1,2,*赵惠贤1,2,*
1西北农林科技大学生命科学学院, 陕西杨陵 712100;2西北农林科技大学 / 旱区作物逆境生物学国家重点实验室, 陕西杨凌 712100;
为了开发小麦粒重相关基因()的功能标记, 挖掘与千粒重性状相关的优异等位变异, 本研究通过对30份不同品种小麦启动子区测序及比对鉴定, 并根据SNP位点差异开发启动子区功能标记CAPS-5Ap。结果表明, 在30份不同小麦品种中启动子区域出现5个SNP位点差异, 可将30份不同品种小麦分为TaCYP78A5-2Ap-HapI和TaCYP78A5-2Ap-HapII两种单倍型; 以323份现代育成小麦品种验证发现, TaCYP78A5-2Ap-HapI的分布频率为17.96%, TaCYP78A5-2Ap-HapII的分布频率为82.04%, 表明CAPS-5Ap标记可用于小麦启动子序列2种单倍型的鉴定。此外, 关联分析发现, CAPS-5Ap标记与粒重相关, 且TaCYP78A5-2Ap-HapII是提高千粒重的优异单倍型。研究结果为小麦分子标记辅助选择和性状改良提供理论依据。
小麦; 粒重;; SNP; 功能标记
小麦(L)是世界上主要的粮食作物之一, 粒重是小麦产量的主要构成因素, 也是小麦育种中的主要选择性状[1]。粒重相关基因的功能研究和标记开发对小麦性状改良及高产育种具有重要的意义和应用价值。因此, 在小麦中许多粒重相关基因的功能研究被广泛报道。例如, Jiang等[2]克隆得到小麦()基因, 并证明该基因与小麦产量性状相关联, 其在胚乳发育过程中表达量较高; Su等[3]通过同源克隆在小麦中获得水稻()同源基因()基因, 证明该基因对小麦千粒重起负调控作用。Ma等[4]同源克隆得到小麦()的全长cDNA并对其进行QTL分析, 证明其可以解释千粒重4.8%的表型差异。
功能标记(functional marker, FM)是根据功能基因的多态性将基因等位变异与表型性状相关联的一种分子标记, 且开发与特定性状相关联的分子标记是分子标记辅助育种的主要手段[5-6]。SNP-CAPS (cleaved amplified polymorphism sequences, 简称CAPS)分子标记是酶切扩增多态性序列标记技术, 能够快速检测由单碱基变异引起的酶切位点的变化, 广泛应用于植物基因分型、定位、克隆、分子鉴定等[7-8]。针对小麦的基因开发等位基因特异性PCR (AS-PCR)标记, 并通过性状关联分析发现突变位点与籽粒的表型尤其是粒宽和千粒重紧密相关, 其中的CAPS分子标记可作为小麦千粒重的优异功能标记[3]。Zhang等[9]克隆了()基因, 并针对开发CAPS分子标记, 其中能提高小麦每穂的小穗数。
细胞色素P450 (Cytochromes P450, 简称CYP)家族是最大的植物蛋白家族之一, 其中()家族一类可应用于作物改良的基因。在模式植物拟南芥()和水稻()中, 许多家族成员被鉴定出与植物籽粒发育密切相关[10-12]。例如, 拟南芥中,被证实是独立于已知母性遗传之外影响种子大小的基因, 而且其活性高低与种子大小呈正相关[10,13]。水稻中拟南芥的同源基因()编码CYP78A13蛋白, 可调节胚和胚乳之间的平衡, 过表达会导致胚的减小和胚乳的增大, 最终导致水稻种子体积的增大[1,12,14]。在小麦中, 马猛等[15-16]首次通过同源克隆获得和基因, 并利用瞬时沉默和过表达技术揭示表达水平与小麦粒重呈正相关; 陈之忍等[17]研究表明籽粒特异性启动子()驱动的基因在小麦中过表达能够显著增加小麦粒重。以上研究表明基因在影响植物粒重方面具有重要功能, 但关于小麦自然群体中基因是否存在等位基因变异、的等位基因是否与产量性状关联以及基因功能标记开发等方面未见研究报道。
本研究对启动子区进行测序分析, 试图建立基于等位基因多态性位点的分子标记, 并进行等位基因分子标记的实用性验证以及分子标记与小麦千粒重的关联分析; 旨在探索基因应用于小麦高产分子育种的可能性, 挖掘与千粒重关联的优异等位基因, 并开发其功能标记, 为小麦高产、高效分子育种提供新的优异基因及功能标记。
1 材料与方法
1.1 试验材料
353份普通小麦品种中30份来自西北农林科技大学小麦试验田, 用于检测目标基因的核苷酸多态性; 黄淮麦区323份现代育成普通小麦品种由中国农业科学院景蕊莲研究员提供, 用于目标基因单倍型的检测及农艺性状的关联分析。
1.2 小麦总RNA提取与cDNA合成
不同生育期小麦材料(根、茎、叶、旗叶、5 mm、10 mm幼穗、5 d、10 d、15 d、20 d籽粒)来自田间正常管理的普通小麦小偃6号, 利用北京百泰克多糖多酚植物总RNA快速提取试剂盒提取总RNA, 并利用Takara公司反转录试剂盒(Primescript RT reagent kit Perfect Real Time)进行cDNA第1链的合成。
1.3 TaCYP78A5基因时空表达模式分析
以上述已获得的小偃6号不同生育期cDNA为模板, 通过实时荧光定量PCR (quantitative real-time PCR, qRT-PCR)对基因时空表达模式进行分析。上下游引物(A5-A-RT-F/R、A5-B-RT-F/R、A5-D-RT-F/R)序列见表1, PCR体系为2×TB Green Premix 12.5 µL, cDNA 50 ng, Free-water 8.5 µL, 10 µmol L–1的上下游引物各1 µL。反应条件为95℃ 30 s; 95℃ 5 s, 66℃ 30 s, 50个循环。反应完成后绘制95℃ 10 s、65℃ 5 s、95℃ 5 s熔解曲线。所有反应均以内参基因进行归一化处理, 每样品进行3次重复。
1.4 小麦基因组DNA提取
种子萌发后取二叶一心期新鲜叶片, 利用CTAB (Cetyltrimethylammonium Ammonium Bromide)法提取小麦基因组DNA, 以1%琼脂糖凝胶电泳检测其浓度和纯度后于−20℃保存备用。
1.5 TaCYP78A5启动子序列全长扩增和序列分析
根据最新公布的中国春小麦基因组序列数据库IWGSC RefSeq v1.0 (International Wheat Genome Sequencing Consortium 2018)(基因ID分别为TraesCS2A01G175700/TraesCS2B01G201900/TraesCS2 D01G183000)的启动子序列(简称)多态性位点进行分析, 利用Primer Premier 5.0软件设计特异性引物序列, 以上述30份小麦品种(15份大粒品种和15份小粒品种)的基因组DNA为模板进行PCR扩增, 所用引物对分别为A5-Ap-F/R、A5-Bp-F/R 和A5-Dp-F/R (序列见表1)。PCR体系为2×KOD buffer 10 µL, 2 µmol L–1dNTPs 2 µL, KOD 0.5 µL, 10 µmol L–1的上下游引物各0.5 µL, DNA模板100 ng, ddH2O 5.5 µL; 反应条件为95℃ 5 min; 95℃ 30 s, 66℃ 30 s, 72℃ 2 min, 50个循环; 72℃ 10 min。PCR产物经1%的琼脂糖凝胶电泳检测后送西安擎科生物泽西生物科技有限公司测序; 并利用PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线软件预测和分析其在序列的顺式作用元件进行。

表1 用于TaCYP78A5分析的引物
1.6 30份小麦品种间TaCYP78A5启动子序列测序分析及SNP位点筛选
将30份小麦品种基因启动子序列全长的PCR产物送至西安擎科生物泽西生物科技有限公司测序, 将测序结果与最新中国春小麦基因组序列数据库IWGSC中序列通过DNAMAN8.0 (https://www.lynnon.com/pc/framepc.html)软件比对分析, 分别获得30份小麦品种在序列区间内的SNP位点。
1.7 SNP-CAPS标记的开发
为了将不同品种间的SNP位点转化为SNP-CAPS分子标记, 采用二次PCR扩增。将得到的序列利用Primer premier 5.0软件查找多态性位点, 将其转化为CAPS分子标记位点。利用Primer premier 5.0软件在候选CAPS标记位点两侧设计PCR特异性引物CAPS-A5-Ap-F/R (表1)进行扩增, DNA模板为稀释100倍的序列全长PCR产物, PCR体系为2×KOD buffer 10 µL, 2 µmol L–1dNTPs 2 µL, KOD 0.5 µL, 10 µmol L–1的上下游引物各0.5 µL, DNA模板2 µL, ddH2O 4.5 µL。反应条件为95℃ 5 min; 95℃ 30 s, 72℃ 30 s, 72℃ 15 s, 45个循环; 72℃ 10 min。PCR产物经1%琼脂糖凝胶电泳检测。
1.8 酶切分析及验证
根据成功转化为CAPS-5Ap标记的SNP位点, 选择合适的限制性酶进行酶切反应, 酶切反应体系为10×NEB buffer 2 µL, 限制性内切酶I0.4 µL, PCR产物18 µL。37℃酶切2.5 h, 其中I购自NEB公司, 用4.5%琼脂糖凝胶电泳检测酶切产物。
1.9 性状-标记关联分析
为进一步分析CAPS-5Ap标记的实用性, 以2017年收获的黄淮麦区323份现代育成普通小麦品种为材料进行扫描, 并利用Microsoft Excel软件进行千粒重数据统计和分析; 利用TASSEL 2.1软件中的普通线性模型(GLM)将开发的CAPS-5Ap分子标记与323份普通小麦品种的千粒重进行关联分析。其中, 323份普通小麦品种的千粒重表型数据, 以及单倍型与小麦千粒重关联分析由中国农科院景蕊莲研究员课题组提供。
2 结果与分析
2.1 TaCYP78A5基因时空表达模式分析
前期研究表明, 小麦中基因含有3个直系同源基因, 分别位于2A2B和2D染色短臂, 被命名为、、[15]。利用小偃6号不同生育期、不同部位(根、茎、叶、旗叶、5 mm和10 mm幼穗以及花后5、10、15、20 d籽粒)样品时空表达模式分析发现,基因在小麦各个部位均有表达, 且在幼穗发育阶段表达量较高; 其中在各个部位表达量最高,次之(图1)。

图1 TaCYP78A5-2A/2B/2D基因表达模式
R: 根; S: 茎; L: 叶; FL: 旗叶; YS5: 5 mm的幼穗; YS15: 15 mm的幼穗; GR5、GR10、GR15和GR20分别表示花后5、10、15和20 d的籽粒。
R: root; S: stem; L: leaf; FL: flag leaf; YS5: 5 mm young panicles; YS15: 15 mm young panicles; GR5, GR10, GR15, and GR20: grain at 5 days, grain at 10 days, grain at 15 days and grain at 20 days after flowering.
2.2 TaCYP78A5启动子全长序列扩增和序列分析
为了进一步了解-不同亚基因组间差异表达的根源, 在小偃6号小麦品种中对启动子区进行全长扩增和序列分析, 扩增获得基因启动子3个亚基因组序列信息, 其中序列长度为1800 bp序列长度为1500 bp,序列长度为1810 bp。基因序列起始密码子前1500 bp序列比对结果表明序列内存在较大差异(附图1)。进一步对序列内的作用元件分析显示, 在的−1500 bp序列内除共同含有CAAT-box和TATA-box基本顺式作用元件外, 还含有激素响应元件ABRE、GC-motif、P-boxTGA-element等和逆境响应元件; 以及特有元件CAT-box和AT-rich sequence,特有元件GCN4_motif和TCA- element (表2)。特别是序列内特有的在分生组织表达的顺式作用元件CAT-box, 可能是引起在根部和幼穗期表达量较高的原因。因此, 这些启动子序列和调控元件的差异可能是导致基因的3个直系同源基因间表达量巨大差异的根源。
2.3 30份小麦品种间TaCYP78A5启动子SNP位点识别和筛选
与中国春小麦基因组序列数据库IWGSC RefSeq v1.0比对显示, 在30份小麦品种间序列共存在5个SNP位点, 分别位于−1292、−1203、−596、−594和−435 bp (图2)。而序列区间内不存在有规律的SNP位点,序列区间内存在2个SNP位点。因此, 后续只对不同小麦品种间等位基因序列进行SNP变异分析和分子标记开发。
对30份小麦品种单倍型分析发现, 5个SNP位点差异在30份品种间组成2种等位基因差异类型, 分别为单倍型TaCYP78A5-2Ap-HapI (C/C/C/A/G)和单倍型TaCYP78A5-2Ap-HapII (T/T/A/G/A)。

表2 TaCYP78A5-2Ap/2Bp/2Dp序列顺式作用元件预测
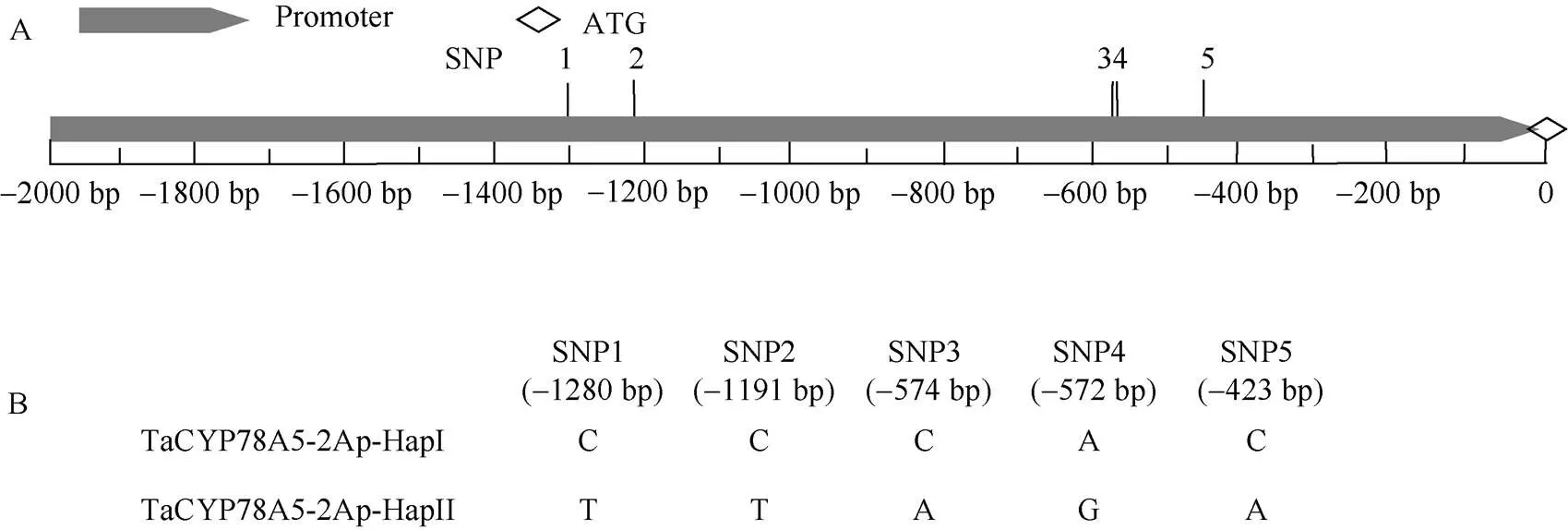
图2 TaCYP78A5-2Ap序列结构和等位基因多态性分析
A:序列结构; B:序列多态性和等位基因变异分析。
A: structure of; B: polymorphism and allelic variation analysisof
2.4 TaCYP78A5-Ap的 SNP-CAPS标记的开发
通过对两种单倍型TaCYP78A5- 2Ap-HapI和TaCYP78A5-2Ap-HapII序列间差异分析, 发现TaCYP78A5-2Ap-HapI在−1203 bp (SNP2)存在特异性酶(I)酶切位点, 而TaCYP78A5-2Ap-HapII对应位点不存在I的酶切位点; 因此, 根据标记的酶切产物大小可以区分的两种单倍型。
通过在–1203 bp位点上下游设计引物CAPS-A5-Ap- F/R进行二次PCR扩增, 开发SNP-CAPS标记CAPS-5Ap, 并根据标记的酶切产物大小区分的2种基因类型, 若酶切产物为170 bp和140 bp的2条带, 则待测小麦单倍型为TaCYP78A5-2Ap-HapI; 若酶切产物为310 bp的一条带, 则待测小麦单倍型为TaCYP78A5- 2Ap-HapII。
2.5 SNP-CAPS标记的验证
在上述30份小麦品种间对SNP-CAPS标记CAPS- 5Ap检测发现, 其中7份品种能够被I酶切识别, 属于TaCYP78A5-2Ap-HapI单倍型; 其余23份品种均不能被I酶切识别, 属于TaCYP78A5-2Ap-HapII单倍型(图3)。酶切结果与测序结果一致, 表明针对该位点(SNP2)开发的CAPS-5Ap标记能有效鉴别的2种单倍型。
为了进一步验证CAPS-5Ap标记在不同地区栽培小麦品种中的实用性, 将开发的CAPS-5Ap标记在323份现代育成小麦品种间进行扫描验证。酶切表明, 323份现代育成品种的序列均能够被I酶酶切产生与上述30品种相同的2种单倍型类型, 部分品种酶切结果如图4所示。在323份现代育成品种中共有58份品种属于TaCYP78A5-2Ap-HapI类型, 分布频率为17.96%; 265份品种属于TaCYP78A5-2Ap-HapII类型, 分布频率为82.04% (图5), 323份现代育成品种中的单倍型类型统计情况见附表1。以上结果表明CAPS-5Ap标记可用于鉴别不同地区栽培小麦品种中序列的2种单倍型。

图3 TaCYP78A5-2Ap分子标记的开发
M: 20 bp DNA ladder; I/II:的2种单倍型; I: TaCYP78A5-2Ap-HapI; II: TaCYP78A5-2Ap-HapII。
M: 20 bp DNA ladder; I/II: two genotypes of; I: TaCYP78A5-2Ap-HapI; II: TaCYP78A5-2Ap-HapII.

图4 323份现代育成小麦品种TaCYP78A5-2Ap单倍型扫描验证
M: 20 bp DNA ladder; I/II:的2种单倍型; I: TaCYP78A5-2Ap-HapI; II: TaCYP78A5-2Ap-HapII。
M: 20 bp DNA ladder; I/II: two haploidtypes of; I: TaCYP78A5-2Ap-HapI; II: TaCYP78A5-2Ap-HapII.
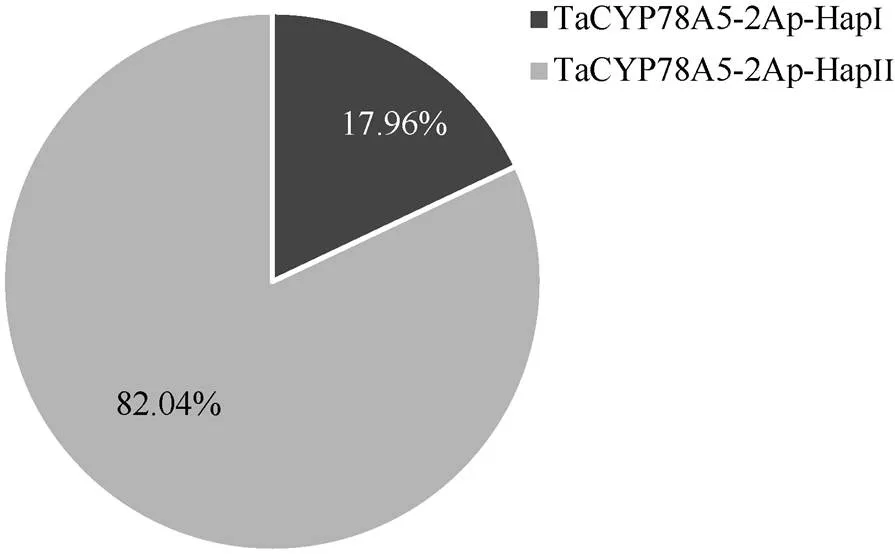
图5 323份现代育成小麦品种中TaCYP78A5-2Ap两种单倍型的分布频率
TaCYP78A5-2Ap-HapI/II:启动子的2种单倍型。
TaCYP78A5-2Ap-HapI/II: two haploidtypes forpromoter.
2.6 籽粒性状-分子标记的关联分析
对323份小麦品种的单倍型数据与千粒重表型数据进行性状-标记的关联分析显示, TaCYP78A5-2Ap-HapI单倍型和TaCYP78A5-2Ap-HapII单倍型对应小麦品种的平均千粒重存在极显著差异(<0.01); 其中, 单倍型TaCYP78A5-2Ap-HapII小麦品种的平均千粒重显著高于单倍型TaCYP78A5-2Ap-HapI (图6)。这表明不同单倍型对千粒重的贡献存在极显著差异, 暗示着CAPS-5Ap标记是与粒重相关的功能标记; 单倍型TaCYP78A5-2Ap-HapII是提高千粒重的优异单倍型。
3 讨论
小麦产量的提高一直是小麦育种工作不断追求的重要目标。目前, 已有不少籽粒大小相关基因被克隆并开发了其功能标记, 如[2]、[3]、[4]、[19]、[20]等。近年来, 植物特异的家族的部分成员[10]、[12]、[14]、[21]等被证实参与植物生殖器官及种子的发育, 暗示着家族基因可用于作物产量性状的改良。本课题组马猛等利用同源克隆技术获得和两个基因, 并证实这两个基因均可影响籽粒大小[15-16]。因此, 本研究通过检测黄淮麦区323份现代育成小麦品种的3个直系同源基因的等位基因, 并开发了其CAPS-5Ap功能标记; 该研究结果将为小麦高产、高效分子育种提供新优异基因和功能标记。
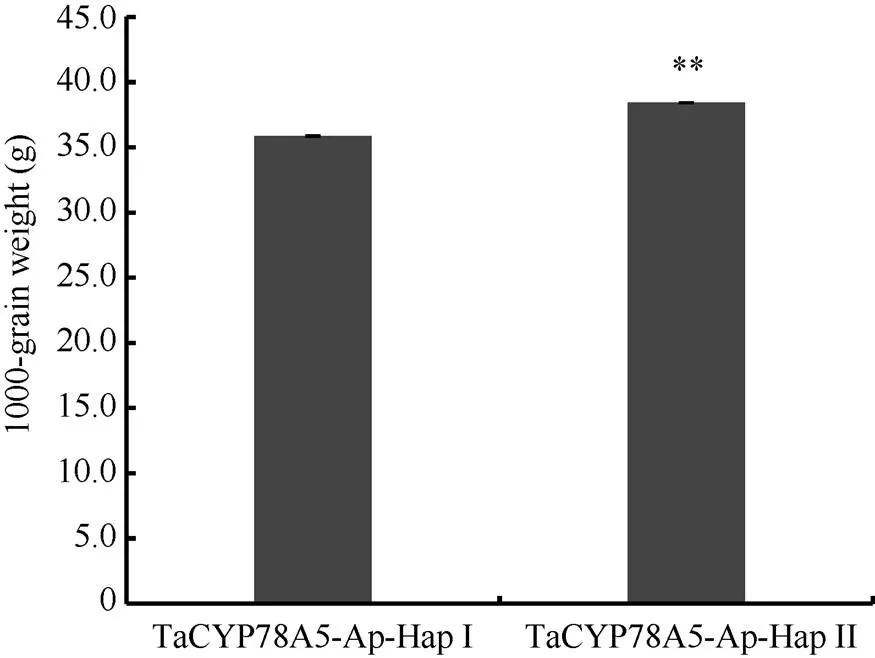
图6 323份现代育成小麦品种中TaCYP78A5-2Ap两种单倍型与千粒重的方差分析
-HapI/II:启动子的两种单倍型; **<0.01; 误差显示为±SE。
-HapI/II: Two haploidtypes forpromoter; **<0.01; Error bars denote ±SE.
分子标记辅助选择是现代分子育种的主要手段, 它通过对单倍型的直接、快速选择进行分子育种。因此, 基于已知功能基因开发其与产量性状相关的功能标记, 对未来的分子育种至关重要。Jiang等[2]针对开发功能标记和, 并通过关联分析方法证明是影响千粒重的优异单倍型。Ma等[4]根据的等位变异位点开发了与粒重相关的功能标记和。相吉山等[22]利用新疆小麦品种资源进一步证实的功能标记、能够较好地区分小麦千粒重的大小, 可用于粒重的分子标记辅助选择。本研究首次通过对不同品种序列多态性位点分析, 开发了等位基因功能标记CAPS-5Ap; 将CAPS-5Ap标记在黄淮麦区323份小麦品种间扫描验证表明, CAPS-5Ap标记可将323份小麦品种分为TaCYP78A5-2Ap-HapI和TaCYP78A5-2Ap-HapII两种单倍型。进一步的关联分析发现, TaCYP78A5-2Ap- HapII单倍型小麦品种的千粒重均极显著高于TaCYP78A5-2Ap-HapI, 表明TaCYP78A5-2Ap-HapII是提高千粒重的优异单倍型; TaCYP78A5-2Ap-HapII类型可用于小麦粒重的分子标记辅助选择。
本研究是基于不同小麦品种间序列上多个SNP位点组成的单倍型为单位的结果; 后期计划进一步研究各单倍型的单一SNP位点对基因表达水平的影响, 以期了解SNP位点差异对基因表达水平, 乃至对籽粒大小和产量的影响。
附图和附表 请见网络版: 1) 本刊网站http://zwxb.chinacrops.org/; 2) 中国知网http://www.cnki.net/; 3) 万方数据http://c.wanfangdata.com.cn/Periodical-zuowxb.aspx。
[1] Xu F, Fang J, Ou S J, Gao S P, Zhang F X, Du L, Xiao Y H, Wang H R, Sun X H, Chu J F, Wang G D, Chu C C. Variations incoding region influence grain size and yield in rice, 2015, 38: 800–811.
[2] Jiang Q Y, Hou J, Hao C Y, Wang L F, Ge H M, Dong Y S, Zhang X Y. The wheat (.) sucrose synthase 2 gene () active in endosperm development is associated with yield traits, 2011, 11: 49–61.
[3] Su Z Q, Hao C Y, Wang L F, Dong Y C, Zhang X Y. Identification and development of a functional marker ofassociated with grain weight in bread wheat (L.), 2011, 122: 211–223.
[4] Ma D Y, Yan J, He Z H, Wu L, Xia X C. Characterization of a cell wall invertase geneon common wheat chromosome 2A and development of functional markers, 2012, 29: 43–52.
[5] Andersen J R, Lubberstedt T. Functional markers in plants, 2003, 8: 554–560.
[6] Gupta P K, Rustgi S. Molecular markers from the transcribed/expressed region of the genome in higher plants, 2004, 4: 139–62.
[7] Michaels S D, Amasino R M. A robust method for detecting single-nucleotide changes as polymorphic markers by PCR, 1998, 14: 381–385.
[8] 束永俊, 李勇, 朱振雷, 朱延明. 大豆CAPS标记快速开发方法的建立与优化东北农业大学学报, 2009, 40: 62–65. Shu Y J, Li Y, Zhu Z L, Zhu Y M. Establishment and optimization of the rapid method to develop soybean CAPS molecular markers., 2009, 40: 62–65 (in Chinese with English abstract).
[9] Zhang B, Xu W N, Liu X, Mao X G, Li A, Wang J Y, Chang X P, Zhang X Y, Jing R L. Functional conservation and divergence among homoeologs ofand, two SBP-box genes governing yield-related traits in hexaploid wheat, 2017, 174: 1177–1191.
[10] Adamski N M, Anastasiou E, Eriksson S, O’Neill C M, Lenhard M. Local maternal control of seed size by-dependent growth signaling, 2009, 106: 20115–20120.
[11] Fang W J, Wang Z B, Cui R F, Li J, Li Y H. Maternal control of seed size byin., 2012, 70: 929–939.
[12] Nagasawa N, Hibara K I, Heppard E P, Vander Velden K A, Luck S, Beatty M, Nagato Y, Sakai H.encodes CYP78A13, required for proper size balance between embryo and endosperm in rice, 2013, 75: 592–605.
[13] Eriksson S, Stransfeld L, Adamski N M, Breuninger H, Lenhard M.-dependent growth signaling coordinates floral organ growth in Arabidopsis., 2010, 20: 527–532.
[14] Yang W B, Gao M J, Yin X, Liu J Y, Xu Y H, Zeng L J, Li Q, Zhang S B, Wang J M, Zhang X M, He Z H. Control of rice embryo development, shoot apical meristem maintenance, and grain yield by a novel cytochrome P450, 2013, 6: 1945–1960.
[15] Ma M, Zhao H X, Li Z J, Hu S W, Song W N, Liu X L.regulates seed size in wheat (), 2016, 67: 1397–1410.
[16] Ma M, Wang Q, Li Z J, Cheng H H, Li Z J, Liu X L, Song W N, Appels R, Zhao H X. Expression of, a gene encoding cytochrome P450 CYP78A3 protein in wheat (L.), affects seed size, 2015, 83: 312–325.
[17] 陈之忍, 马猛, 申玉霞, 吴林楠, 刘香利, 赵惠贤.基因过表达小麦的遗传和功能初步分析麦类作物学报, 2017, 37: 721–729. Chen Z R, Ma M, Shen Y X, Wu L N, Liu X L, Zhao H X. Geneticand functional analysis of transgenic wheat overexpressinggene., 2017, 37: 721–729 (in Chinese with English abstract).
[18] 吴林楠, 司文洁, 郭利建, 张亚婷, 赵惠贤, 刘香利, 马猛. 小麦粒重相关基因的克隆和CAPS标记开发农业生物技术学报, 2018, 26: 1659–1669. Wu L N, Si W J, Guo L J, Zhang Y T, Zhao H X, Liu X L, Ma M. Cloning and CAPS marker development of seed weight-related genein wheat ()., 2018, 26: 1659–1669 (in Chinese with English abstract).
[19] Zhang Y J, Liu J D, Xia X C, He Z H., an ortholog of rice, is associated with grain weight and grain length in common wheat, 2014, 34: 1097–1107.
[20] Guo Y, Sun J, Zhang G, Wang Y, Kong F, Zhao Y, Li S. Haplotype, molecular marker and phenotype effects associated with mineral nutrient and grain size traits ofin wheat, 2013, 154: 119–125.
[21] Sotelosilveira M, Cucinotta M, Chauvin A L, Montes R A C, Colombo L, Marschmartínez N, Folter S D. Cytochrome P450is involved in arabidopsis reproductive development, 2013, 162: 779–799.
[22] 相吉山, 穆培源, 桑伟, 聂迎彬, 徐红军, 庄丽, 崔凤娟, 韩新年, 邹波. 小麦粒重基因功能标记、的验证及应用中国农业科学, 2014, 47: 2671–2709. Xiang J S, Mu P Y, Sang W, Nie Y B, Xu H J, Zhuang L, Cui F J, Han X N, Zou B. Validation and application of function markersandofgene related to wheat kernel weight., 2014, 47: 2671–2709 (in Chinese with English abstract).
Development and validation of the functional marker of grain weight-related genein wheat (L.)
SI Wen-Jie1, WU Lin-Nan1, GUO Li-Jian1, ZHOU Meng-Die1, LIU Xiang-Li1,2, MA Meng1,2,*, and ZHAO Hui-Xian1,2,*
1College of Life Science, Northwest A&F University, Yangling 712100, Shaanxi, China;2State Key Laboratory of Crop Stress Biology for Arid Areas / Northwest A&F University, Yangling 712100, Shaanxi, China
In order to develop the functional marker of wheat grain weight related gene() and excavate superior alleles for 1000-grain weight, functional marker CAPS-5Ap was developed according to the different SNP loci ofby analyzing thepromoter sequence of 30 wheat varieties and alignment evaluation. There were five SNP loci inpromoter regions of 30 wheat varieties, which could be divided into two kinds of genotype,TaCYP78A5-2Ap-HapIand TaCYP78A5-2Ap-HapII. The frequency of TaCYP78A5-2Ap-HapI and TaCYP78A5-2Ap-HapII in 323 modern varieties of wheat was 17.96% and 82.04% respectively, which indicating that the CAPS-5Ap can be used to identify two genotypes ofpromoter sequence in wheat. What's more, the correlation between the genotype data and 1000-grain weight phenotype data of 323 modern varieties was analyzed, showing that CAPS-5Ap marker associated with grain weight, andTaCYP78A5-2Ap-HapII was the superior genotype for 1000-grain weight. These results may provide useful information for molecular marker assisted selection and character improvement in breeding for high yield wheat.
wheat; grain weight;;SNP; functional marker
本研究由陕西杨凌示范区产学研用协同创新重大项目计划(2017CXY-01)和国家自然科学基金项目(31701419, 31471482)资助。
This study was supported by the Collaborative Innovation Major Project (2017CXY-01) of the Production and Research Institute of Shaanxi Yangling Demonstration Zone and the National Natural Science Foundation of China (31701419, 31471482).
马猛, E-mail: dik725@163.com; 赵惠贤, E-mail: hxzhao212@nwafu.edu.cn
E-mail: wenjiesi2016@126.com; dik725@163.com
2019-02-17;
2019-06-12;
2019-07-08.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20190705.1252.004.html
10.3724/SP.J.1006.2019.91016
