基于UPLC-QTOF/MS的小麦发芽代谢组学分析方法
2019-11-13王丽娜王步军
王丽娜 王步军
研究简报
基于UPLC-QTOF/MS的小麦发芽代谢组学分析方法
王丽娜 王步军*
中国农业科学院作物科学研究所 / 农业农村部谷物品质监督检验测试中心, 北京 100081
为探究不同提取方法对发芽小麦代谢物提取效果的影响, 本研究建立了基于超高效液相色谱-四级杆飞行时间质谱(UPLC-QTOF/MS)的发芽小麦非靶向代谢组学样品前处理方法和分析方法, 以发芽2 d周麦26籽粒为材料, 设计提取溶剂、提取方式、提取时间3个因素在3个水平上L9(34)正交试验, 并通过主成分分析和聚类分析确定提取效果最佳的组合。以80%乙腈(0.1%甲酸)震摇提取30 min可检测出1609个代谢峰, 说明提取溶剂对代谢物提取效果起主要作用。共鉴定出92种小麦代谢物。
代谢组学; 小麦; UPLC-QTOF/MS; 提取方法; 提取溶剂; 正交试验
代谢组学通过大量代谢组分的定性、定量分析来研究生物体的代谢型与基因型的关系, 系统诠释生物体的整体代谢情况[1-2], 是基因组学和蛋白质组学的延伸和发展。代谢组学主要分为靶向和非靶向2种, 靶向代谢组学即对目标代谢物进行监测, 而非靶向代谢组学是无偏向性分析方法, 试图覆盖尽可能多的代谢物。在代谢组学研究中, 样品的制备是最容易引入系统误差的一步[3], 但目前关于系统评估非靶向代谢组学样品制备程序的研究较少, 已报道的研究主要集中在人血浆[4]、血清[5]、小鼠肝组织[6]、部分微生物[7]、植物[8-10]等方面。
样品制备中的代谢物提取是至关重要的步骤, 在很大程度上影响代谢物提取的数量[11], 影响可检测的代谢物范围[12]。代谢物常用无机溶剂(水)和有机溶剂(甲醇[5]、乙腈[13-14]等)分别提取, 有机溶剂水溶液的代谢物提取率好于绝对有机溶剂[15]。包雨卓等[16]利用甲醇︰水= 3︰1 (v︰v)的水溶液提取冬小麦的代谢物, 分析其在不同温度下的代谢差异; Yang等[17]利用0.3 mL甲醇和0.1 mL氯仿混合提取受盐碱胁迫小麦中的代谢物; 张月等[18]在研究小麦粉中氯啶菌酯残留实验中用到的提取剂为乙腈︰水= 4︰1 (v︰v); Beccari等[19-20]在感染镰刀菌枯萎病小麦产生次级代谢物的2篇研究中, 均用到乙腈︰水︰乙酸= 79︰20︰1 (v︰v︰v)的混合提取剂。
样品制备过程复杂、繁琐, 代谢物提取手段、提取时间及实验者的实验操作等因素同样会影响样品的制备水平[3,10]。胡贲等[21]优化了基于UHPLC-QTOF/MS的烟草代谢组学分析方法, 以影响提取效果的溶剂、提取方式、提取时间、提取温度4个因素为研究对象, 确定甲醇(含0.1%甲酸)在4℃震摇提取20 min效果最好。Ruben等[12]在拟南芥代谢组学研究中, 比较了球磨机、研钵、高速分散机、超声粉碎机、恒温均质仪5种提取方法, 发现高速分散机能提取更多代谢物, 而研钵研磨具有最佳工艺效果。Kye等[22]认为提取溶剂特性、溶剂与样品的比例、提取时间和温度都会影响代谢物提取效果; 当提取效果不佳时, 可通过多次溶剂提取、增加提取时间并辅助提高温度和超声波处理来提高提取效率, 但Ruben等[12]认为反复溶剂提取对提取效果影响不大。甲酸的加入有利于提高代谢物的溶解度, 使提取更易进行[10]。
在本研究中, 采用超高效液相色谱-四级杆串联飞行时间质谱(UPLC-QTOF/MS)分析提取溶剂、提取方式、提取时间三种因素对发芽小麦代谢物提取效果的影响, 以代谢物检出峰数目作为评定标准[5,12,21], 选择适宜的提取方法, 旨在为小麦代谢组学研究提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为半冬性小麦周麦26。取大小均匀、籽粒饱满的小麦种子, 以1%次氯酸钠表面灭菌5 min, 放在培养皿湿滤纸上, 加入适量蒸馏水, 盖上纱布, 放置在30℃、暗环境、47%湿度的恒温恒湿培养箱发芽培养, 不同发芽阶段(0、24、48和72 h)取样, 样品保存于–80℃冰箱, 待用。
1.2 正交试验设计
选择提取溶剂、提取方式、提取时间3个因素, 设计每个因素3个水平(表1)。因本研究为多因素多水平试验, 全面试验组合过多, 不易操作, 所以采用正交试验设计方法, 从全部水平组合中挑选部分有代表的水平组合进行试验, 通过这部分水平组合分析全面试验的情况, 找出最优的水平组合[23]。参考L9(34)正交试验表设计的处理组合, 详见表2。
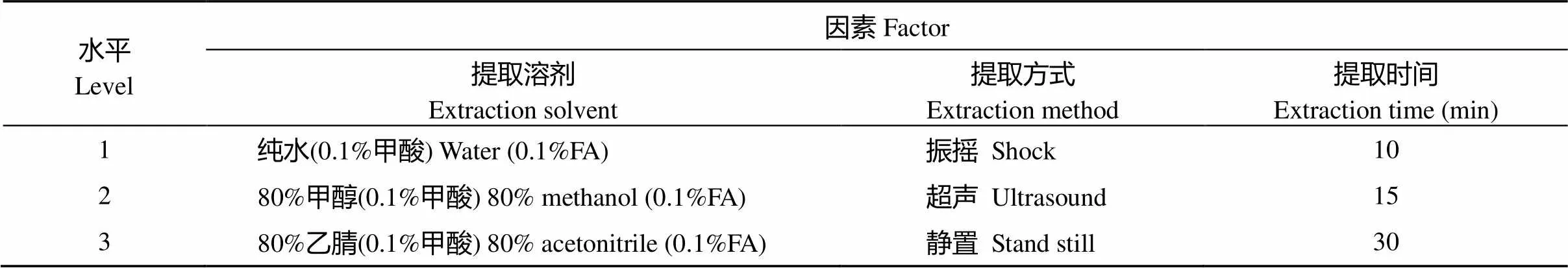
表1 正交试验因素与水平
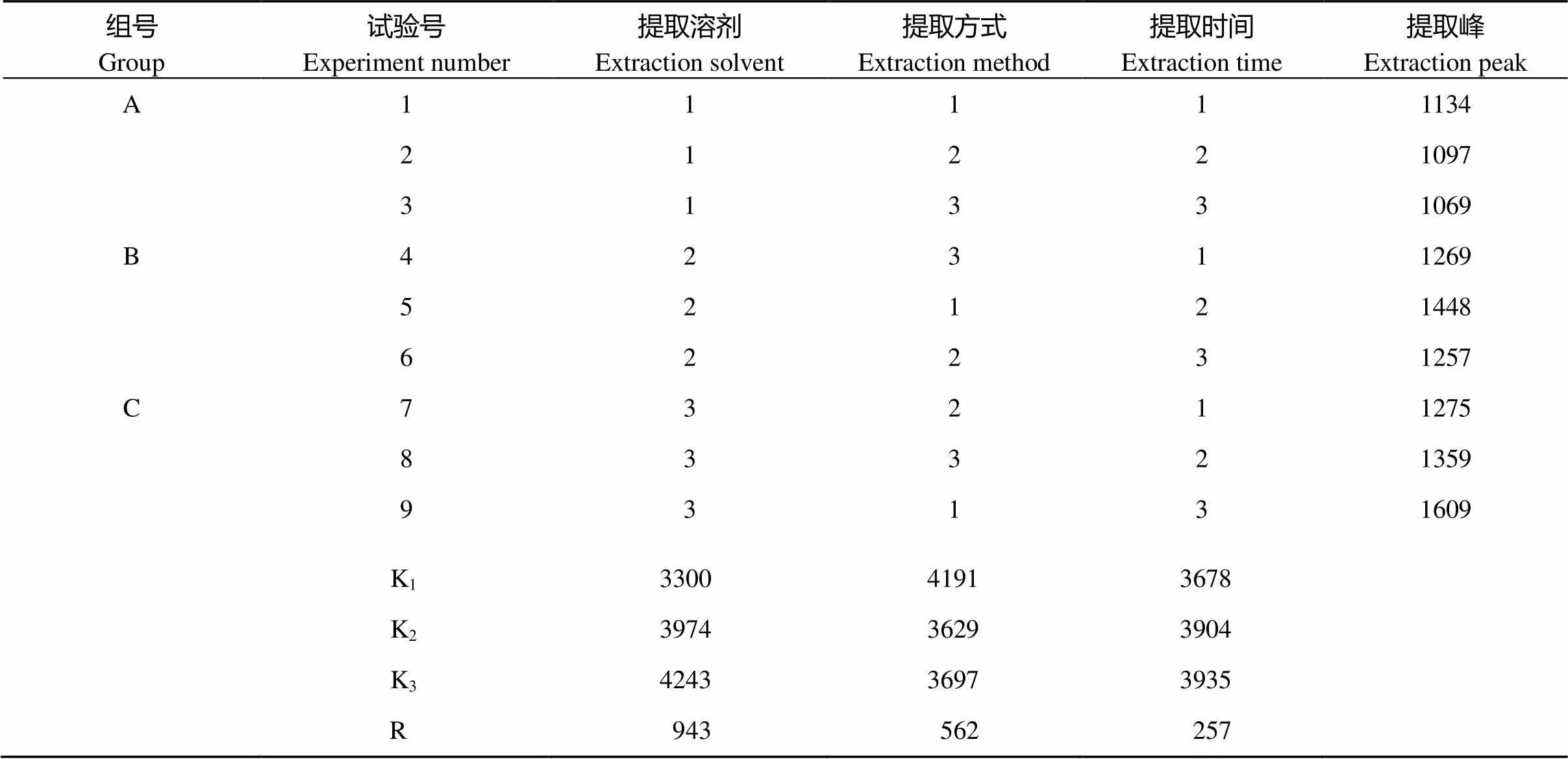
表2 正交试验结果
1.3 样品前处理
将发芽48 h的小麦样品从–80℃取出后, 放入装有液氮的保温桶临时保存, 在预冷的研钵内加入液氮研磨样品成粉末。从每个处理取100 mg样品置10 mL离心管内, 在不同处理组合下提取发芽小麦代谢物。在11,180´、4℃条件下离心10 min, 取上清液1 mL于进样小瓶, 另取每个样品100mL均匀混合成QC (混合质量控制组样品, Quality Control)样品, 待UPLC-QTOF/MS检测。
1.4 色谱质谱分析条件
1.4.1 色谱条件 采用Acquity UPLC BEH C18色谱柱(2.1 mm´100.0 mm, 1.7mm); 流动相A为乙腈, 流动相B为水(含0.1%甲酸); UPLC梯度洗脱程序为2% A (0~1 min), 2%~40% A (1~5 min), 40%~70% A (5~12 min), 70%~95% A (12~15 min), 95% A (15~20 min); 流速为0.4 mL min–1; 样品室温度为10℃; 进样量为1mL。
1.4.2 质谱条件 采用电喷离子源(electrospray ionization, ESI), MSE模式扫描, 亮氨酸脑啡肽作为校正液, 质量范围50~1000 m/z, 毛细管电压3.5 kV, 锥孔电压40 V, 低能电压4 V, 高能电压20~40 V, 离子源温度120℃, 脱溶剂温度400℃, 扫描时间0.2 s。
1.5 数据处理
采用UNIFI软件采集原始质谱图, 将采集的原始数据导入Progenesis QI软件进行峰提取、峰对齐、峰识别和归一化等处理, 选择QC-8样品作为参照校正峰对数据进行标准化处理。依据代谢物分子量、保留时间[8,24]、碎片离子等信息与在线数据库进行化合物的匹配鉴定, 筛选母体误差0.005 Da, 碎片离子误差10 mg L–1的化合物。采用Progenesis QI内部Ezinfo软件对数据进行无监督的主成分分析(PCA), 从整体上分析不同处理组间差异。使用MeV 4.9.0软件进行各代谢物平均丰度的聚类分析(HCA)。
2 结果与分析
2.1 小麦代谢物检测分析
对QC样品进行代谢物轮廓分析, ESI正离子模式下共提取出4113个峰, 借助Waters公司的CCS (碰撞截面积)数据库进行代谢物信息比对, 在不同处理中鉴定了92种代谢物, 涵盖糖类、有机酸、氨基酸、脂类和胺类等化合物。TIC (总离子流图, total ion chromatogram)显示QC样品的峰形重现性良好, 表明系统较稳定(附图1)。ESI负离子模式下代谢物响应较低, 化合物涵盖范围较小, 与已有报道情况相同[21,25], 故本研究不做讨论。
2.2 正交试验结果分析
由表2正交试验结果极差分析可以看出, 影响发芽小麦代谢物提取峰数量的因素为A>B>C, 即提取溶剂>提取方式>提取时间。根据提取峰数量与图1单因素对峰提取的影响可确认最佳的提取方法组合为A3B1C3, 即80%乙腈(0.1%甲酸), 振摇30 min提取发芽小麦代谢物。
2.3 多变量数据统计分析
PCA得分图结果如图2所示, 9个处理的3次重复在得分图中分布较集中, 表明每个处理内差异较小, 本次实验的稳定性比较好。根据每个处理在PCA图里的分布特点, 可将9个处理分为X (处理1、处理2、处理3)、Y (处理4、处理5)、Z (处理6、处理7、处理8、处理9) 3组, 与提取溶剂因素分组相似, 说明小麦代谢物提取效果受提取溶剂的影响大于提取方式和提取时间, 结果与极差分析相符。X组为无机相提取剂, 在t[2]轴上与Y、Z组分离明显; B、C组兼顾有机相和无机相提取剂, 在t[1]轴上分离明显。PCA得分图分析结合表2的不同处理正交试验结果, 认为处理9在提取代谢物涵盖范围上优势明显, 是发芽小麦代谢物提取的最佳组合。
代谢物丰度聚类热图况反映代谢物的相对含量, 丰度越高, 代谢物相对含量越高(附图2)。根据丰度差异, 可将代谢物分为6个簇(Cluster), 代谢物含量越低, 颜色越绿; 含量越高, 颜色越红。簇1包含海藻糖、蜜二糖等5种糖类化合物; 簇2包含壬二酸、D-苹果酸、二羟基富马酸等13种有机酸; 簇3包含亮氨酸、酪氨酸、苯丙氨酸等16种氨基酸; 簇4包含甜菜碱、苯乙胺等7种胺类代谢物; 簇5包含肉豆蔻酸、棕榈酸等38种脂类代谢物; 簇6包含腺嘌呤、乙偶姻、维生素B2、维生素C等13种其他代谢物。从热图分析可以看出, 簇2有机酸类代谢物在B、C处理组的检出含量高于A处理组, 簇5脂类代谢物有相似的检出特点, 表明B、C组的提取剂对这两类代谢物有较好的覆盖率; 簇1糖类代谢物在C处理组的检出含量高于A、B两组, 说明80%乙腈(0.1%甲酸)提取糖类代谢物效果更优。簇3、簇4、簇6部分代谢物的检出情况与上述三簇相同。综合上述情况, 认为处理组C在代谢物检出丰度上更有优势, 能覆盖更多代谢物, 提取效果具有明显优势。

图1 单因素对峰提取的影响

图2 不同处理PCA分析
2.4 不同提取方法的代谢物检出情况
已鉴定的代谢物检出情况(附表1)表明代谢物对提取剂有一定的偏向性。保留时间长的代谢物亲水性不强, A组提取剂仅为无机相纯水(0.1%甲酸), 在保留时间长的大部分脂类等代谢物的检出上表现较差, 水相制备的代谢物主要集中在早期保留时间和小m/z部分; B、C组有机无机混合提取剂不仅能涵盖部分亲水性代谢物, 还能检出大部分亲脂性代谢物, 弥补纯无机相提取的不足。
3 讨论
样品的采集与制备不仅是代谢组学研究的第一步[26], 也是最容易引入系统误差的一步[3], 样品制备主要有样品取样、匀浆、提取和保存等步骤[27]。本研究采用正交试验设计方法优化发芽小麦代谢物提取条件, 极差处理发现提取溶剂为影响小麦代谢物提取的主要因素, 这与已有的研究结果相似[21,24]。本研究的9个处理在PCA图中的分布特点进一步验证了这一结果, 同一提取溶剂的3个处理在PCA散点图中分布较接近, 相似性更高[28], 表明提取溶剂对9个处理的分组趋势影响更大, 提取方式与提取时间的影响较小。提取溶剂对代谢物的检出有一定的偏向性, 水相提取的代谢物保留时间较短, 且偏向较小m/z, 而有机相提取的代谢物保留时间较长, 这与水稻[29]种子的代谢组学研究结果相同, 代谢物对有机相和无机相的偏好明显。综合几类代谢物的检出情况, 及优选与流动相相似的提取剂的原则[22], 本研究确定提取效果最佳的前处理为80%乙腈(0.1%甲酸)提取剂震摇提取30 min, 该条件下可检出糖类、氨基酸、有机酸和脂类等小分子代谢物, 检出更多代谢物峰, 且操作简单、试剂经济实惠, 可满足发芽小麦代谢组学研究。
本研究选用甲醇和乙腈两种常用提取剂为研究对象, 发现在基于UPLC-QTOF/MS的非靶向代谢组学研究中, 乙腈对发芽小麦代谢物的提取效率高于甲醇, 这一结果与已有研究不同。有报道指出植物中小分子代谢物的最佳提取剂为甲醇[30-31], 水与甲醇的组合适合多数非靶向研究[32-34], 当最佳提取剂未知时, Creydt等[10]建议优先选择甲醇水溶液。Dopple等[35]利用LC-HRMS手段分析甲醇和乙腈及其水溶液对开花期小麦代谢物萃取情况, 发现甲醇和乙腈在提取率方面是互补的, 共检测到996种代谢物, 鉴定代谢物109种。Han等[36]小麦胚和胚乳代谢研究中同样用到100%甲醇为提取剂。在基于FIMS手段的草莓[37]代谢组学研究中也有相似报道, 甲醇∶水(v∶v = 50∶50, 0.1%甲酸)与100%乙腈可共同检测到16%~36%的质量数, 但二者叠加可检测多达5844个独特12C。造成本研究与报道不同的原因可能是采用的检测技术、样品种类不同, 目前还没有适用于所有植物代谢组学分析的方法, 本研究的结果可能并不适用于生长中的小麦, 在实际应用中应根据样品种类、检测仪器特性等因素确定代谢物的制取方法。
代谢组学是通过分析海量代谢物信息, 来探究生物体内源性代谢物整体及其变化规律的科学。海量信息的获取不仅受提取方法的影响, 还受检测仪器的分辨率等因素的影响。代谢组学常用高分辨检测技术有GC-MS和LC-MS, 与LC-MS相比, GC-MS不易进行热不稳定代谢物的分析, 且样品前处理需衍生化, 不仅操作繁琐、耗时, 还可能引入干扰物[38], 对组学分析产生误差。LC-MS技术虽较晚应用到代谢组学中, 但具有检测范围广, 适用于热不稳定代谢物, 前处理简单, 基本不需要衍生化等优点,成为本次研究的检测技术。本研究采用的QTOF (飞行时间质谱)技术, 是目前使用较普遍的代谢组学质谱分析仪器, 质量准确度能达到1×10–6mg L–1 [39], 通过与超高压液相色谱联用, 扫描速度快, 为代谢物的定性分析提供更多依据。
数据库作为代谢物定性鉴定的参考标准之一, 对后续代谢组学数据分析、深入探究生物学机理具有十分重要的作用。目前有许多可供使用的网络开放数据库, 如MassBank等, 但缺乏具有针对性的特定数据库。因此, 建议未来可根据代谢物的分类建设不同类别数据库, 将为代谢物筛选工作提供更多便利。
附图和附表 请见网络版: 1) 本刊网站http://zwxb.chinacrops.org/; 2) 中国知网http://www.cnki.net/; 3) 万方数据http://c.wanfangdata.com.cn/Periodical-zuowxb.aspx。
[1] Scalbert A, Brennan L, Fiehn O, Hankemeier T, Kristal B S, Ommen B V, Pujos-Guillot E, Verheij E, Wishart D, Wopereis S. Mass-spectrometry-based metabolomics: limitations and recommendations for future progress with particular focus on nutrition research., 2009, 5: 435–458.
[2] Keurentjes J J B, Fu J, Vos C H R D, Lommen A, Hall R D, Bino R J, van der Plas L H, Jansen R C, Vreugdenhil D, Koornneef M. The genetics of plant metabolism., 2006, 38: 842–849.
[3] 漆小泉, 王玉兰, 陈晓亚. 植物代谢组学——方法与应用. 北京: 化学工业出版社, 2011. pp 3, 60.Qi X Q, Wang Y L, Chen X Y. Plant Metabolomics: Methods and Applications. Beijing: Chemical Industry Press, 2011. pp 3, 60 (in Chinese).
[4] Tulipani S, Llorach R, Urpi-Sarda M, Andres-Lacueva C. Comparative analysis of sample preparation methods to handle the complexity of the blood fluid metabolome: when less is more., 2013, 85: 341–848.
[5] Want E J, O’Maille G, Smith C A, Brandon T R, Uritboonthai W, Qin C, Trauger S A, Siuzdak G. Solvent-dependent metabolite distribution, clustering, and protein extraction for serum profiling with mass spectrometry., 2006, 78: 743–752.
[6] Fan T W M. Considerations of Sample Preparation for Metabolomics Investigation., 2012, 17: 7–27.
[7] Duportet X, Aggio R B M, Carneiro S, Villas-Bôas S G. The biological interpretation of metabolomic data can be misled by the extraction method used., 2012, 8: 410–421.
[8] t’Kindt R, Morreel K, Deforce D, Boerjan W, Van Bocxlaer J. Joint GC-MS and LC-MS platforms for comprehensive plant metabolomics: repeatability and sample pre-treatment.,, 2009, 877: 3572–3580.
[9] Theodoridis G, Gika H, Franceschi P, Caputi L, Arapitsas P, Scholz M, Masuero D, Wehrens R, Vrhovsek U, Mattivi F. LC- MS based global metabolite profiling of grapes: solvent extraction protocol optimisation., 2012, 8: 175–185.
[10] Creydt M, Arndt M, Hudzik D, Fischer M. Plant Metabolomics: Evaluation of Different extraction parameters for nontargeted UPLC-ESI-QTOF-mass spectrometry at the example of white asparagus officinalis., 2018, 66: 12876–12887.
[11] 李思钒. 不同代谢物提取方法对扬稻6号和武运粳7号水稻代谢组学研究结果的影响. 上海交通大学硕士学位论文, 上海, 2015. Li S F. Effect of Different Sample Extraction Methouds on the Metabolomics Study in Yangdao 6 and Wuyungeng 7 Rice. MS Thesis of Shanghai JiaoTong University, Shanghai, China, 2015 (in Chinese with English abstract).
[12] t’Kindt R, De Veylder L, Storme M, Deforce D, Van Bocxlaer J. LC-MS metabolic profiling of Arabidopsis thaliana plant leaves and cell cultures: Optimization of pre-LC-MS procedure parameters., 2008, 871: 37–43.
[13] Cara P. Optimization of protein precipitation based upon effectiveness of protein removal and ionization effect in liquid chromatography-tandem mass spectrometry.,, 2003, 2: 263–275.
[14] Stephen J B. Investigation of human blood plasma sample preparation for performing metabolomics using ultrahigh performance liquid chromatography/mass spectrometry., 2009, 9: 3285–3296.
[15] Bushra S. Effect of extraction solvent/technique on the antioxidant activity of selected medicinal plant extracts.(Basel, Switzerland), 2009, 6: 2167–2180.
[16] 包雨卓, 杨宁, 苍晶, 冯明芳, 吕岩, 彭瞰看, 田宇, 张达, 王军虹, 孟婧. 冬小麦东农冬麦1号在不同温度下的代谢组学差异分析. 麦类作物学报, 2017, 37: 647–655. Bao Y Z, Yang N, Cang J, Feng M F, Lyu Y, Peng K K, Tian Y, Zhang D, Wang J H, Meng J. Metabolomics analysis of winter wheat Dongnongdongmai 1 at different temperatures., 2017, 37: 647–655 (in Chinese with English abstract).
[17] Guo R, Yang Z, Li F, Yan C, Zhong X, Liu Q, Xia X, Li H, Zhao L. Comparative metabolic responses and adaptive strategies of wheat () to salt and alkali stress., 2015, 15: 170.
[18] 张月, 吕岱竹, 林静凌, 李建国. 高效液相色谱法测定小麦粉和大米粉中的氯啶菌酯. 农药, 2013, 52(1): 48–49. Zhang Y, Lyu Y Z, Lin J L, Li J G. Determination of chlorfenapyr in wheat flour and rice flour by high performance liquid chromatography., 2013, 52(1): 48–49 (in Chinese with English abstract).
[19] Beccari G, Arellano C, Covarelli L, Tini F, Sulyok M, Cowger C. Effect of wheat infection timing on Fusarium head blight causal agents and secondary metabolites in grain., 2019, 290: 214–225.
[20] Beccari G, Colasante V, Tini F, Senatore M, Prodi A, Sulyok M, Covarelli L. Causal agents of Fusarium head blight of durum wheat (Desf.) in central Italy and their in vitro biosynthesis of secondary metabolites., 2017, 70: 17–27.
[21] 胡贲, 赵明月, 段礼新, 王燃, 李锋, 翟妞, 许国旺, 彭孝军, 金立锋. 基于超高压液相色谱-四极杆串联飞行时间质谱技术的烟草代谢组学分析方法. 分析试验室, 2016, 35: 502–505. Hu B, Zhao M Y, Duan L X, Wang R, Li F, Zhai N, Xu G W, Peng X J, Jin L F. Tobacco metabolomics analysis method based on ultra-high pressure liquid chromatography-quadrupole tandem time-of-flight mass spectrometry., 2016, 35: 502–505 (in Chinese with English abstract).
[22] Kim H K, Verpoorte R. Sample preparation for plant metabolomics., 2010, 12: 4–13.
[23] 明道绪. 田间试验与统计分析(第3版). 北京: 科学出版社, 2013. pp 185–190.Ming D X. Field Experiments and Statistical Analysis, 3rd edn. Beijing: Science Press, 2013. pp 185–190 (in Chinese).
[24] Martin A, Pawlus A, M. Jewett E, Wyse D, Angerhofer C, Hegeman A. Evaluating solvent extraction systems using metabolomics approaches., 2014, 4: 26325.
[25] 王曦. 黄芪种子萌发及后萌发时期的代谢变化分析. 东北林业大学博士学位论文, 黑龙江哈尔滨, 2016. Wang X. Analysis of Metabolic During Seed Germination and Post-Germination of Astragalus Monghohcus. PhD Dissertation of Graduate School of Northeast Forestry University, Harbin, Heilongjiang, China, 2016 (in Chinese with English abstract).
[26] 许国旺, 路鑫, 杨胜利. 代谢组学研究进展. 中国医学科学院学报, 2007, 29: 701–711. Xu G W, Lu X, Yang S L. Progress in metabolomics research., 2007, 29: 701–711 (in Chinese with English abstract).
[27] Fukusaki E, Kobayashi A. Plant metabolomics: potential for practical operation., 2005, 100: 347–354.
[28] 阿基业, 何骏, 孙润彬. 代谢组学数据处理——主成分分析十个要点问题. 药学学报, 2018, 53: 929–937.A J Y, He J, Sun R B. Metabolomics data processing: ten key points in principal component analysis., 2018, 53: 929–937 (in Chinese with English abstract).
[29] 李思钒, 胡朝阳, 宋越, 詹舜安, 石建新. 不同提取液配方对水稻种子代谢组学研究的影响. 中国农机化学报, 2017, 38(2): 108–113. Li S F, Hu C Y, Song Y, Zhan S A, Shi J X. Effects of different extract formulations on rice seed metabolomics research., 2017, 38(2): 108–113 (in Chinese with English abstract).
[30] Evans A M, DeHaven C D, Barrett T, Mitchell M, Milgram E. Integrated, Nontargeted ultrahigh performance liquid chromatography/electrospray ionization tandem mass spectrometry platform for the identification and relative quantification of the small-molecule complement of biological systems., 2009, 81: 6656–6667.
[31] Oikawa A, Matsuda F, Kusano M, Okazaki Y, Saito K. Rice metabolomics., 2008, 1: 63–71.
[32] Díaz R, Pozo O J, Sancho J V, Hernández F. Metabolomic approaches for orange origin discrimination by ultra-high performance liquid chromatography coupled to quadrupole time-of-flight mass spectrometry., 2014, 157: 84–93.
[33] Bondia-Pons I, Savolainen O, Törrönen R, Martinez J A, Poutanen K, Hanhineva K. Metabolic profiling of Goji berry extracts for discrimination of geographical origin by non-targeted liquid chromatography coupled to quadrupole time-of-flight mass spectrometry., 2014, 63: 132 –138.
[34] Hrbek V, Rektorisova M, Chmelarova H, Ovesna J, Hajslova J. Authenticity assessment of garlic using a metabolomic approach based on high resolution mass spectrometry., 2018, 67: 19–28.
[35] Doppler M, Kluger B, Bueschl C, Schneider C, Krska R, Delcambre S, Hiller K, Lemmens M, Schuhmacher R. Stable isotope-assisted evaluation of different extraction solvents for untargeted metabolomics of plants., 2016, 17: 1017.
[36] Han C, Zhen S, Zhu G, Bian Y, Yan Y. Comparative metabolome analysis of wheat embryo and endosperm reveals the dynamic changes of metabolites during seed germination., 2017, 115: 320–327.
[37] Aharoni A, De Vos R, Verhoeven H, Maliepaard C, Kruppa G, Bino R, Goodenowe D. Nontargeted Metabolome analysis by use of fourier transform ion cyclotron mass spectrometry., 2002, 6: 217–234.
[38] 常玉玮, 王国栋. LC-MS在植物代谢组学分析中的应用. 生命科学, 2015, 27: 978–985. Chang Y W, Wang G D. Application of LC-MS in plant metabolomics analysis., 2015, 27: 978–985 (in Chinese with English abstract).
[39] 孔宏伟, 戴伟东, 许国旺. 基于液相色谱-质谱联用的代谢组学研究中代谢物的结构鉴定进展. 色谱, 2014, 32: 1052–1057. Kong H W, Dai W D, Xu G W. Progress in the structural identification of metabolites in metabolomics based on liquid chromatography-mass spectrometry., 2014, 32: 1052–1057 (in Chinese with English abstract).
Analysis method of wheat germination metabolomics based on UPLC-QTOF/ MS
WANG Li-Na and WANG Bu-Jun*
Institute of Crop Sciences, Chinese Academy of Agricultural Sciences / Cereal Quality Supervision and Testing Center, Ministry of Agriculture, Beijing 100081, China
To investigate the effects of different extraction methods on the extraction of wheat metabolites in germination, we established a pre-treatment and analysis method for the metabolomics samples based on UPLC-QTOF/MS. In this study, we used Zhoumai 26 grains germinated for 2 days, and designed L9(34) orthogonal experiments with extraction solvents, extraction methods and extraction time three levels based on UPLC-QTOF/MS. Besides, the best combination of extraction was obtained by principal component and cluster analysis: 1609 metabolic peaks were detected by 80% acetonitrile (0.1% formic acid) with shocking for 30 min, indicating that the extraction solvent plays a major role in the extraction of metabolites. A total of 92 wheat metabolites were identified in this study.
metabolomics; wheat; UPLC-QTOF/MS; extraction method; extraction solvent; orthogonal experimental
本研究由国家粮油作物产品质量安全风险评估专项(GJFP2018001), 中国农业科学院科技创新工程项目和国家重点研发计划项目(2016YFF0201803)资助。
This study was supported by the National Grain and Oil Crop Product Quality and Safety Risk Assessment Special (GJFP2018001), the Science and Technology Innovation Project of Chinese Academy of Agricultural Sciences, and the National Key Research and Development Program (2016YFF0201803).
王步军, E-mail: wangbujun@caas.cn
E-mail: hellowlina@sina.com
2019-02-25;
2019-06-24;
2019-07-19.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20190719.1332.002.html
10.3724/SP.J.1006.2019.91017
