CRISPR/Cas9介导敲除小鼠成纤维细胞MMP-2基因
2019-11-11接金磊张青青李鹏辉刘焕奇
接金磊,迟 良,张青青,李鹏辉,刘焕奇
(青岛农业大学动物医学院,山东青岛266109)
MMP-2(金属基质蛋白酶-2)是一种重要的炎性介质,能够参与多种疾病的发展过程[1]。炎症早期释放的TNF-α和IL-6等炎性介质能够促进MMP-2的表达[2,3],而过表达的MMP-2可降解细胞外基质,破坏基膜,使炎性细胞进一步浸润到更深层次的组织中,出现肌纤维坏死及吞噬现象等一系列病理炎症改变,从而加重炎性反应[4]。另外,肿瘤细胞也可因基膜的破坏、细胞外基质的溶解发生转移[5]。
近几年有研究表明[6],金属基质蛋白酶-2(MMP-2)在蹄叶炎的早期发展阶段中起着重要作用,基质金属蛋白酶能催化降解基底膜、半桥粒等重要结构,最终使基底膜和上皮基部细胞分离,使薄膜组织失去其生物学功能[7],造成指(趾)损伤,并发现P38 MAPK有利于MMP-2的活化[8],其下游通过PI3K/Akt使半桥粒调节异常,粘附功能失常[9],对蹄叶炎具有强大的促进作用。并有大量研究[10-12]表明,在蹄叶炎的早期炎症是主要的病理变化,这些变化包括:激活蹄层状基质金属蛋白酶(MMPs)、活化血小板并且形成嗜中性粒细胞血小板聚集、蹄叶层的白介素-1(IL-1)和内皮素1表达增加、p38 MAPK表达增加等。其中被激活的白细胞和血小板会释放TNF-α和p38丝裂原活化蛋白激酶(p38 MAPK),p38 MAPK能够激活MMP-2,从而对蹄叶层造成破坏,促进蹄叶炎的发生。
随着奶牛养殖业的高速发展,奶牛蹄叶炎也越来越多。据统计,41%的肢蹄病是蹄叶炎,72%的奶牛至少有一个蹄发生过蹄叶炎[13]。并且在实际情况中,对急性蹄叶炎的及时治疗是不切实际的,因为在其造成损伤前确诊是不可能的。当奶牛发展到慢性蹄叶炎时康复的几率很小,到目前为止还没有确切诊断蹄叶炎的基因检测指标,往往在症状上发现蹄叶炎症状时该奶牛已经面临淘汰危险。因此,开展对奶牛蹄叶炎病因、发病机理、诊断和防治等方面的研究,对防治奶牛蹄叶炎、提高奶牛生产性能具有重要的实用价值和现实意义[14]。
CRISPR/Cas9系统是一种存在于细菌和古细菌中针对外来入侵的免疫防御系统,能够识别外来入侵的核酸物质并形成针对性的剪切,以此来抵抗入侵的病毒以及外源DNA[15]。该技术操作简单、适用范围广[16],可以对特定的基因进行编辑,并且效率很高,在基因功能研究、模式生物构建、新品种的改造和培育以及基因治疗等方面均有研究[17]。本试验目的是通过利用CRISPR/Cas9系统敲除小鼠成纤维细胞中的MMP-2基因,为后人研究MMP-2与蹄叶炎炎症提供理论基础,对蹄叶炎等炎症性疾病的治疗预防和快速诊断具有重要意义,并为寻找分子指标的变化与蹄叶炎的关系,从而进行准确诊断和早期预警提供理论基础和技术标准。
1 材料与方法
1.1 菌株、质粒 Lenticrispr v2载体,购自Addgene公司;Stbl3感受态细胞,购自北京全式金生物技术有限公司。
1.2 试剂 限制性内切酶 Esp3I和FastAP,均购自Thermo公司;二硫苏糖醇 DTT,购自生工生物工程(上海)股份有限公司;T4多聚核苷酸激酶和Quick Ligase连接酶,均购自NEB公司;凝胶回收试剂盒和质粒提取试剂盒,均购自TaKaRa公司;2×TaqPCR Master Mix,购自北京艾德莱生物科技有限公司;青链霉素,购自Solarbio公司;DMEM-F12,购自HyClone公司;SDS-PAGE凝胶试剂盒和碱性磷酸酶显色试剂盒,购自贝博生物有限公司。
1.3 sgRNA的设计与相关引物的合成 根据MMP-2的基因序列(NCBI Reference Sequence:NM_008610.3)利用在线sgRNA设计工具(http://chopchop.cbu.uib.no/)设计MMP-2的sgRNA(small guide RNA),并在序列正义链和反义链的5′端添加Esp3I酶切位点(CACC/AAAC),设计的sgRNA引物分别为:MMP-sgRNA2-F:5′-caccGGCGATGGTGCAGCGATGGCG-3′;MMP-sgRNA2-R:5′-aaacCGCCATCGCTGCACCATCGCC-3′;MMP-sgRNA3-F: 5′-caccGTGGTAAACAAGGCTTCATGG-3′;MMP-sgR NA3-R:5′-aaacCCATGAAGCCTTGTTTACCAC-3′。sgRNA 的磷酸化与退火反应体系为:100 μmol/L Oligo1 1 μL、100 μmol/L Oligo 21 μL、10×T4 Ligation Buffer 1 μL、ddH2O 6.5 μL、T4 PNK 0.5 μL,共10 μL体系。反应条件为:37 ℃ 3 min,90 ℃ 5 min,再放置室温下,自动冷却至25 ℃。最终退火的寡核苷酸用无菌水以1∶200倍稀释,-20 ℃储存备用。
1.4 lenticrispr v2载体酶切 用Esp3I限制性内切酶切割Lenticrispr v2质粒,酶切体系为:Lenticrispr v2 5 μg、Esp3I 3 μL、Fast AP 3 μL、10×Fast Digest Buffer 6 μL、100 mol/L DTT 0.6 μL、ddH2O X μL,共60 μL体系。反应条件为:37 ℃水浴0.5~1 h。将酶切产物进行电泳检测,切胶回收酶切后的载体。
1.5 Lenticrispr-sgRNA载体构建 把退火之后200倍稀释的DNA片段与酶切后胶回收的载体相连接。连接反应体系为:酶切载体1 μL、DNA片段1 μL、2×Quick Ligase Buffer 5 μL、ddH2O 3 μL、Quick Ligase 1 μL,共11 μL体系。反应条件为:25 ℃孵育30 min。将连接产物转化感受态细胞stbl3,涂于含有氨苄抗性的LB平板,37 ℃过夜培养,挑取单克隆进行菌液PCR检测,检测引物为:V2-JC2-F:5′-GCCTATTTCCCATGATTCCTTC-3′;V2-JC2-R:5′-ACATCACTTTCCCAGTTTACCC-3′。菌液PCR体系为:菌液 2 μL、2×TaqPCR MasterMix 12.5 μL、v2-JC2-F 0.5 μL、v2-JC2-R 0.5 μL、ddH2O 9.5 μL,共25 μL体系。反应条件为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸20 s,30个循环;72 ℃延伸5 min。将阳性PCR反应液送公司测序,提取质粒。
1.6 转染及Western Blot 检测 转染前1天,将小鼠成纤维细胞接种于六孔板,加入2 mL含10%胎牛血清不含双抗培养基;取4支无菌离心管,分别加入200 μL无血清无双抗培养基,再向1号离心管中加入15 μL生理盐水;2、3号离心管中分别加入3 μg构建好的Lenticrispr-sgRNA2、Lenticrispr-sgRNA3载体;向4号离心管中加入相同量的Lenticrispr v2质粒;最后在上述4个离心管中分别加入9 μL转染试剂,室温孵育15 min。将上述混合液加入六孔板中,48 h后更换为含有1 μg/mL嘌呤霉素10%胎牛血清不含双抗的培养基,37 ℃培养24 h。提取细胞蛋白,做Western Blot 检测MMP-2蛋白表达量。
2 结果
2.1 Lenticrispr v2载体的酶切 Lenticrispr v2质粒长度为14 873 bp,用Esp3I限制性内切酶切割Lenticrispr v2质粒,可以切割下1个2 000 bp左右大小的条带。由图1可以看出,将酶切反应液进行凝胶电泳后,发现2个条带,其中1条2 000 bp左右与预测的结果相符。
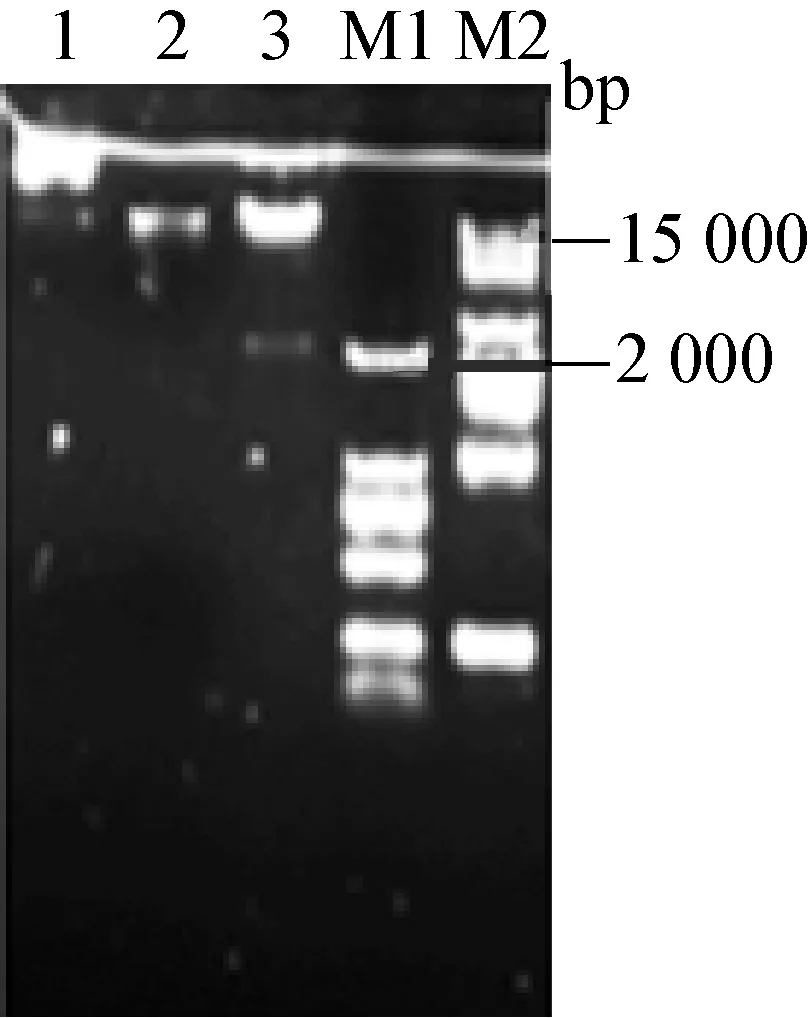
图1 lenticrispr v2载体酶切鉴定
1: Lenticrispr v2原质粒; 2:Lenticrispr v2质粒酶切,切胶回收后;3:Lenticrispr v2质粒酶切后; M1、M2:DNA相对分子质量标准
2.2 Lenticrispr-sgRNA载体构建 DNA片段与酶切后胶回收的载体相连接,如封三彩版图2。
2.3 阳性克隆鉴定 挑去阳性菌落进行菌液PCR,并将PCR体系进行凝胶电泳鉴定,发现500 bp左右的目的条带,结果如图3所示,与预测的结果相符。
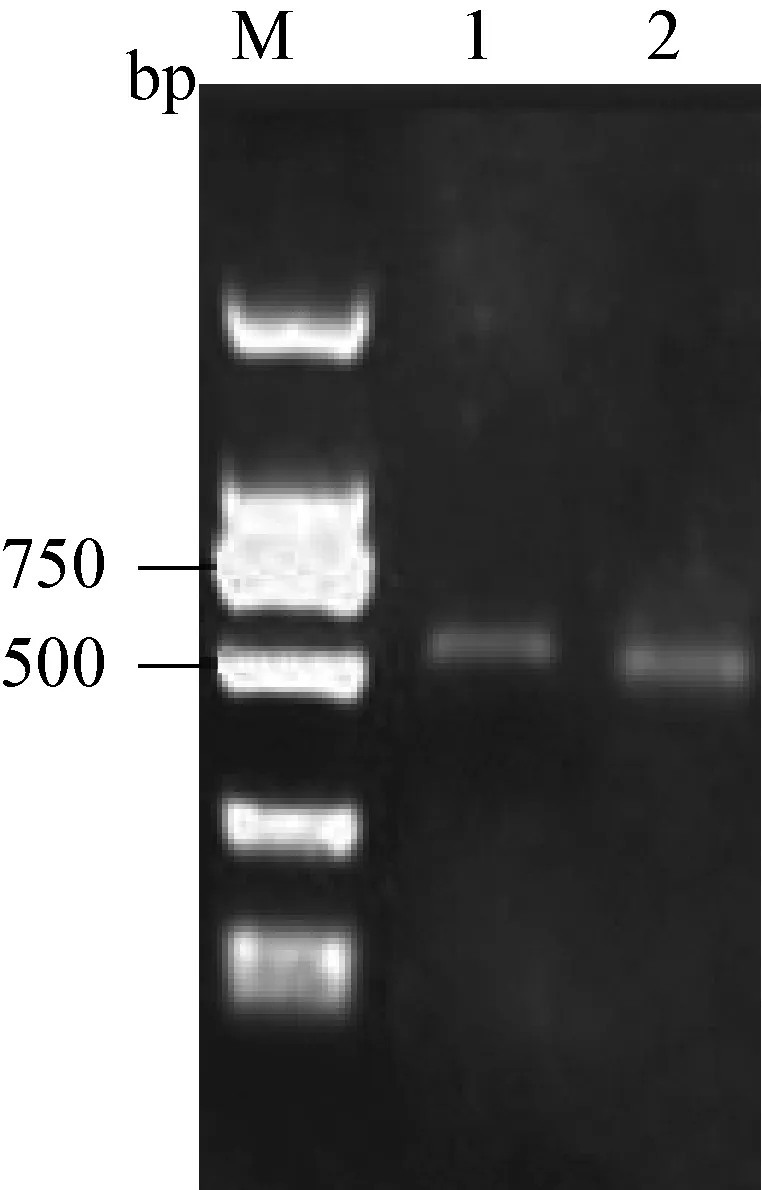
图3 阳性菌落PCR鉴定
M: DNA相对分子质量标准; 1、2:阳性菌落PCR反应液
2.4 测序结果 将PCR产物送至公司测序,得到产物序列,含有sgRNA:
Lenticrispr-sgRNA2:5′-…ACGAAACACCGGCGATGGTGCAGCGATGGCGGTTTTA…-3′
Lenticrispr-sgRNA3:5′-…ACGAAACACCGTGGTAAACAAGGCTTCATGGGTTTTA…-3′
2.5 转染结果 由封三彩版图4可见,经嘌呤霉素筛选后1组(对照组)细胞全死,2、3、4组细胞生长良好,表明质粒转染成功。
2.6 Western Blot 图5结果显示,基因敲除组(Lenticrispr-sgRNA2组和Lenticrispr-sgRNA3组)的MMP-2蛋白表达量明显降低,与空白对照组和转染空质粒组均有显著差异(P<0.05)。
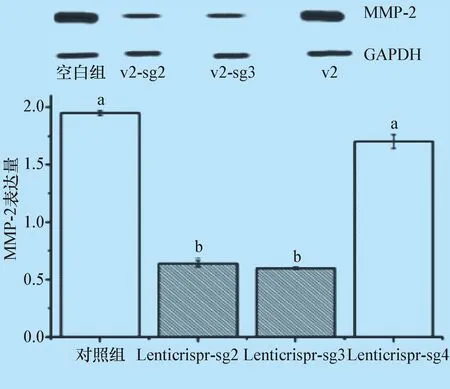
图5 MMP-2蛋白表达量分析
3 讨论
经过试验发现,将Lenticrispr v2载体用Esp3I酶进行酶切时,在PCR仪中酶切效果不如在水浴锅中。在试验中酶切时间可适当延长,但不要超过Esp3I酶的有效作用时间(6 h),若超过Esp3I酶的有效作用时间会把载体切碎,得不到所需片段。在对酶切好的载体进行切胶回收、纯化时,要用能够切胶回收的核酸染料(如溴化乙锭(EB)),在紫外线下不容易淬灭,以免造成切胶回收时载体浓度过低导致载体构建失败。本试验中酶切载体时对载体进行脱磷而Oligo则进行加磷处理之后再进行连接,这样可充分保证载体不会自连。其实Lenticrispr v2载体酶切后两端没有互补序列,所以不进行脱磷也不会自连,但并没有文献说明不脱磷对载体构建成功率是否有影响。
在转化过程中培养超过16 h就很容易出现卫星菌落和假阳性并且有提不出质粒的现象,这可能与带Amp抗性的细菌在生长时为了抵抗Amp会分泌一种能够降解Amp的β-内酰胺酶有巨大的关系。随着带Amp抗性细菌的生长,β-内酰胺酶分泌增多,培养基中的Amp逐渐减少,一旦细菌失去选择压力,就可能造成质粒丢失,当Amp浓度降到很低不足以抑制杂菌生长时,未携带质粒的菌就会比带质粒的快,出现较多的假阳性。其次也有可能是构建好的载体拷贝数低,提取DNA量低,检测不出来。在试验中一开始平板中Amp浓度为50 μg/mL,有较多的假阳性和卫星菌落,后来Amp浓度增加为100 μg/mL,卫星菌落和假阳性明显减少。
转染时应选用活力旺盛的细胞,不要用含杂质较多的原代细胞,最好是第3~5代的细胞,可以大大增加转染效率。转染时小鼠成纤维细胞在六孔板中生长密度为80%~90%时使用脂质体转染方法,有研究表明,细胞转染效率主要受细胞状态、细胞生长密度、质粒浓度、脂质体以及转染时间有关[18],经本试验筛选用3 μg载体与9 μL脂质体进行转染效果较好。小鼠和牛MMP-2基因的mRNA序列具有高同源性,本试验敲除小鼠成纤维细胞MMP-2基因,为以后在细胞层次研究MMP-2对炎症的影响提供基础。
4 结论
本试验构建了MMP-2基因CRISPR/Cas9敲除系统,成功敲除小鼠成纤维细胞中MMP-2基因,为进一步在细胞层面研究MMP-2基因提供基础。
