铜锤白花胶囊安全性评价研究
2019-11-08付开聪1崔明筠1健1付丽红2
付开聪1 崔明筠1* 罗 健1 付丽红2 倪 凯 高 敏
1.普洱市民族传统医药研究所,云南 普洱 665000;2.上海中医药大学,上海 201203;3.云南省中医中药研究院,云南 昆明 650000
腰椎间盘突出症是指腰椎间盘在受外力作用下,髓核从破裂处脱出,压迫腰椎的神经根,从而引起腰痛、下肢放射性疼痛和皮肤麻木、发凉、皮温下降、小便刺痛等一系列临床症状,该病在人群中较为常见,由于缺少有效的治疗方法,一旦患上,将严重影响患者的正常生活[1-2]。为寻求有效的治疗方法,普洱市民族传统医药研究所从哈尼族民间挖掘到一剂特效验方,后经普洱市民族医院研究开发成院内制剂铜锤白花胶囊,该制剂经临床验证对腰椎间盘突出症及腰腿疼痛的病症具有特殊功效[3]。
处方主要由民族药小铜锤、白花丹和中药细辛、三七、蜈蚣、蝎子等19味药材组成,19味药材君臣佐使搭配合理,相辅相成,增强疗效,起到了疗伤、止痛、疏通经络的作用。方中含有细辛、蜈蚣、全蝎和土鳖虫等4味毒性药材,该民族医药处方在普洱市民族医院临床使用超过5年,先后收集到125份临床观察病例,患者未出现过临床不良反应,为进一步探究铜锤白花胶囊的安全性,普洱市民族医院联合云南省中医中药研究院,开展了铜锤白花胶囊对大鼠的长期毒性实验研究,为民族医药制剂铜锤白花胶囊临床安全应用,提供了参考依据。
1 实验仪器、材料及动物
1.1 仪器 SQP型电子分析天平(德国赛多利斯);小鼠灌胃器[东西仪(北京)科技有限公司];RM2235切片机(上海徕卡仪器有限公司);SYSMEX XT-1800i全自动动物血液分析仪(日本希森美康公司);Qlympus Au5400全自动生化分析仪(日本奥林巴斯有限公司)。
1.2 材料 铜锤白花胶囊,每粒装0.45 g(普洱市民族传统医药研究所,1次5粒,1日3次,日服用量为13.65 g;饮用水(昆明珍茗食品有限责任公司);试剂盒(南京建成生物工程研究所);鼠料和玉米芯垫料(苏州双狮实验动物饲料科技有限公司)。
1.3 动物体重范围 60~80 g 的SPF级大鼠162只,雌雄各半,由湖南斯莱克景达实验动物有限公司提供。
2 方法
2.1 动物分组和给药 采用分层分组法,对162只大鼠,随机分为饮用水对照组、铜锤白花胶囊低(3g·kg-1·d-1)、中(6g·kg-1·d-1)、高(12g·kg-1·d-1)剂量组共4组,除对照组30只外,铜锤白花胶囊组每组44只,雌雄各半。连续灌胃铜锤白花胶囊3个月,依照雌雄各半,第13周随机抽取20只对照组大鼠,铜锤白花胶囊给药组大鼠每组抽取26只,实施剖检。
2.2 观察指标
2.2.1 一般情况 每天观察对照组和铜锤白花胶囊给药组大鼠的一般状态,每周1次体重和耗料量测定,停药4周后剖检剩余动物。观察铜锤白花胶囊给药期间和给药后恢复期大鼠的毒性反应,每周称量1次大鼠体重和平均进食量,每只动物每周摄食量以平均值记。
2.2.2 血液检查 给药结束后和恢复期结束,测定对照组和铜锤白花胶囊给药组大鼠的血红蛋白含量、红细胞数、红细胞平均体积、红细胞平均血红蛋白浓度、血小板数及白细胞计数等指标。
2.2.3 血液生化指标 给药结束后和恢复期结束,测定对照组和铜锤白花胶囊给药组大鼠的谷丙转氨酶、谷草转氨酶、总蛋白、总胆红素等肝功指标,尿素等肾功指标,葡萄糖胆固醇等生化指标。
2.2.4 病理学检查 给药结束后和恢复期结束,剖检对照组和铜锤白花胶囊给药组大鼠,观察雌雄大鼠的肝肺肾等主要器官的湿重,计算脏器系数;并用10%中性福尔马林液对大鼠脏器做固定处理,再对其进行石蜡包埋切片,镜检。
2.2.5 数据处理方法 数据用SPSS软件16.0处理,计量资料符合正态分布,方差齐者采用T检验,方差不齐采用T′检验;计量资料不符合正态分布,采用秩和检验,各组与对照组进行比较,P<0.05表示数据有统计学意义。
3 实验结果
3.1 对一般情况的影响 实验期间,对照组和铜锤白花胶囊给药组大鼠未监测到大鼠异常行为,精神状态和饮食活动正常。给药结束与恢复期结束,铜铜锤白花胶囊组进食量与饮用水空白对照组比较,进食量稍微减少,但不存在显著性差异(P>0.05)属于正常范畴,见表1。锤白花胶囊低、中、高剂量组雌雄动物体重与对照组比较出现动物体重增长缓慢,但在恢复期摄食量和体重增长恢复正常。见表2。
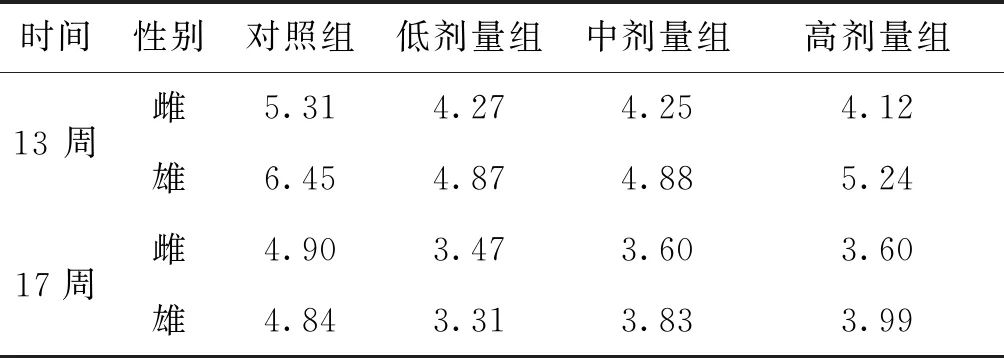
表1 给药对SD大鼠进食的影响 (g)
注:与空白对照组比较,*P<0.05;**P<0.01。

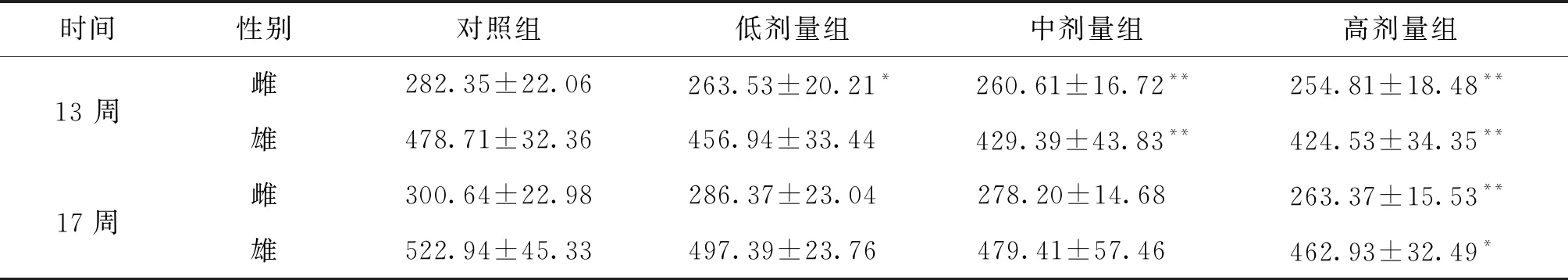
时间性别对照组低剂量组中剂量组高剂量组13 周雌282.35±22.06263.53±20.21*260.61±16.72**254.81±18.48**雄478.71±32.36456.94±33.44429.39±43.83**424.53±34.35**17周雌300.64±22.98286.37±23.04 278.20±14.68 263.37±15.53**雄522.94±45.33497.39±23.76479.41±57.46462.93±32.49*
注:与空白对照组比较,*P<0.05;**P<0.01。
3.2 血液学检查 由表3可知,灌胃13周结束时,铜锤白花胶囊组大鼠白细胞、血红蛋白计数和活化部分凝血活酶时间,与空白对照组比较差异无统计学意义 (P>0.05);其余铜锤白花组血液学检查指标和对照组比较可见统计学意义的增加或减少,铜锤白花胶囊剂量组大鼠的血液学指标,未见明显剂量时间依赖关系,综合上述结果,故认为是由动物个体差异所致[4-5];恢复期结束,各剂量组动物血液学指标与对照组比较未见统计学差异。因此连续灌胃给予铜锤白花胶囊不会影响大鼠的血液学指标。
3.3 血清生化学检查 由表4可知,灌胃13周结束时,铜锤白花胶囊组大鼠谷丙转氨酶、血糖、尿素、肌酐、与空白对照组比较不存在显著性差异,无统计学意义 (P>0.05);铜锤白花胶囊组大鼠总胆红素、总蛋白、总胆固醇值和和空白对照组比较可见统计学意义的增加或降低;恢复期结束,锤白花胶囊组大鼠总胆红素、总蛋白、总胆固醇值和空白对照组比较未见显著性增加或降低,大鼠血清生化学指标和铜锤白花胶囊灌胃剂量未形成明显量效关系,考虑认为是由动物个体差异所致出现统计学差异,未构成毒理学意义,说明指标的变化不是由药物毒性反应引起的[6-7]。
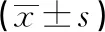
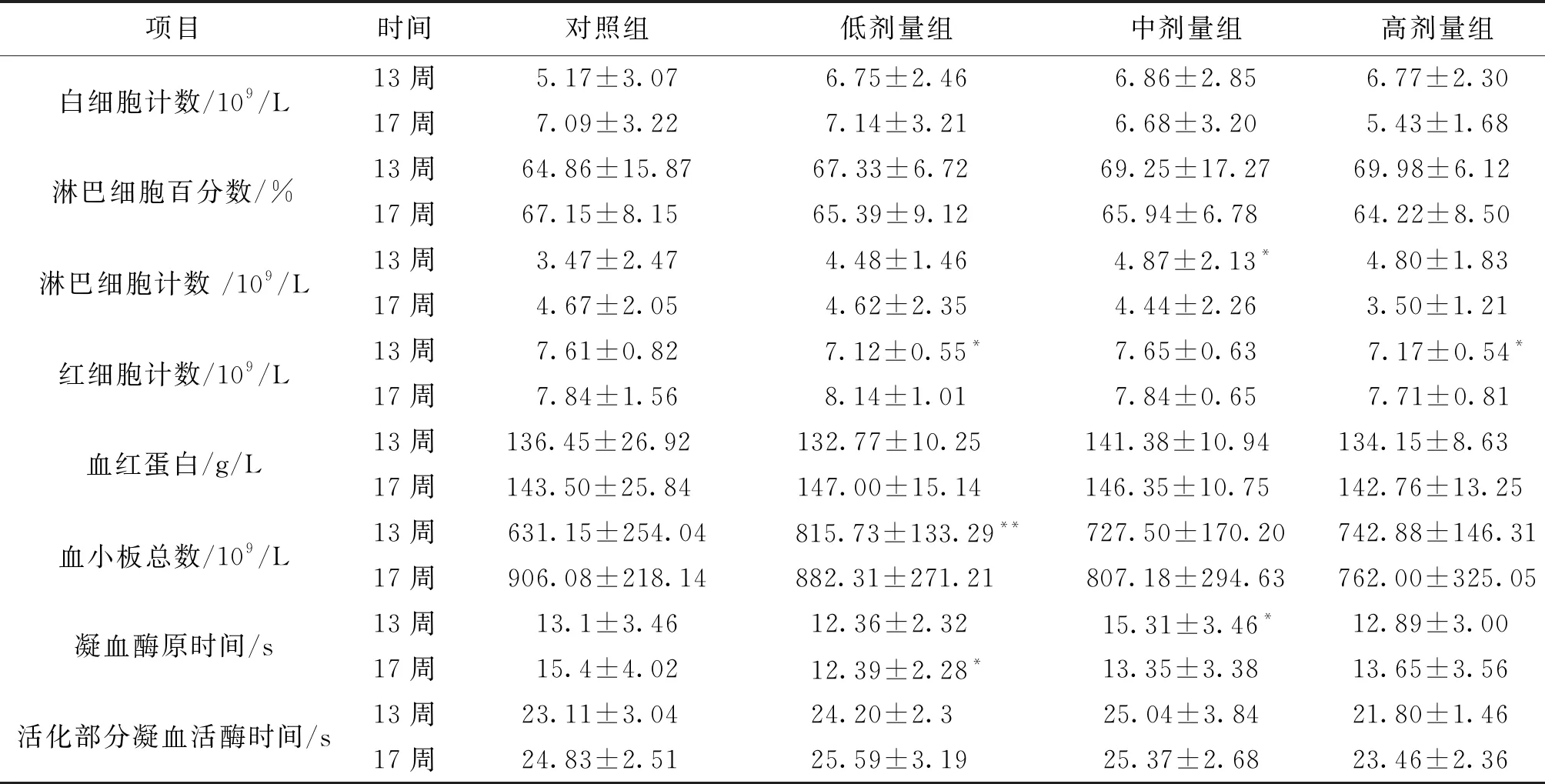
项目时间对照组低剂量组中剂量组高剂量组白细胞计数/109/L13周5.17±3.076.75±2.466.86±2.856.77±2.3017周7.09±3.227.14±3.216.68±3.205.43±1.68淋巴细胞百分数/%13周64.86±15.8767.33±6.72 69.25±17.2769.98±6.12 17周67.15±8.15 65.39±9.12 65.94±6.78 64.22±8.50 淋巴细胞计数 /109/L13周3.47±2.474.48±1.46 4.87±2.13*4.80±1.8317周4.67±2.054.62±2.354.44±2.263.50±1.21红细胞计数/109/L13周7.61±0.82 7.12±0.55*7.65±0.63 7.17±0.54*17周7.84±1.568.14±1.017.84±0.657.71±0.81血红蛋白/g/L13周136.45±26.92 132.77±10.25 141.38±10.94 134.15±8.63 17周143.50±25.84 147.00±15.14 146.35±10.75 142.76±13.25 血小板总数/109/L13周631.15±254.04 815.73±133.29**727.50±170.20742.88±146.3117周906.08±218.14882.31±271.21807.18±294.63762.00±325.05凝血酶原时间/s13周13.1±3.4612.36±2.32 15.31±3.46*12.89±3.00 17周15.4±4.0212.39±2.28*13.35±3.3813.65±3.56活化部分凝血活酶时间/s13周23.11±3.04 24.20±2.3 25.04±3.84 21.80±1.46 17周24.83±2.5125.59±3.1925.37±2.6823.46±2.36
注:与空白对照组比较,*P<0.05;**P<0.01。
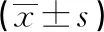
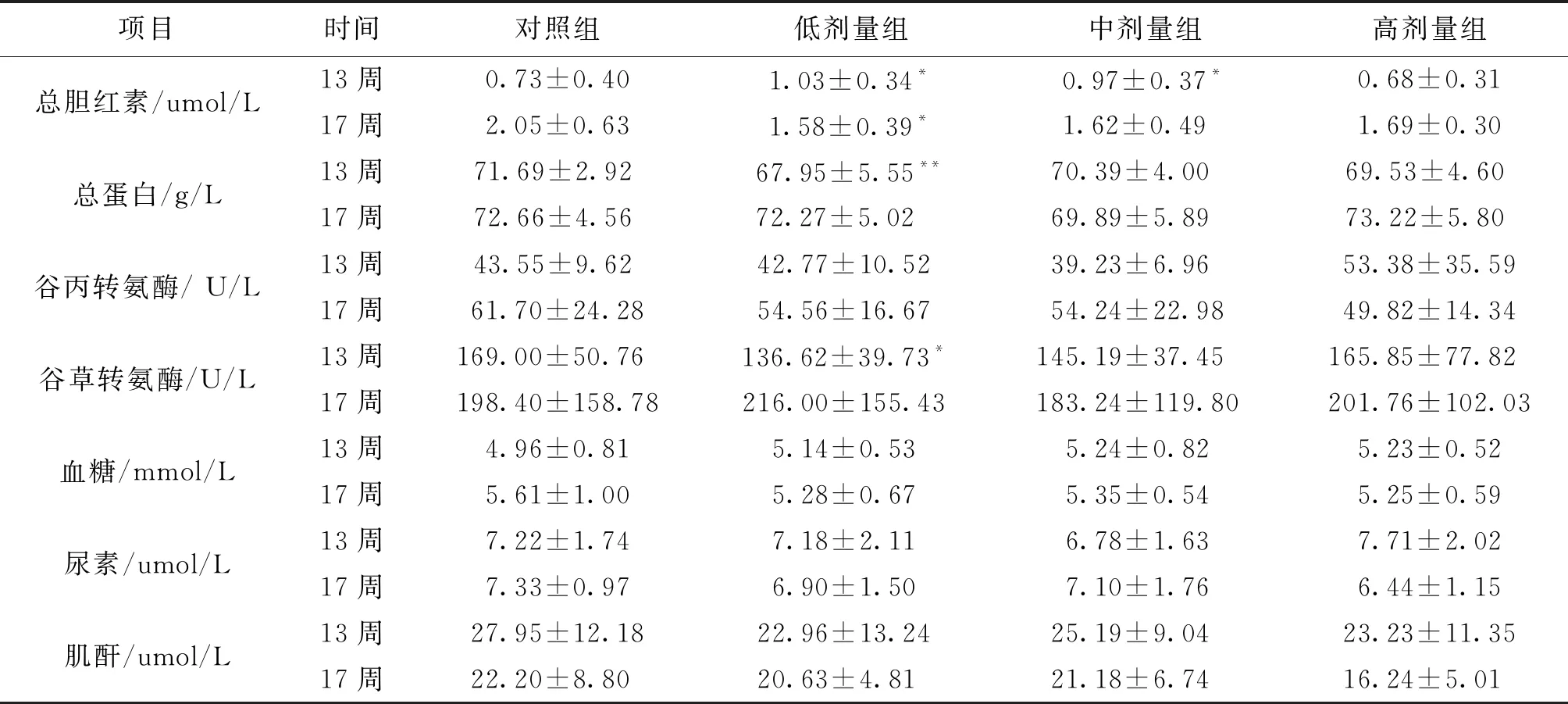
项目时间对照组低剂量组中剂量组高剂量组总胆红素/umol/L13周0.73±0.401.03±0.34*0.97±0.37*0.68±0.3117周2.05±0.631.58±0.39*1.62±0.491.69±0.30总蛋白/g/L13周71.69±2.92 67.95±5.55**70.39±4.00 69.53±4.60 17周72.66±4.5672.27±5.0269.89±5.8973.22±5.80 谷丙转氨酶/ U/L13周43.55±9.62 42.77±10.52 39.23±6.96 53.38±35.5917周61.70±24.2854.56±16.67 54.24±22.98 49.82±14.34谷草转氨酶/U/L13周169.00±50.76 136.62±39.73* 145.19±37.45 165.85±77.82 17周198.40±158.78216.00±155.43 183.24±119.80 201.76±102.03血糖/mmol/L13周4.96±0.815.14±0.53 5.24±0.82 5.23±0.5217周5.61±1.005.28±0.675.35±0.545.25±0.59尿素/umol/L13周7.22±1.747.18±2.11 6.78±1.63 7.71±2.0217周7.33±0.976.90±1.507.10±1.766.44±1.15肌酐/umol/L13周27.95±12.1822.96±13.24 25.19±9.04 23.23±11.3517周22.20±8.80 20.63±4.81 21.18±6.74 16.24±5.01
续表4
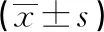

项目时间对照组低剂量组中剂量组高剂量组总胆固醇/mmol/L13周2.16±0.372.01±0.49 2.04±0.27 1.76±0.34**17周1.95±0.282.06±0.34 1.91±0.54 1.92±0.43肌酸激酶/umol/L13周4429.45±3013.74 2617.19±1918.04*3023.27±2417.33 3167.27±2153.2617周2502.10±1785.663793.94±3851.173331.76±2984.444159.35±3569.23
注:与空白对照组比较,*P<0.05;**P<0.01。
3.4 脏器系数和脏器病理组织学检查 给药结束后和恢复期结束胃、脑、十二指肠、骨骼肌、睾丸、附睾、子宫、卵巢、前列腺、肾上腺、甲状腺、食管、主动脉、膀胱、胸腺、皮肤、骨髓、脊髓、气管、心、脾、肠系膜淋巴等器官组织未观察到与受试物有关的改变。
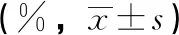
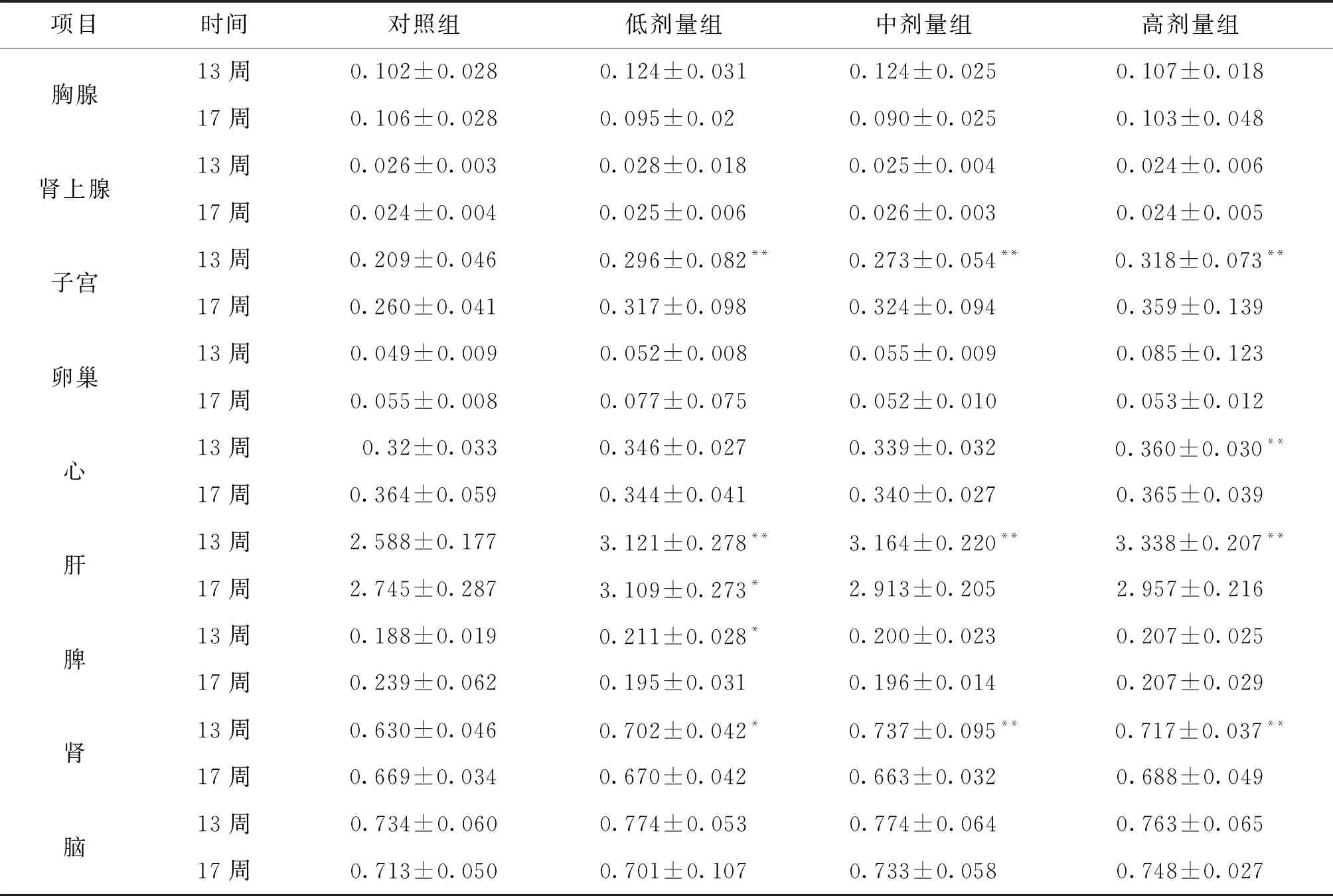
项目时间对照组低剂量组中剂量组高剂量组胸腺13周0.102±0.0280.124±0.0310.124±0.0250.107±0.01817周0.106±0.0280.095±0.020.090±0.0250.103±0.048肾上腺13周0.026±0.0030.028±0.0180.025±0.0040.024±0.00617周0.024±0.0040.025±0.0060.026±0.0030.024±0.005子宫13周0.209±0.0460.296±0.082**0.273±0.054** 0.318±0.073**17周0.260±0.0410.317±0.0980.324±0.0940.359±0.139卵巢13周0.049±0.0090.052±0.0080.055±0.0090.085±0.12317周0.055±0.0080.077±0.0750.052±0.0100.053±0.012心13周 0.32±0.0330.346±0.0270.339±0.032 0.360±0.030**17周0.364±0.0590.344±0.0410.340±0.0270.365±0.039肝13周2.588±0.1773.121±0.278**3.164±0.220** 3.338±0.207**17周2.745±0.2873.109±0.273*2.913±0.2052.957±0.216脾13周0.188±0.0190.211±0.028*0.200±0.0230.207±0.02517周0.239±0.0620.195±0.0310.196±0.0140.207±0.029肾13周0.630±0.0460.702±0.042*0.737±0.095** 0.717±0.037**17周0.669±0.0340.670±0.0420.663±0.0320.688±0.049脑13周0.734±0.0600.774±0.0530.774±0.0640.763±0.06517周0.713±0.0500.701±0.1070.733±0.0580.748±0.027
注:与空白对照组比较,*P<0.05;**P<0.01。
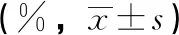
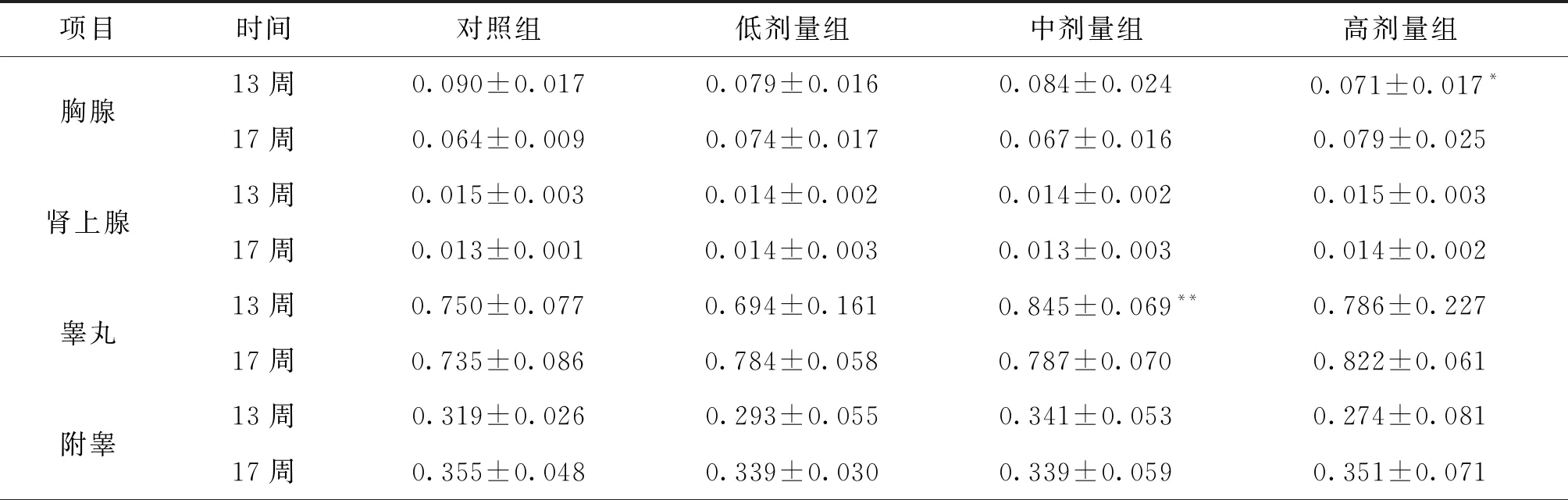
项目时间对照组低剂量组中剂量组高剂量组胸腺13周0.090±0.0170.079±0.0160.084±0.024 0.071±0.017*17周0.064±0.0090.074±0.0170.067±0.0160.079±0.025肾上腺13周0.015±0.0030.014±0.0020.014±0.0020.015±0.00317周0.013±0.0010.014±0.0030.013±0.0030.014±0.002睾丸13周0.750±0.0770.694±0.1610.845±0.069**0.786±0.22717周0.735±0.0860.784±0.0580.787±0.0700.822±0.061附睾13周0.319±0.0260.293±0.0550.341±0.0530.274±0.08117周0.355±0.0480.339±0.0300.339±0.0590.351±0.071
续表6
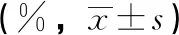

项目时间对照组低剂量组中剂量组高剂量组心13周0.335±0.021 0.313±0.028*0.359±0.0350.328±0.03017周0.316±0.0560.375±0.1190.314±0.0400.335±0.034肝13周 2.579±0.272 2.863±0.230* 3.007±0.166** 3.124±0.306**17周 2.724±0.175 2.724±0.331 2.810±0.2282.980±0.361脾13周 0.174±0.034 0.160±0.014 0.156±0.0170.162±0.01417周 0.146±0.023 0.149±0.024 0.156±0.020.160±0.034肾13周 0.617±0.072 0.704±0.065** 0.750±0.064**0.708±0.17517周0.0595±0.047 0.636±0.048 0.675±0.057* 0.705±0.04**脑13周 0.440±0.060 0.458±0.048 0.509±0.058 0.516±0.082*17周 0.411±0.034 0.425±0.043 0.450±0.0700.447±0.015*
注:与空白对照组比较,*P<0.05;**P<0.01。
由表5~6的数据分析,结合对照组和铜锤白花胶囊组大鼠器官湿重、体重、病理结果和脏体比系数的变化进行分析,给药结束时,与对照组比较,铜锤白花胶囊组大鼠脏体比系数均增加或降低的生物学意义较大,但缺少剂量和时间依赖性,且器官组织未观察到与受试物有关的改变,说明脏器指标的变化可能不是药物特异性毒性损伤;恢复期结束,雌性大鼠脏体比系数无明显变化,雄性大鼠肝脑肾脏体比系数升高,结合大鼠尿液检查、病理组织检查,可视为不是毒性靶器官[8]。
4 讨论
长期毒性试验是药物临床前安全性评价采取的主要研究方法,文中研究试验,通过将铜锤白花胶囊按照临床用药途径大剂量重复多次给予动物,密切检测动物产生的毒性反应和中毒靶组织器官,获得毒性产生的量效和时效关系,预测了铜锤白花胶囊在临床上可能出现的毒性反应性质及发生率,对铜锤白花胶囊的临床应用具有重要的参考意义。
铜锤白花胶囊对大鼠长期毒性实验结果显示,给药期与恢复期结束时,铜锤白花胶囊低、中、高剂量组大鼠一般状况良好,其活动,饮食,饮水正常,与对照组比较体重部分时期增长缓慢,但在恢复期摄食量和体重增长恢复正常,其它各项临床检验未见与铜锤白花胶囊灌胃剂量形成明显量效关系,且铜锤白花胶囊组大鼠各器官组织均未观察到与给药明显相关的组织形态学改变,综合以上研究数据说明在长期毒性实验条件下,铜锤白花胶囊对大鼠是安全的,为民族药铜锤白花胶囊的临床应用提供了安全性评价依据。
