靶向表皮生长因子受体的抗肿瘤治疗研究进展
2019-11-01王名雪李壮林
王名雪,李壮林
(1.烟台迈百瑞国际生物医药有限公司,山东 烟台 264006;2.荣昌生物制药<烟台>有限公司,山东 烟台 264006)
近年来,恶性肿瘤的发病率及死亡率不断攀升,严重威胁着人类的生命健康。随着肿瘤细胞学及分子生物学的不断发展,肿瘤的靶向治疗被越来越多的应用到恶性肿瘤的临床治疗中,成为继手术、放疗及化疗后治疗恶性肿瘤的新模式。肿瘤的靶向治疗,是利用肿瘤细胞过度表达的某些标志性分子作为靶点,这些特异性结构分子往往是肿瘤原癌基因产物或其信号传导通路,使用能与这些靶分子特异性结合的药物,达到抑制肿瘤生长或杀伤肿瘤细胞的作用[1]。这种靶向治疗,相对于放疗、化疗等传统手段更具有高效、低毒的功效,尤其对于放疗、化疗效果不理想以及失去手术机会的患者将更加有益。
表皮生长因子受体(epidermal growth factor receptor,EGFR),就是其中一种较理想的肿瘤治疗靶点。EGFR是原癌基因c-erb-B1的表达产物,是酪氨酸激酶I型受体家族的成员,该家族的其他成员包括HER2/neu、HER3和HER4[2]。EGFR与其配体结合后会导致二聚化,激活了胞内酪氨酸蛋白激酶的活性,使C末端特异的酪氨酸残基磷酸化,活化下游酶如Ras、Raf和PI3K等,由此启动下游一系列复杂交叉的信号转导途径[3]。EGFR通过介导这些信号通路,调节正常细胞的生长、分化及凋亡[4]。但其在大多数肿瘤中过表达和(或)突变,借助于信号转导通路的调节失控使细胞生长失控和恶化,抑制肿瘤细胞的凋亡[5]。EGFR在不同肿瘤组织中表达水平不同,且与肿瘤的分化程度、恶性程度及浸润程度密切相关[6]。正是由于这些特点,使EGFR成为具有良好前景的肿瘤诊断和治疗的靶点。目前,以EGFR为靶点的肿瘤靶向治疗主要分为如下五类:EGFR酪氨酸激酶抑制剂(EGFR tyrosine kinase inhibitor,EGFR-TKI)、单克隆抗体(monoclonal antibody,mAb)、双特异性抗体(bispecific antibody,BsAb)、抗体药物偶联物(antibody Drug Conjugate,ADC)及嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T),其作用机理见图1。本文针对这五类靶向性治疗的最新研究进展进行了综述。
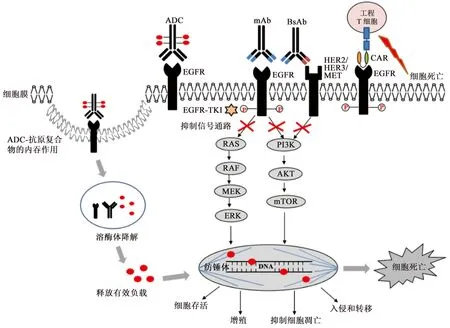
图1 靶向EGFR的抗肿瘤治疗机理
EGFR-TKI通过抑制EGFR酪氨酸激酶磷酸化,从而阻断下游信号通路;mAb与EGFR胞外区特异结合,阻断下游磷酸化及信号通路;BsAb通过与EGFR和另外一个抗原结合,更好的阻断下游信号通路,如果mAb和BsAb是IgG1类型,还可通过ADCC作用杀伤肿瘤细胞;ADC通过结合EGFR被细胞内吞,释放毒素,杀死细胞;CAR-T疗法通过表达CAR的T细胞识别并结合具有相应特异性抗原的肿瘤细胞,进而攻击肿瘤细胞。
1 EGFR-TKI
EGFR-TKI的作用机制是与EGFR胞内酪氨酸激酶结构域结合,能够竞争性抑制酪氨酸激酶三磷酸腺苷(adenosine triphosphate,ATP)与EGFR胞内酪氨酸激酶结构域的结合,进而影响酪氨酸残基磷酸化,抑制EGFR下游的信号转导。EGFR基因包括28个外显子,外显子18~21是EGFR基因ATP结合位点的编码区。
1.1 第一代EGFR-TKI 第一代的EGFR-TKI有吉非替尼(Gefitinib)、厄洛替尼(Erlotinib)、埃克替尼(Icotinib),其中吉非替尼和厄洛替尼均是美国原研药,分别由美国食品药品监督管理局(FDA)于2003年和2004年批准上市;埃克替尼是我国自主研发的药物,于2011年被中国食品药品监督管理局(CFDA)批准上市。这三种EGFR-TKI均被用于治疗局部晚期或转移的非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)。EGFR在20% ~ 80%的NSCLC中表达,而且外显子19的缺失和外显子21的点突变(L858R)被认为是NSCLC的致癌驱动因子[7];目前已经证实EGFR突变与第一代EGFR-TKI的疗效有关,是预测其疗效的最佳指标[8]。然而,在持续9~14个月的用药后出现了获得性临床耐药性[9]。研究发现,这些耐药性样本的EGFR中除了19号和21号两种药物敏感突变外,还出现了第20号外显子的790位苏氨酸残基被蛋氨酸取代(T790M)的突变[9-10]。T790M突变导致形成位阻效应,影响了EGFR-TKI与预期靶点的结合,从而提高了ATP与EGFR的亲和力,恢复了激酶活性,重新启动下游信号通路[11]。
1.2 第二代EGFR-TKI 为了解决第一代EGFR-TKI药物出现获得性耐药的问题,第二代不可逆的酪氨酸激酶抑制剂应运而生。第二代EGFR-TKI能够与EGFR共价结合,但从效果上来看大部分第二代EGFR-TKI并没有有效地阻止因T790M突变导致的EGFR与ATP亲和力增强的现象,而且皮疹和胃肠毒性的副作用大大限制了它们在临床中的应用[12]。迄今为止,只有阿法替尼(Afatinib)被批准用于转移性非小细胞肺癌患者的一线治疗,它是由Boehringer Ingelheim公司开发的一种选择性、不可逆的EGFR/HER2/HER4抑制剂,能够抑制野生型EGFR、L858R突变EGFR以及L858R/T790M双突变EGFR活性,同时还能抑制同家族的HER2和HER4活性[13-14]。
1.3 第三代EGFR-TKI 由于第二代EGFR-TKI对治疗EGFR T790M突变的效果不佳,而且不良反应也较明显,第三代共价选择性EGFR-TKI被开发。这些抑制剂对于EGFR双突变具有良好的选择性,能够选择性的与Cys797共价结合,从而克服了第二代EGFR-TKI出现的临床毒性[15]。2015年11月,FDA通过加速批准通道批准了Osimertinib上市,用于治疗EGFR T790M突变的晚期非小细胞肺癌患者[16]。尽管第三代EGFR-TKI显示出卓越的临床疗效,但是获得性耐药已悄然来临。有研究表明,在Osimertinib耐药的肺癌中发现C797S突变,这个突变能阻挡Osimertinib与EGFR的结合;同时,在耐药患者中也出现了HER2或C-MET的扩增,使得肿瘤细胞通过EGFR-非依赖的信号通路发生逃逸[17]。
1.4 第四代EGFR-TKI 鉴于第三代EGFR-TKI耐药性的出现,第四代EGFR-TKI的开发模式是抑制具有三重突变L858R/T790M/C797S的EGFR突变体。EAI045是首次被报道的第四代EGFR-TKI,在L858R/T790M/C797S模型中能够有效抑制肿瘤细胞的增殖,由于EGFR二聚化的需要,EAI045可能需要与西妥昔单抗联合使用[18]。博生医药开发的ES-072作为新一代EGFR-TKI于2017年7月被FDA批准进入临床试验阶段,试验患者包括存在EGFR T790M和C797S耐药突变的非小细胞肺癌患者。
然而,C797S突变并不是第三代EGFR-TKI产生耐药性的唯一机制,L718Q和L844V突变以及EGFR-非依赖的信号通路也导致第三代EGFR-TKI耐药性的出现[19]。因此,EGFR-TKI耐药是一个非常棘手的临床问题,第四代EGFR-TKI也不能完全解决临床耐药性出现的问题。
2 mAb
mAb与小分子EGFR-TKI作用机制不同,它可特异性地识别EGFR胞外区,阻断配体与EGFR的结合,从而阻断了配体对EGFR的激活作用。同时可促进EGFR的内吞机制,减少膜表面的EGFR数量;IgG1型抗体还可诱导产生抗体依赖的细胞毒性(ADCC)[20]。此外,由于抗体与EGFR胞外区结合,所以对野生型及胞内酪氨酸激酶活性域变异型EGFR均有效。目前,已上市的EGFR单克隆抗体共有4个,分别是西妥昔单抗、帕尼单抗、尼妥珠单抗和加西他布单抗。
2.1 西妥昔单抗(cetuximab) 西妥昔单抗于2004年被FDA批准用于治疗EGFR阳性的晚期结肠癌,可单独用药或与化疗联合应用,是第一个经FDA批准的EGFR单抗药物。西妥昔单抗是一种人/鼠嵌合IgG1单克隆抗体,能够以高亲和力与内源性配体竞争结合EGFR胞外域,它还可诱导产生ADCC作用杀伤肿瘤细胞[20]。2006年3月,FDA批准西妥昔单抗用于治疗手术不能切除的头颈部鳞癌,是第一个获批的头颈部肿瘤治疗药物。研究表明, 西妥昔单抗的疗效或总体生存期与K-ras基因是否突变有关,对K-ras突变型患者疗效不佳[21]。2008年8月,欧洲药品局(EMEA)批准西妥昔与化疗联合可作为K-ras野生型、EGFR阳性转移性结直肠癌患者的一线治疗。
2.2 帕尼单抗(panitumumab) 帕尼单抗是第一个完全人源化IgG2单克隆抗体,作用机制与西妥昔单抗相似,2006年9月被FDA批准用于治疗化疗失败后转移性结直肠癌,2007年12月获EMEA批准用于治疗K-ras野生型结直肠癌患者[22]。相对于西妥昔单抗,帕尼单抗是IgG2型单抗,因此缺乏ADCC杀伤肿瘤细胞的机制;但其没有鼠源蛋白,半衰期更长,受体亲和性更高,免疫耐受性更好。帕尼单抗用于治疗头颈癌、非小细胞肺癌等适应证的临床试验正在进行中[23]。
2.3 尼妥珠单抗(nimotuzomab) 尼妥珠单抗是我国批准引进的第一个用于治疗恶性肿瘤的EGFR单抗药物,2008年,CFDA批准其用于与放疗或化疗联合治疗EGFR表达阳性的Ⅲ/Ⅳ期鼻咽癌,2009年被写入《NCCN头颈部肿瘤临床指南(中国版)》,推荐用于局部晚期鼻咽癌的一线治疗。目前,尼妥珠单抗联合放化疗治疗鼻咽癌、头颈部肿瘤、神经胶质瘤、结直肠癌、胰腺癌、食管癌、肝癌、非小细胞肺癌等实体瘤的临床研究在多个国家正在开展。尼妥珠作为新一代人源化EGFR单克隆抗体,联合放化疗可明显提高抗肿瘤效果,具有安全性高、耐受性好等特点,具有很好的临床应用前景。然而,尼妥珠单抗的疗效预测分子目前尚未明确,未来需要在治疗前检测EGFR、KRAS等基因水平,寻找有意义的预后指标,筛选敏感人群,为肿瘤患者提供更合理有效的个体化治疗方案。
2.4 加西他布单抗(necitumumab) 加西他布单抗是第二代重组人IgG1 EGFR抗体,联合吉西他滨-顺铂一线化疗与单独吉西他滨-顺铂相比显著提高了晚期或转移性鳞状细胞癌患者总生存率和无进展生存率[23-24],于2015年被FDA批准用于联合吉西他滨、顺铂一线治疗转移性鳞状非小细胞肺癌。K-ras基因突变状态是西妥昔单抗和帕尼单抗治疗结直肠癌的一个重要标志物[25],缺乏有效的疗效预测生物标志物也可能成为加西他布单抗临床应用的主要障碍之一。
尽管西妥昔单抗和帕尼单抗在治疗结直肠癌患者中取得了显著的临床效果,但持续用药几个月后便出现耐药性。除了最常见的K-ras突变导致的逃逸机制外,EGFR表位结构域S468R突变首先在西妥昔耐药转移性结直肠癌患者中被发现,其他点突变引起的西妥昔及帕尼单抗耐药性也陆续被发现和报道[26-27]。一项最新研究发现,加西他布单抗可以结合大多数对西妥昔和帕尼单抗产生抗性的EGFR突变体,可能对某些产生耐药性的转移性结直肠癌有效,显示出很好的临床应用前景[28]。
3 BsAb
BsAb是同时特异性结合两个不同抗原的人工抗体,由于其特异性和双功能性,现已成为抗体工程领域的研究热点。目前已上市的两个双特异性抗体(catumaxomab和blinatumomab)均通过结合T细胞表面分子CD3和癌细胞表面抗原,拉近细胞毒性T细胞与癌细胞的距离,引导T细胞直接杀伤癌细胞。目前处于临床阶段的靶向EGFR的双特异性抗体有如下几类:
3.1 靶向EGFR和HER3的BsAb Duligotuzmab(MEHD7945A,RG7597)是基因泰克公司研发的同时结合EGFR和HER3的双特异性抗体。EGFR和HER3的磷酸化激活了下游的Ras/MAPK和PI3K/AKT信号通路,促进了细胞的生长和增殖[2-3]。EGFR或HER3的单特异性抗体不能完全抑制增殖和存活信号,将针对EGFR和HER3的两种特异性抗体结合在一起,可以完全抑制Ras/MAPK和PI3K/AKT信号通路,提高癌症治疗疗效[29]。两种抗体分子分别对EGFR和HER3具有良好的亲和力。Fc区的存在使这种双特异性抗体可以像正常人体IgG一样,同时可以发挥免疫效力。目前,Duligotuzmab处于Ⅱ期临床试验阶段,初步结果显示其优于单一靶向EGFR抗体西妥昔的疗效[30],而且有研究表明,Duligotuzmab能克服西妥昔单抗产生的部分耐药性[31]。
3.2 靶向EGFR和C-MET的BsAb LY3164530由礼来公司研制,是靶向EGFR和C-MET的双特异性抗体。C-MET与其配体肝细胞生长因子(hepatocyte growth factor,HGF)在细胞的增殖、存活、侵袭等过程中发挥重要作用,在多种肿瘤细胞中高表达[32]。C-MET还可通过与EGFR相互作用而被激活,被认为是EGFR-TKI耐药性的一种信号逃逸机制[17]。Emibetuzumab(LY2875358)是礼来公司开发的一种靶向C-MET的单克隆抗体,目前处于临床Ⅱ期研究阶段,用于治疗非小细胞肺癌和胃癌。LY3164530是通过融合EGFR抗体单链可变片段(cetuximab序列)至Emibetuzumab重链的N末端而成的双特异性抗体类药物。LY3164530可结合C-MET及EGFR并促进其内吞,而不具有激活活性。在NSCLC移植瘤模型中,该药物相比于Emibetuzumab与Cetuximab联合用药方案表现出更好的抗肿瘤疗效。另一个EGFR/c-MET双特异性抗体JNJ-61186372增强了EGFR突变型肺癌细胞的杀伤,目前正处于临床Ⅰ期试验阶段[33]。
3.3 包含EGFR靶标的其他BsAb 靶向EGFR/CD3的双特异性抗体被开发用来连接到激活的T细胞,这种T细胞(EGFRBi-aATC)被重新输入体内,促进非MHC限制的T细胞介导的对EGFR阳性肿瘤细胞的杀伤[34],但该项I期临床试验被终止[35]。靶向EGFR/CD64的双特异性抗体MDX447完成了I期临床对晚期实体瘤患者安全性与有效性评估,目前无该项临床试验的最新进展[36]。此外,靶向EGFR/VEGFR2[37]、EGFR/IGF-1R[38]、EGFR/HER2[39]等双特异性抗体也处于不同的研发阶段。
4 ADC
ADC近年来发展迅速,它将细胞毒素分子连接到抗体上,通过其抗体部分与细胞表面的抗原结合,形成ADC-受体复合物并迅速内化,在溶酶体内加工后释放毒素,从而杀伤肿瘤细胞;ADC兼具小分子药物强大的杀伤力和单抗高度的靶向性,因而成为肿瘤靶向治疗的热点[40]。目前,FDA批准上市的ADC药物有4个(Adcetris、Kadcyla、Besponsa、Mylotarg),另外还有超过65个ADC正处于临床试验的不同阶段[41]。目前还没有靶向EGFR的ADC被批准上市,但有几个正处于临床试验阶段。
4.1 Depatuxizumab mafodotin(ABT-414) ABT-414为艾伯维公司研发的靶向EGFR的ADC,它由人源化EGFR抗体ABT-806经不可裂解的连接子偶联微管抑制剂MMAF而组成。在多形性成胶质细胞瘤(glioblastoma multiforme,GBM)的Ⅱ期临床研究中,表现出了强效的抑制肿瘤的疗效和可控的眼部毒性[42]。目前,此药用于成胶质细胞瘤、非小细胞肺癌等实体瘤的Ⅲ期临床试验正在开展。另一种将抗体ABT-806偶联MMAE毒素制备的ADC(ABBV-221)在临床前研究中显示出较强的肿瘤抑制作用,有望进入临床试验阶段[43]。
4.2 Laprituximab emtansine(IMGN-289) IMGN-289是由Immuno Gen公司开发的一种靶向EGFR的嵌合IgGκ型单克隆抗体与美登素DM1的偶联药物,曾进行过治疗实体瘤的Ⅰ期临床研究,但该研究目前已终止。
4.3 AMG-595 AMG-595是安进公司开发的一种靶向EGFR Ⅲ型突变体(EGFRvⅢ)的单克隆抗体与DM1的偶联药物,曾进行过治疗间变性星形细胞瘤和成胶质细胞瘤的Ⅰ期临床研究,该研究目前无最新进展公布。
5 CAR-T
CAR-T疗法是从患者自身收集T细胞,通过基因工程技术在其表面表达能够识别特异性肿瘤抗原的特殊受体,即嵌合抗原受体(chimeric antigen receptor,CAR),同时在受体的胞内段加上引起T细胞活化的信号传递区域,表达CAR的T细胞(CAR-T)经扩增后被注入患者体内,识别并结合具有相应特异性抗原的肿瘤细胞,进而攻击肿瘤细胞[44]。目前已有两个CAR-T被FDA批准上市,分别是2017年8月批准的Kymriah(tisagenlecleucel)和2017年10月批准的Yescarta(axicabtagene ciloleucel),它们都是靶向CD19的CAR-T疗法。针对EGFR的CAR-T治疗也处在临床及研发的不同阶段。
CAR-T-EGFRvⅢ是宾夕法尼亚大学和诺华医学研究所合作开发的靶向EGFRvⅢ的CAR-T,用于GBM患者的治疗正处于I期临床试验阶段。EGFRvⅢ是EGFR胞外区氨基酸缺失引起的突变体,是肿瘤中最常见的一种EGFR突变体[45]。这种突变体被检测到在GBM肿瘤细胞中大量表达,在正常细胞中无表达,具有肿瘤特异性和免疫原性[46]。一项最新的临床研究结果显示,CART-EGFRvⅢ细胞具有可接受的安全性,可以跨越血脑屏障,浸润肿瘤,并且能够引起免疫应答,从而使得GBM细胞中EGFRvⅢ肿瘤抗原的减少[47]。除此之外,该研究还发现,患者中EGFRvⅢ表达的广泛变化,再加上CAR-T细胞输注时引起的肿瘤免疫抑制效应被激活,这些可能是潜在的治疗障碍[47]。
目前上海细胞治疗研究所正在开展一项Ⅰ/Ⅱ临床试验,评估一项可以分泌CTLA-4和PD-1抗体的EGFR-CAR-T疗法对EGFR阳性、晚期复发或难治性恶性实体瘤患者的疗效和安全性。EGFR-CAR-T能特异性有效地杀伤EGFR阳性肿瘤细胞,其分泌的CTLA-4和PD-1抗体能改善肿瘤免疫抑制微环境,这种新一代的CAR-T兼具CAR-T和免疫检查点抑制剂的优点,是治疗晚期实体瘤的一种有前景的方法。
6 结语
肿瘤细胞学及分子生物学的不断发展,EGFR作为肿瘤靶向治疗的潜力也已显现出来。目前以EGFR为靶点的肿瘤靶向治疗主要有EGFR-TKI、单克隆抗体、双特异性抗体、ADC及CAR-T这五种类型,这五种治疗方法在临床使用或试验阶段都取得了显著的效果,但每一种方法又都存在局限性。EGFR-TKI要面临EGFR酪氨酸激酶不断出现的耐药性突变,所以针对相继发生的耐药突变不断有新一代的EGFR-TKI出现。单克隆抗体单独用药对肿瘤细胞的杀伤作用有限,需与其他放化疗或EGFR-TKI联合治疗。ADC药物对肿瘤细胞杀伤作用明显,但其药物荷载量的一致性及临床安全性也是该类型药物面临的挑战。目前有大量针对EGFR的CAR-T疗法正处在临床或研发阶段,也取得了显著的疗效,但EGFR的高变化性及肿瘤微环境仍是这种疗法需要突破的障碍。总之,靶向治疗已成为治疗恶性肿瘤的一种新模式,虽然面临着许多难题和技术瓶颈。但随着技术的进步和发展,相信这些难题和技术瓶颈会不断被解决和攻破,为恶性肿瘤患者带来福音。
