海洋生物海绵中溴吡咯生物碱的研究进展
2019-11-01高荔
高荔
(山东省体检办公室,山东 济南 250014)
这个美丽的蓝色星球上,海洋面积十分广大,占地球的四分之三。众多的海洋生物在海洋中共生共存,相互依赖,它们在这样相对稳定的环境中繁衍生息。随着科学技术的不断进步,人类把探索的触角伸向了广阔无垠的海洋。科学家从众多的海洋生物中提取到了许多有效成分,这些成分与陆地生物中所提取的成分截然不同。因此,海洋生物的次级代谢产物在化学结构和药理活性方面也与陆生生物有着较大的差别,在医药领域有着无限的开发潜力和巨大的研究价值[1]
海洋生物品种多、数量大,海绵就是其中非常重要的一种。作为最原始多细胞动物的海绵,细胞已经发生分化,但仍未形成组织。因为机体表面存在很多小孔,所以在动物分类学上属于多孔动物门,海绵大多生活在海洋中一些非常坚硬的物质(如:礁石、珊瑚等)上。在长期的生物进化过程中,海绵与放线菌等微生物形成了极其密切的共生关系,进而产生了许多化学结构新颖且多种多样、药理活性丰富且良好的次级代谢产物[2]。长期以来,来自各个国家和地区的科学家们通过不断的努力,已经研究了地球上不同海域海绵的活性化学化学成分。对于那些有明确药理活性的化合物,科学家们还对其生物合成途径进行进一步探究,试图找到该类化合物的人工合成方法,造福人类。
海水中含有大量的盐分,即具有丰富的氯离子(Cl-)。同时,还含有大量的溴离子(Br-)和较少量的碘离子(I-)。这些卤素离子,广泛参与海洋生物的生物合成过程中的各种卤化反应,最终产生大量带有卤素原子的化合物。含有卤素原子的天然药物,例如抗生素金霉素和氯霉素、抗真菌药灰黄霉素等,它们均具有较为独特的生物活性。由此可见,含有特殊结构的生物碱成分也可能含有某种特别的药理活性,非常具有研究价值。
目前,结构独特、在海绵中广泛存在且药理活性多样的生物碱成分,已经成为天然药物化学研究中的一个重要目标化合物[3-5]。近年来,研究已经发现这些溴吡咯生物碱具有镇痛、抗组胺[6]、抗菌[7]细胞毒及免疫抑制[8]等多种生物活性。本文将对目前已分离纯化得到的溴吡咯生物碱类成分按不同结构进行分类介绍,并对相关的提取分离合成方法进行简要阐述。
1 目前已分离得到的溴吡咯生物碱
1.1 简单链式溴吡咯生物碱
1.1.1 吡咯环α-侧链为链状结构的溴吡咯生物碱 海绵中分离得到的简单链式溴吡咯生物碱,结构相对简单的一种便是吡咯环α-侧链为链状结构的溴吡咯生物碱,文献中有不少报道。在对海绵中具有防污活性的化合物进行系统研究时,从海绵(Agelasmauriti)中分离得到一种2.5 μg·mL-1浓度下可以促进海鞘(Cionasavignyi)幼虫蜕变的物质,与其他化合物有所不同,这种化合物是4,5-dibromopyrrole-2-carbamide(1)[9]。而Tasdemir等[10]利用Ⅱ型脂肪酸途径(FAS-II)作为抗菌药物发现的验证目标,以基于Plasmodiumfalciparum的enoyl-酰基载体蛋白还原酶(PfFabI)的活性追踪分离程序进行酶抑制活性试验,发现化合物4,5-dibromopyrrole-2-carboxylic acid methyl ester(2)具有较好的抑制活性。Scala等[11]在对具有抗寄生性原生虫病活性的溴吡咯生物碱进行研究时,发现了化合物bromopyrrolohomoarginin(3)具有非常好的抑制PfFabZ活性,其IC50值为0.28 μg·mL-1。高尚等[12]从海绵Axinellaverrucosa中分离出4种简单链式溴吡咯生物碱,分别为化合物4~7,并对该类化合物进行体外脾淋巴细胞的增殖实验。研究结果显示化合物(4)对ConA诱导的T淋巴细胞具有一定的增殖作用,化合物(5)对LPS诱导的B淋巴细胞具有一定的增殖作用,化合物1~7的结构式见图1。
1.1.2 吡咯环α-侧链上有环状结构的溴吡咯生物碱 吡咯环脂肪侧链上连接有咪唑环或其他环状结构的溴吡咯生物碱是从海绵中分离得到的一种非常重要的化合物,它们的结构相对简单却多种多样。文献资料中,oroidin(8)是非常常见的一种溴吡咯生物碱,主要从Axinellidae和Agelasidae类海绵中分离得到。Scala等[11]在对Agelasnakamurai海绵提取物进行代谢产物和生物活性的初步研究时,发现其可能具有抗肿瘤活性。Lindel等[13]在对海绵提取物进行拒鱼食活性的研究中,发现oroidin在高浓度时很有可能是海绵进行化学防御的主要有效物质,化合物keramadine(9)在结构中含有一个N-甲基-2-氨基咪唑环及一个(Z)型双键,它在高浓度条件下,基本上没有化学防御活性。而与其结构相似的化合物dihydrokeramadine (10)也从海绵中分离得到过,研究还发现化合物midpacamide(11)及其他几种化合物合用,可提高化学防御活性。也就是说,吡咯环是该类成分产生化学防御活性的必需结构,而咪唑环的存在可以增强化学防御的活性。
在现代生物碱的研究中,海洋生物海绵中溴吡咯生物碱的研究在全世界范围内有着举足轻重的地位。在生物体内,有超过2 000个蛋白激酶在调节细胞的功能。对这些激酶进行筛选,可以发现效果明显且选择性好的蛋白激酶抑制剂,为人类疾病的治疗提供可靠的药物。对分离自海绵的活性成分sventrin(12)进行活性筛选,发现其对珊瑚礁鱼Thalassomabifasciatum具有拒食作用,构-效关系研究表明,其结构中N-甲基的存在能够降低其拒食活性[14]。运用老鼠胚胎干细胞体外血管组织模型对ageladine (13)的抗血管新生作用进行研究,发现其可能具有抗肿瘤活性[15]。而dispacamide A(14)、dispacamide B(15)、dispacamide C(16)和dispacamide D(17)则除了具有抗血管新生活性之外,还有明显的抗组胺活性。与之结构相似mukanadin A即dispacamide D、mukanadin B (18)、和mukanadin D(19)也是在海绵中发现的,其中mukanadin D具有神经保护活性和谷氨酸拮抗活性,化合物8~19的结构式见图2。

图2 吡咯环α-侧链上有环状结构的溴吡咯生物碱
1.1.3 羧酸类溴吡咯生物碱 在溴吡咯生物碱中,很多含有羧基这一特别的官能团,有的以游离形式存在,有的与其他化合物成盐,以解离状态存在。Erik等[16]从Agelascerebrum粗提取液中分离出一些简单羧酸类溴吡咯生物碱,这些生物碱具有一定的抗肿瘤、抗疟疾作用,如:4,5-dibromopyrrole-2-carboxylic acid(20)、4,5-dibromopyrrole-2-carboxylic acid TFA salts(21)、5-bromopyrrole-2-carboxylic acid(22)以及与之结构十分相似的化合物4-bromopyrrole-2-carboxylic acid(23)、3,4-bromopyrrole-2-carboxylic acid(24)和侧链上含有胍基的化合物4-bromopyrrole-2-carboxyhomoarginine(25)等。从Axinella和Agelas属海绵中分离得到的 manzacidin A(26)和agelongine1(27)等有具有对4种寄生原生动物有抑制作用,另外还发现了manzacidin B(28)、manzacidin C(29)、N-methylmanzacidin C(30)等化合物[11],化合物20~30的结构见图3。
1.2 并环类溴吡咯生物碱
1.2.1 吡咯并七元环类溴吡咯生物碱 吡咯并七元环类溴吡咯生物碱是并环类溴吡咯生物碱中很重要的一类,其结构特征是在吡咯环2,3位形成七元并环,其结构如图4所示。这些吡咯并七元环类溴吡咯生物碱结构新颖而复杂,并表现出多种生物活性,是海洋天然药物化学的研究中不可或缺的组成部分,在天然药物领域中具有极大的关注度。然而,因为海绵中的此类成分的含量极少,经过一步的提取分离实验后,样品的损耗必然存在,所以我们要积极的探究新颖的研究方法,更快,更准确地发现一些微量甚至是超微量的成分。

图3 羧酸类溴吡咯生物碱

图4 吡咯并七元环类溴吡咯生物碱
Linington等[17]在对海绵中分离得到的化合物进行生物活性研究时,发现化合物hymenialdisine(31)具有蛋白激酶抑制活性,能调节炎症转化因子、抑制G2细胞循环站点,并且可以减轻骨关节炎恶化,药理活性多样。Sauleau等[18]在海绵Cymbastelacantharella中发现了一系列结构相似的化合物,即hymenialdisine类化合物,包括(+)-dihydrohymenialdisine (32)、(-)-dihydrohymenialdisine(33)和一些其他化合物。这类化合物化学结构独特,对蛋白激酶具有非常明显的抑制活性,在澳大利亚一篇关于海洋科学的文章中,报道了2-bromoaldisin(34)、axinohydantoin (35)、hymenin(36)和stevensine(37)等一系列化合物已经在海绵中被发现。Fouad等[19]从采集自印度尼西亚海域的海绵Stylissasp.中发现了化合物12-N-Methyl stevensine(38)、12-N-Methyl-2-debromostevensine(39)、3-debromolatonduine B methyl ester (40)、和3-debromolatonduine A(41)等溴吡咯类生物碱。在对海绵的研究中,还发现了一些结构新颖的溴吡咯生物碱,这些化合物包括:没有细胞毒性的latonduine A(42)和latonduine B(43)及其衍生物,即latonduine B的酯类化合物latonduine B ethyl ester (44)和latonduine B methyl ester(45)等。
1.2.2 吡咯并哌啶类溴吡咯生物碱 吡咯并哌啶类生物碱也是一种非常重要的溴吡咯生物碱,其结构特征为吡咯环1,2位形成六元并环,其详细结构如图5。吡咯并哌啶类生物碱与吡咯并七元环类溴吡咯生物碱,在海绵中溴吡咯生物碱的研究、海洋天然产物的研究以及天然产物的研究中具有同等地位。
到目前为止,从Agelasida、Axinellida和Halichondrida属海绵中已经分离得到很多种具有不同生物活性的溴吡咯生物碱,此外,在海绵中还发现了几种化合物,这几种化合物对人类20S蛋白酶体和20S免疫蛋白酶体催化中心蛋白质的水解活性具有一定的抑制作用,这些化合物为dibromophakellin (46)、bromophakellin (47)、4,5-dibromopalau′amine (48)、 dibromophakellstatin(49)、和dibromoisophakellin (50)。另外dibromoagelaspongin (51)、cycoroidin(52)、hanishin(53)N-methyldibromoisophakellin(54)等化合物也在海绵中有所发现[20-21]。Akta等[20]从海绵Agelasoroides中分离到两种化合物。化合物mukanadin C(55)的粗提取物在HPLC上的保留时间为21.87 min。oxocyclostylidol(56)则是从海绵Stylissacaribica中获得的一种分子内环化的oroidin衍生物。

图5 吡咯并哌啶类生物碱
1.3 聚合类溴吡咯生物碱 聚合类溴吡咯生物碱是由两个或多个溴吡咯生物碱聚合而成的,其结构中含有两个及两个以上的溴吡咯环,与其他结构类型的溴吡咯生物碱相比,较为复杂。其结构如图6,大多数的聚合类溴吡咯生物碱属于化合物oroidin的衍生物。Tanaka等[22]应用简单的提取技术,及HPLC、LC-MS 和 MS-MS等方法,快速地发现了Agelassp.海绵中sceptrin (57)、debromosceptrin (58)、oxysceptrin (59)、dibromosceptrin (60)及 nakamuric acid(61)等化合物的存在。而Buchanan等[23]在研究中发现化合物stylissadine A(62)和stylissadine B (63) 作为P2X7受体拮抗剂,具有抗炎活性。另外,从日本海绵PseudoceratinaPurpurea中分离得到了具有抗菌活性和细胞毒性的结构相对简单的化合物pseudoceratidine(64)及可阻止藤壶幼虫附着的具有抗污损活性的mauritiamine(65)[24]。
2 溴吡咯生物碱的合成
海洋中的海绵种类多种多样,传统的提取分离方法已经不能够充分提取海绵中的有效活性成分。 因此,天然药物学家和药理学家将对海绵进行进一步的研究实验,为更加深入的探究奠定坚实的基础。值得注意的是,溴吡咯生物碱化合物的合成难度与该化合物自身结构的复杂程度密切相关,现就文献资料中有关溴吡咯生物碱的合成方法进行简单的介绍和阐述。
简单链式的溴吡咯生物碱的合成相对简单,Justin James[25]对海绵中orioidin 类生物碱的合成和生物活性进行了研究,并且对简单的羧酸类溴吡咯生物碱4,5-dibromopyrrole-2-carboxylic acid的N-甲基衍生物进行了合成,其合成方法如图7。海绵通过消耗体内的氨基酸来合成其次生代谢产物,其生物合成途径为氨基酸途径。因而,可以采用氨基酸途径对溴吡咯生物碱进行仿生合成。Genta-Jouve等[26]对oroidin类生物碱的生物合成途径进行了探究,其生物合成途径如图8。一定要注意的是,精氨酸、高精氨酸、鸟氨酸和赖氨酸4种氨基酸是oroidin类溴吡咯生物碱的合成前体化合物。首先精氨酸通过动物体内的尿素循环脱去尿素,形成高精氨酸。高精氨酸经过脱氨、氧化等步骤形成2-羧基吡咯与赖氨酸反应得到的2-氨基咪唑类化合物反应,最终生成oroidin类溴吡咯生物碱。这是一种非常重要的合成途径,因为海绵体内很多的溴吡咯生物碱均是由oroidin类溴吡咯生物碱衍生而成的。通过这一反应得到的oroidin类溴吡咯生物碱,也可以应用于合成很多结构新颖且各有不同的溴吡咯生物碱。

图6 聚合类溴吡咯生物碱

图7 羧酸类溴吡咯生物碱的合成

图8 oroidin的生物合成途径
近年来,对溴吡咯生物碱合成方法的研究报道屡见不鲜,Forte等[27]探究了许多种溴吡咯生物碱的合成方法,其中最重要的两种合成方法是吡咯并七元环类和吡咯并哌啶类溴吡咯生物碱的合成,这两个典型的合成途径如图9所示。先以氨基酸途径合成2-bromoaldisine,从它开始合成更为复杂的吡咯并七元环类化合物,得到最终产物axinohydantoin。另外,还采用一些简单的化合物经过一共六步的化学反应,得到了一种结构相对复杂的吡咯并哌啶类溴吡咯生物碱。然而,在这篇文章中,还叙述了一些其他有生物活性的天然产物的合成过程。虽然这些化合物的结构并不是十分复杂,但由于多个手性碳原子的存在,导致化合物空间结构具有多样性,使得一些手性分子的合成难度增大。对于那些具有手性碳原子的手性分子,即使合成成功,也很难采用合适的方法将不同异构体进行分离,因此,溴吡咯生物碱的合成是一项非常具有挑战性的工作。
聚合类溴吡咯生物碱的合成与其他结构简单的溴吡咯生物碱相比,更为复杂,聚合类溴吡咯生物碱多数是由oroidin类生物碱聚合而成,可能的合成机理见图10[28]。

图9 吡咯并七元环类和吡咯并哌啶类溴吡咯生物碱合成
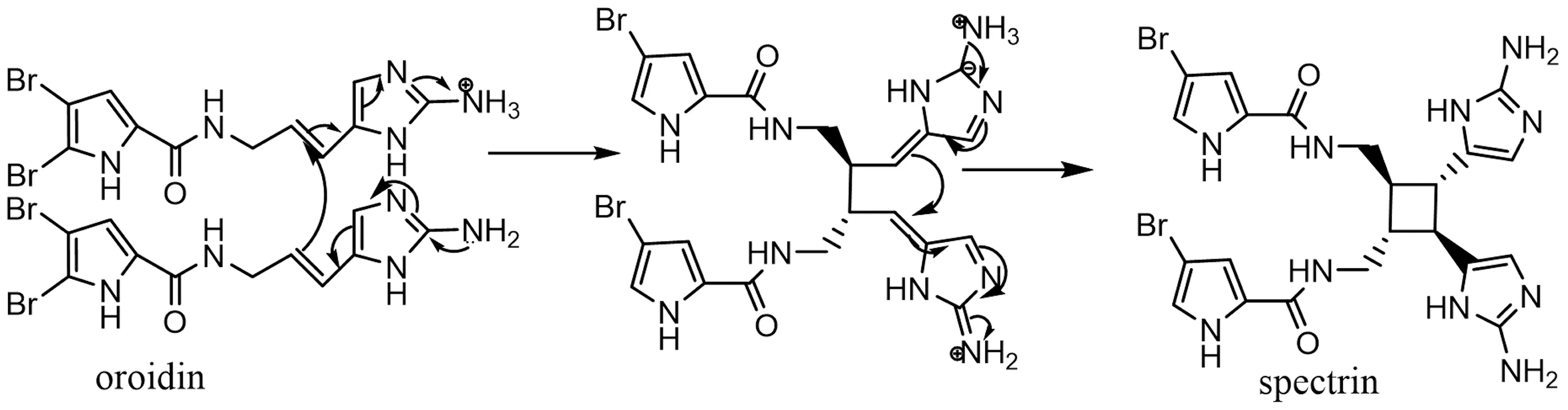
图10 聚合类溴吡咯生物碱的合成机理
3 结论
海绵中的溴吡咯生物碱具有多种多样的生物活性和药理活性,例如:抗肿瘤活性,抗组胺活性,抗菌活性等。溴吡咯生物碱的化学结构也具有许多种类,例如:简单链式的溴吡咯生物碱、并环类溴吡咯生物碱、聚合类溴吡咯生物碱等。在这些类型的生物碱中,聚合类溴吡咯生物碱尤为特别,它与其他类型的溴吡咯生物碱相比,生物活性与药理活性较多,化学结构也更加丰富。近年来,科学家对于聚合类溴吡咯生物碱的研究日益增加。
广阔无垠的海洋是无数海洋生物的生活家园,它蕴藏着极为丰富的自然资源,其中,海绵便是生活在海洋中的一种非常重要的动物。随着自然科学和动物分类学等相关学科的发展,人们将会发现更多的海绵物种,由于海绵物种的不同,其产生的次生代谢产物也可能具有细微或较大的差别;同时,随着化学和药学相关学科的发展,科学家能够逐渐发现更加科学的海洋天然药物研究方法,应用更加先进的科学技术手段提取,分离并鉴定出海绵中的微量成分;值得期待的是,随着电子科学技术的发展,人类将建立更加完善、更加完整的海洋药物化学成分的数据库,特别是关于海绵中有效活性化学成分的数据库,例如溴吡咯类生物碱等。方便科学家、学者和普通公民进行查阅和对比研究;更有甚者,随着药理学、临床药学等学科的发展,如果人们可以应用微量的成分预测化合物的生物活性或药理活性,那么对于海绵中溴吡咯生物碱的科学研究将会迈出一大步。今后,随着科学家和药理学家对海绵中溴吡咯类生物碱更加深入的研究更多有益于人体的化学成分将等待着我们去发掘、应用,终将有造福人类的美好明天。
我国海洋辽阔,海洋中有着非常丰富的海绵资源,目前已经发现的海绵品种就有5 000多种,应该还有更多的海绵品种亟待发现。虽然海绵的种类多种多样,但是经过科学研究并报道过有效活性成分的海绵物种却只是屈指可数,这无疑是对海绵资源的一种浪费。为了充分地利用这些海绵资源,寻找有药用价值的海洋天然产物,发现更多具有显著药理活性的先导化合物,开发更为理想的临床药物,国家可以给予相应的政策支持,鼓励研发人员的积极研究。海绵有着十分广阔的应用前景,随着社会的发展、人类的进步,实现从海绵中发现有实际药用价值并开发为新药运用于临床战胜疾病这一目标将指日可待!
