Galectin-3和急性脑梗死预后的相关性分析
2019-10-31张媚溪
张媚溪
脑梗死为临床常见的脑缺血性损伤,是导致患者死亡及残疾的主要原因。近年来我国脑梗死发病率呈逐年上升趋势[1]。既往认为全身炎症在脑梗死发病中有重要作用[2]。半乳糖凝集素-3(galectin-3,gal-3)在炎症、血管增生、免疫疾病发病过程中均有一定的调控作用,属于N-乙酰氨基乳糖外源性凝集素,可分泌血清及细胞外基质,与纤连蛋白、层粘连蛋白、Ⅳ型胶原结合,参与T 细胞凋亡、增殖及巨噬细胞吞噬过程,同时有趋化作用,可激活肥大细胞,促进中性粒细胞外渗,介导巨噬细胞活化,在动脉粥样硬化过程中有重要作用[3]。为探讨gal-3 与急性脑梗死预后的关系,我院对收治的129 例患者的临床资料进行了回顾性分析,现报道如下。
1 材料与方法
1.1 研究对象 选择2014年2月~2018年1月我院收治的129 例急性脑梗死患者作为脑梗死组。纳入标准:符合中华医学会神经病学分会脑血管病学组通过的脑卒中标准[4],且经头颅CT 及磁共振检查确诊;伴颈动脉供血区神经功能缺失,且持续时间>48h;颈动脉超声检查确定存在动脉粥样硬化;入院后均完善实验室检查,有明确的gal-3 检查结果,且临床资料完整,均完成6 个月随访调查。排除标准:合并心肌梗死、先天性心脏病、心脏瓣膜病、心房纤颤、脂肪栓塞、心房黏液瘤、癌栓等疾病者;合并凝血机制异常及血栓形成者;合并出血性疾病及肝肾功能衰竭者;合并恶性肿瘤者;合并结核病、免疫系统疾病者;合并腔隙性脑梗死者;急慢性感染性疾病者;既往有手术或外伤史者。其中男87 例,女42 例;年龄42~79 岁,平均(65.2±4.7)岁;合并高血压17 例,糖尿病30 例。选取同期我院体检的40 例健康正常人作为对照组,均有明确gal-3测定结果,其中男29 例,女11 例;年龄41~78 岁,平均(64.7±3.5)岁。
1.2 方法 ①研究方法。回顾性分析所有患者临床资料及随访资料,包括人口学资料、既往史、实验室检查结果、动脉粥样硬化斑块性质(不稳定斑块、稳定斑块、无斑块)、脑梗死体积(小体积梗死:≤4cm3;中体积梗死:4~10cm3;大体积梗死:≥10cm3)、治疗及预后评分结果。②实验室指标测定方法。所有对象入院清晨抽取空腹肘静脉血,采用全自动生化分析仪测定空腹血糖(Glu)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、甘油三酯(TG)、超敏C 反应蛋白(hs-CRP)、同型半胱氨酸(Hcy)水平,并采用酶联免疫法测定血gal-3 水平,试剂盒购自武汉博士德生物科技有限公司,严格按照试剂使用说明进行操作。③预后分组方法。采用改良Rankin 量表评定[5]脑梗死组患者治疗6 个月预后,0 分:无症状;1 分:有轻微症状,但无功能障碍,可独立完成日常生活及工作;2 分:轻度残疾,无法完全完成病前活动,但无需照料;3 分:中度残疾,可独立行走,日常生活需部分帮助;4 分:中重度残疾,无法独立行走,日常生活需帮助;5 分:重度残疾,卧床,大小便失禁,日常生活完全依赖;6 分:死亡。预后良好:0~2 分;预后不良:3~6 分。所有患者均按照预后评分分为预后良好组、预后不良组,比较两组临床各指标的差异。
1.3 统计学方法 采用SPSS 19.0 软件处理数据,计数资料进行χ2检验,计量资料采用t检验,多组比较进行秩和或方差分析,组内行LSD-t 检验,相关性分析采用Pearson 相关分析,P<0.05 为差异有统计学意义。
2 结果
2.1 两组实验室指标比较 脑梗死组血清Glu、TC、LDL-C、hs-CRP、gal-3水平均高于对照组(P<0.05),见表1。
表1 两组实验室指标比较(±s)
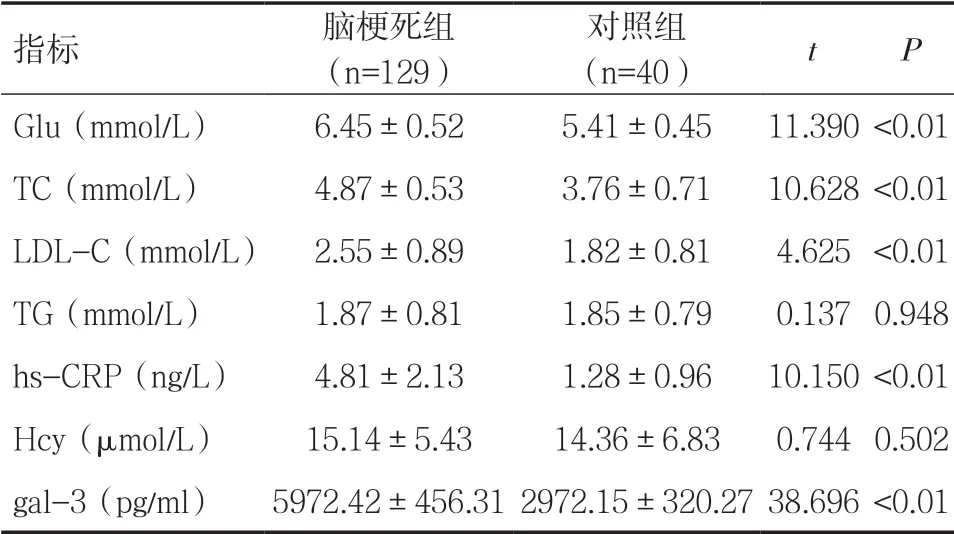
表1 两组实验室指标比较(±s)
指标 脑梗死组(n=129)对照组(n=40) t P Glu(mmol/L) 6.45±0.52 5.41±0.45 11.390 <0.01 TC(mmol/L) 4.87±0.53 3.76±0.71 10.628 <0.01 LDL-C(mmol/L) 2.55±0.89 1.82±0.81 4.625 <0.01 TG(mmol/L) 1.87±0.81 1.85±0.79 0.137 0.948 hs-CRP(ng/L) 4.81±2.13 1.28±0.96 10.150 <0.01 Hcy(μmol/L) 15.14±5.43 14.36±6.83 0.744 0.502 gal-3(pg/ml) 5972.42±456.31 2972.15±320.27 38.696 <0.01
2.2 急性脑梗死患者不同斑块性质实验室指标比较按斑块性质分组,本组不稳定斑块48 例,稳定斑块45 例,无斑块36 例。不稳定斑块组TC、LDL-C、hs-CRP、gal-3 高于稳定斑块组与无斑块组,稳定斑块组TC、LDL-C、hs-CRP、gal-3 高于无斑块组,差异有统计学意义(P<0.05),见表2。
2.3 不同脑梗死体积患者实验室指标比较 按梗死体积分组,本组小体积梗死37 例,中体积梗死60例,大体积梗死32 例。大体积梗死组TC、LDL-C、hs-CRP、gal-3 高于中体积与小体积梗死组,中体积梗死组TC、LDL-C、hs-CRP、gal-3 高于小体积梗死组,差异有统计学意义(P<0.05),见表3。
2.4 不同预后患者实验室指标比较 按预后分组,本组预后不良37 例,预后良好92 例。预后不良组患者血清Glu、TC、LDL-C、hs-CRP、gal-3 均高于预后良好组,差异有统计学意义(P<0.05),见表4。
2.5 脑梗死斑块性质、梗死体积、预后与gal-3 相关性分析 脑梗死斑块性质、梗死体积及预后均与gal-3 表达水平呈正相关(r=0.504、0.621、0.722,P<0.01),不稳定斑块、大体积梗死、预后不良患者gal-3 表达水平较高。
表2 急性脑梗死患者不同斑块性质实验室指标比较(±s)
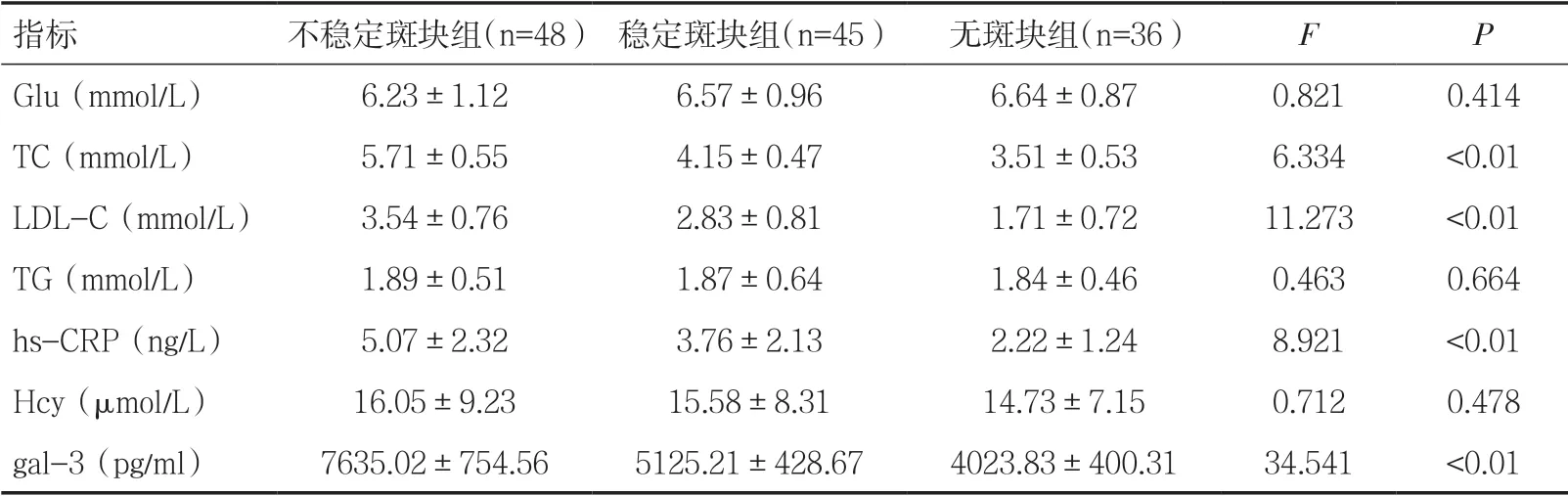
表2 急性脑梗死患者不同斑块性质实验室指标比较(±s)
指标 不稳定斑块组(n=48) 稳定斑块组(n=45) 无斑块组(n=36) F P Glu(mmol/L) 6.23±1.12 6.57±0.96 6.64±0.87 0.821 0.414 TC(mmol/L) 5.71±0.55 4.15±0.47 3.51±0.53 6.334 <0.01 LDL-C(mmol/L) 3.54±0.76 2.83±0.81 1.71±0.72 11.273 <0.01 TG(mmol/L) 1.89±0.51 1.87±0.64 1.84±0.46 0.463 0.664 hs-CRP(ng/L) 5.07±2.32 3.76±2.13 2.22±1.24 8.921 <0.01 Hcy(μmol/L) 16.05±9.23 15.58±8.31 14.73±7.15 0.712 0.478 gal-3(pg/ml) 7635.02±754.56 5125.21±428.67 4023.83±400.31 34.541 <0.01
表3 不同脑梗死体积患者实验室指标比较(±s)

表3 不同脑梗死体积患者实验室指标比较(±s)
指标 小体积梗死组(n=37)中体积梗死组(n=60)大体积梗死组(n=32) F P Glu(mmol/L) 6.38±0.71 6.41±0.63 6.42±0.54 0.347 0.257 TC(mmol/L) 3.57±0.38 4.26±0.51 5.85±0.34 6.998 <0.01 LDL-C(mmol/L) 1.66±0.58 2.97±0.77 3.52±0.36 8.415 <0.01 TG(mmol/L) 1.93±0.74 1.96±0.78 1.97±0.54 0.984 0.265 hs-CRP(ng/L) 2.21±1.22 3.87±2.15 5.12±1.78 7.227 <0.01 Hcy(μmol/L) 21.79±9.84 22.47±8.43 24.06±7.26 1.475 0.654 gal-3(pg/ml) 4027.63±360.44 5380.43±400.26 7535.41±687.45 33.672 <0.01
表4 不同预后患者实验室指标比较(±s)
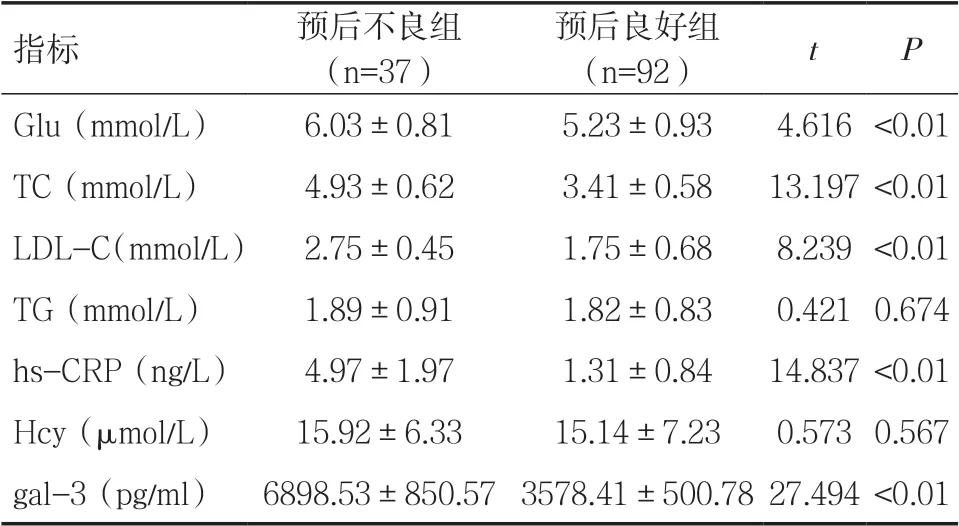
表4 不同预后患者实验室指标比较(±s)
指标 预后不良组(n=37)预后良好组(n=92) t P Glu(mmol/L) 6.03±0.81 5.23±0.93 4.616 <0.01 TC(mmol/L) 4.93±0.62 3.41±0.58 13.197 <0.01 LDL-C(mmol/L) 2.75±0.45 1.75±0.68 8.239 <0.01 TG(mmol/L) 1.89±0.91 1.82±0.83 0.421 0.674 hs-CRP(ng/L) 4.97±1.97 1.31±0.84 14.837 <0.01 Hcy(μmol/L) 15.92±6.33 15.14±7.23 0.573 0.567 gal-3(pg/ml) 6898.53±850.57 3578.41±500.78 27.494 <0.01
3 讨论
动脉粥样硬化是脑梗死的关键病理机制。动脉粥样硬化被认为是慢性炎症过程,其通过巨噬细胞吞噬黏附血管内脂蛋白颗粒、修饰性低密度脂蛋白等参与脑血管进展,促进炎症因子增殖及细胞外基质沉积[6]。gal-3 是一类26KD αβ-半乳糖蛋白,不仅参与细胞增殖、渗出、吞噬、趋化及激活等过程,同时在冠心病、心力衰竭、脑卒中等心脑血管疾病发生及进展中有重要作用。gal 家族是一类古老凝集素家族,目前已发现14 个哺乳动物凝集素,其中gal-3 是唯一一个脊柱动物半乳糖凝集素,有N-端结构域与C-端结构域[7],其中N-端结构域包含丰富的酪氨酸、脯氨酸、甘氨酸、丙氨酸等氨基酸序列,系基质金属蛋白酶的重要底物,可促进低聚物形成;C-端结构域则为糖识别结构域,可调节糖类结合位点,激活gal-3,参与抗细胞凋亡过程,同时可识别碳水化合物。gal-3 主要位于细胞质,少部分表达于线粒体、细胞核,细胞增殖期gal-3 主要表达于细胞核内,而静止期其则主要分布于细胞质内。
目前已发现gal-3 表达于成纤维细胞、子宫上皮细胞、胃肠道上皮细胞、骨细胞及部分感觉神经元、组织器官内皮细胞内[8]。有研究发现,在嗜酸性粒细胞、肥大细胞、中性粒细胞、单核细胞及巨噬细胞内均可检出gal-3 表达[9]。有研究指出,gal-3 的合成及表达与单核细胞及巨噬细胞分化密切相关[10]。也有研究表明,gal-3 是细胞到细胞外基质信号转导及作用的媒介,其在多器官形成、炎症反应、血管增生中有重要价值[11]。近年来发现,gal-3 为强大的促炎症因子信号,广泛表达于炎症细胞内,在炎症刺激下,gal-3 表达上调,可促进肿瘤坏死因子、白细胞介素-6 等促炎症因子表达上调,同时促进相关趋化因子释放,加重机体炎症反应[12]。同时gal-3 为氧化低密度脂蛋白诱导平滑肌细胞表型转化的关键因子,其可强化人体血管内皮细胞、巨噬细胞对脂质的摄取能力,同时可与低密度脂蛋白结合,抑制血管平滑肌细胞与基质糖蛋白黏附,促进血管内皮细胞增殖及转移,加快动脉粥样硬化形成。本研究发现,急性脑梗死患者其血清gal-3 表达明显高于正常健康人,且急性脑梗死患者LDL-C、TC 表达明显上调,提示gal-3 可引起急性脑梗死患者血脂指标表达异常,加重血管内皮细胞损害,促进病情进展。
此外,gal-3 可趋化血管壁单核细胞,促进巨噬细胞聚集,加快泡沫细胞形成,促进斑块沉积[13]。同时可通过交联蛋白引起信号转导,增强氧化应激反应,加重脑组织缺氧损伤[14]。本研究发现,不稳定斑块患者gal-3 明显高于稳定斑块组与无斑块组,稳定斑块组血清gal-3 水平又高于无斑块组,提示gal-3 参与脑梗死斑块形成过程。人体脑组织缺血损伤时,神经元细胞破坏,gal-3 释放增多,其可透过血-脑屏障进入血液循环,且脑组织损伤越严重,gal-3 表达越多[15]。一般情况下,gal-3 分布于脂质核心区域、钙化区域及新生血管形成区域,主要表达于斑块巨噬细胞与泡沫细胞内,因此其表达水平越高,提示斑块程度越严重。另外,脑梗死体积越大,gal-3 表达水平越高,表明gal-3 表达水平的变化与脑梗死病情严重程度密切相关。同时本研究还发现,gal-3 表达上调是提示急性脑梗死患者预后不良的主要标志,且其与hs-CRP、LDL-C、TC 等表达均有较高的一致性,一般机体炎症损伤程度高,脑梗死体积较大,且斑块越严重的脑梗死患者,其gal-3 表达水平越高,预后越差。
综上所述,gal-3 可反映急性脑梗死机体炎症状态,与动脉粥样硬化进展密切关联,且与脑梗死体积、斑块稳定程度呈正相关,可将gal-3 表达上调作为预测急性脑梗死患者预后不良的有效标志。
