丝素蛋白/壳聚糖微球制备及其抗菌性能
2019-10-29张治斌毛森贤厉巽巽陈玉霜毛青山潘志娟王晓沁
张治斌, 李 刚, 毛森贤, 厉巽巽, 陈玉霜, 毛青山, 李 翼, 潘志娟, 王晓沁
(1. 苏州大学 纺织与服装工程学院, 江苏 苏州 215123; 2. 苏州大学 现代丝绸国家工程实验室, 江苏苏州 215123; 3. 浙江真爱美家股份有限公司, 浙江 金华 322000; 4. 曼切斯特大学 材料学院, 曼切斯特 M139PL)
近年来,随着生活水平的提高,人们对纺织品的功能性越来越重视,尤其是纺织品的抗菌、抗静电、舒适性能等方面。目前,纺织品的抗菌整理剂可分为无机抗菌剂、有机抗菌剂、天然抗菌剂3种:无机抗菌剂主要分为金属元素抗菌剂[1]和光催化抗菌剂[2]2类,该类抗菌剂具有广谱抗菌、持续性好、耐热性好等特点,但其添加量大,成本高且易变色;有机抗菌剂与部分无机抗菌剂相比,其杀菌能力强,种类多,价格低廉,如季铵盐类[3]、胍类[4]和苯酚类等,但其部分抗菌剂存在毒性大,耐热性差,易水解等缺点,限制了此类抗菌剂在纺织领域的应用;更为严重的是此类抗菌剂的大量使用可能会使微生物产生耐药性,降低抗菌剂的抗菌效果,所以近年来有机抗菌剂的需求量逐渐降低。天然抗菌剂包括植物源抗菌剂和动物源抗菌剂2种,其中植物源抗菌剂来自艾蒿、茶叶、甘草等;动物源抗菌剂主要是从虾壳、蟹壳和贝壳中提取的壳聚糖[5]。
微胶囊抗菌整理技术是将抗菌药物包埋胶囊中,然后采用浸渍法或喷涂法将胶囊黏附纤维表面,使其在一定的条件下缓慢释放抗菌药物,从而达到持久的抗菌效果。这种抗菌整理常在后整理加工中使用,具有抗菌效果持久、高效、绿色环保等优点[6]。如今微胶囊技术已广泛应用于织物的防紫外线、抗菌防臭、抗静电等功能整理[7]。例如,将芦荟、壳聚糖、茶叶等天然抗菌剂包覆制成的微胶囊整理涤纶织物,不仅可使涤纶织物获得抗菌、抗静电、保健等功能,还可提高抗菌剂的耐用性。
壳聚糖(CS)是一种来源丰富、生物相容性好、抗菌性能强的天然聚合物,已被广泛地用于化妆品、医药和生物医学工程等领域[8]。壳聚糖溶液整理织物后,由于溶液中含有大量的氨基,这些氨基可与细菌中带负电的物质结合,从而抑制细菌的生长[9]。壳聚糖整理后的纺织品具有优异的抗菌性能,但其单独使用会影响织物手感且抗菌耐久性差[10]。丝素蛋白(SF)富含18种氨基酸,其中丙氨酸(Ala)、丝氨酸(Ser)和甘氨酸(Gly)约占总组成的80%以上[11]。同时,丝素蛋白具有很好的透气透湿性、缓释性和亲水性等理化性能,因此,丝素蛋白处理织物可一定程度地提高织物的吸湿性、抗静电性和舒适性[12]。本文将丝素蛋白与壳聚糖进行结合制备抗菌微球,同时分析了不同比例下丝素蛋白和壳聚糖制备微球的结构和性能,以期使壳聚糖的抗菌功能更加持久,增强纺织品的抗菌持久性。
1 实验部分
1.1 材料与仪器
桑蚕丝,嵊州市协和丝绸有限公司;乙酸、聚乙二醇(相对分子质量为10 000),国药集团化学试剂有限公司;壳聚糖,阿拉丁生化科技股份有限公司;金黄色葡萄球菌和大肠杆菌,苏州大学生命科学学院。无水碳酸钠、溴化锂,化学钝。
S-4800型扫描电子显微镜,日本Hitachi公司;Thermo Nicolet 5700 型红外光谱仪,美国尼高力仪器公司;X′Pert-Pro MRD 型X射线衍射仪,荷兰飞利浦公司;Q600热重/差示扫描量热联用仪,美国TA公司。
1.2 实验方法
1.2.1 丝素蛋白/壳聚糖微球的制备
将30 g桑蚕丝放入12 L含有25.44 g无水碳酸钠沸水中进行30 min的脱胶处理,每10 min对蚕丝搅拌1次,之后将蚕丝取出冲洗3遍,放在通风橱中干燥。将脱胶蚕丝浸入100 mL的溴化锂溶液(浓度为9.3 mol/L)中,并置于60 ℃烘箱中充分溶解,之后将得到的溶液装入透析袋在去离子水中透析36 h,然后将透析溶液进行离心处理(转速为 9 000 r/min,时间为20 min),去除杂质得到丝素蛋白溶液[13],最后对其进行高温高压灭菌处理得到无菌的丝素蛋白溶液。将壳聚糖溶解在质量分数为1%的乙酸溶液中制备壳聚糖溶液;选择丝素蛋白溶液质量分数为6%,壳聚糖溶液质量分数为3%,壳聚糖溶液与丝素蛋白溶液的体积比为1∶1、1∶2、1∶3和 1∶4,混合均匀后再加入聚乙二醇溶液,充分混合于室温下静置12 h,制备得到丝素蛋白/壳聚糖抗菌微球。
1.2.2 微球二级结构测试
取适量丝素/壳聚糖微球放入装有溴化钾的研钵中研磨均匀,压片并用红外光谱仪进行检测,检测范围为4 000~400 cm-1,分辨率为4 cm-1。
利用X射线衍射仪对丝素/壳聚糖微球的化学结构进行测试,其中衍射角范围为5°~45°,电流为30 mA,管电压为40 kV,扫描速度为6(°)/min。
1.2.3 微球表面形貌观察
通过导电胶将超声清洗的硅片黏在电镜台上,之后在硅片上滴加丝素/壳聚糖溶液,通风干燥后对其喷金处理90 s,使用扫描电子显微镜观察溶液成球性能。
1.2.4 微球的平均粒径测试
将样品的扫描电镜图片导入Image J软件中,随机选取100个微球进行测量,将测量的结果导出后用Origin绘制柱状图并计算样品的平均粒径及方差。
1.2.5 微球的热稳定性测试
取丝素/壳聚糖微球粉末5 mg装载在铝盘中,使用热重/差示扫描量热联用仪进行分析,在N2条件下进行检测,其中升温范围为40~600 ℃,升温速率为10 ℃/min。
1.2.6 微球的抗菌性能表征
按GB/T 20944.3—2008《纺织品 抗菌性能的评价第3部分:震荡法》测定丝素/壳聚糖微球的抗菌性能,检测菌种选用大肠杆菌和金黄色葡萄球菌,试样的定量抗菌活性以抑菌率表示,其计算公式为
式中:X为抑菌率,%;W为对照样培养皿上的平均菌落数;Q为丝素/壳聚糖微球培养皿上的平均菌落数。
2 结果及讨论
2.1 微球的表面形貌和尺寸分析
保持壳聚糖、丝素溶液浓度不变,改变丝素与壳聚糖的比例制备微球,其扫描电镜照片如图1所示。

图1 不同CS和SF体积比的微球扫描电镜照片
从微球的表面形态来看,CS和SF体积比为 1∶1 所制备的微球相互黏连在一起,成球性较差,聚集现象比较明显,可能是壳聚糖溶液具有一定的黏度,从而导致不规则微球间发生黏连形成块状,也有可能是丝素蛋白/壳聚糖混合液中加入聚乙二醇溶液后混合不够均匀,因此,微球无法形成规则的球体[14]。CS和SF体积比为1∶2、1∶3和1∶4所制备的微球形貌良好,其表面形态均比较平滑,规则,积聚现象缓解,分散性好。壳聚糖含量较高时所形成的微球其粒径较小,随着丝素蛋白含量的增加,所形成的微球其平均粒径逐渐变大,粒径由(0.47 ± 0.21) μm逐渐增加到(0.90 ± 0.18)μm。
2.2 微球的二级结构分析
不同CS和SF体积比的丝素蛋白/壳聚糖微球的X射线衍射光谱如图2所示。丝素蛋白silk I的主要衍射峰为12.2°、19.7°、24.7°和28.2°等;silk II的主要衍射峰是9.1°、18.9°、20.7°和24.3°[15]。从图中可以看出,空白的丝素蛋白微球主要衍射峰出现在12.2°和19.7°处,表明其主要为无定型结构,结晶较少。丝素蛋白/壳聚糖微球的主要衍射峰出现在18.9°和20.7°处,随着壳聚糖与丝素比例的降低,silk II衍射峰在18.9°处的强度明显增加。说明其结晶结构由silk I转变为silk II,这可能是壳聚糖中的酸性物质诱导丝素蛋白由无规卷曲向稳定的 β-折叠转变[16]。
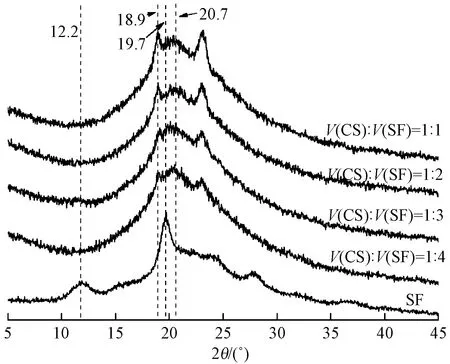
图2 不同CS和SF体积比的微球X射线衍射光谱图
丝素蛋白、壳聚糖及丝素蛋白/壳聚糖微球的红外光谱如图3所示。

图3 丝素蛋白、壳聚糖及丝素蛋白/壳聚糖微球的傅里叶变换红外光谱图
已知,β-折叠吸收峰在1 637~1 616 cm-1范围内,无规卷曲的吸收峰在1 655~1 638 cm-1范围内,α-螺旋的吸收峰在1 662~1 656 cm-1范围内[17]。由图3可知:丝素蛋白微球在 1 655 cm-1处出现特征峰,其主要以silk I结构存在;而丝素蛋白/壳聚糖微球在1 628 cm-1处出现特征峰,发生了偏移,说明丝素蛋白壳聚糖微球的结构产生了改变,由silk I结构转变为silk II结构,这种现象与XRD谱图结果显示一致;1 655和1 628 cm-1处特征峰在不同比例制备的微球中并没有发生明显的变化,说明丝素蛋白与壳聚糖的酰胺基I未解离;同时,1 155 cm-1处为壳聚糖中C—O—C吸收峰,1 094 cm-1处为壳聚糖中二级醇羟基υ(C—O)吸收峰,表明丝素蛋白/壳聚糖微球中存在壳聚糖[18]。
2.3 微球的热稳定性能分析
丝素蛋白、壳聚糖以及体积比为1∶1的丝素蛋白/壳聚糖微球的热稳定性测试结果如图4所示。可知:壳聚糖在100 ℃左右有1个质量损失峰,为壳聚糖中水分蒸发,在120~280 ℃之间未发生明显变化,之后样品的质量开始快速减少;同样,纯丝素蛋白微球在100 ℃左右有1个质量损失峰,为丝素蛋白中水分蒸发,在120~280 ℃范围未发生明显变化,继续增加温度在280~450 ℃范围内样品开始快速降解;丝素蛋白/壳聚糖微球在80 ℃左右有1个质量损失峰,为微球中水分蒸发,在100~280 ℃区间未发生明显变化,在280~380 ℃间样品开始降解,这可能主要是微球外层的丝素蛋白和水分蒸发所导致的,在380~440 ℃质量迅速流失,其主要为丝素蛋白/壳聚糖微球中壳聚糖的降解。丝素/壳聚糖微球中,壳聚糖的降解温度升高,主要是由于丝素蛋白包裹着壳聚糖,使其在温度升高的过程中外层的丝素蛋白先降解,之后包裹的壳聚糖开始降解,也进一步说明了微球起到了很好的稳定的作用。
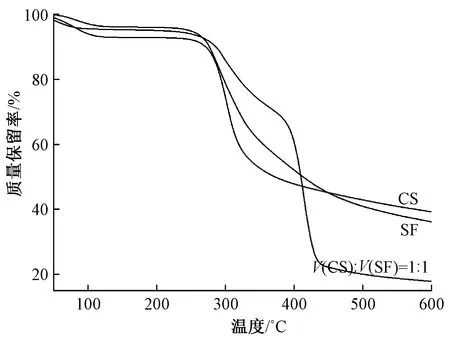
图4 丝素蛋白、壳聚糖及丝素蛋白/壳聚糖微球的热稳定性曲线
由图4可知,丝素蛋白的热稳定性优于壳聚糖,由丝素/壳聚糖微球的热稳定性曲线可以看出,第2阶段丝素蛋白的质量损失速率变缓慢,说明微球中外层丝素蛋白的稳定性优于纯丝素蛋白,这主要是由于微球中丝素蛋白的二级结构发生转变,由silk I(无定形区)结构转变为稳定silk II(结晶区)结构,进而提高外层丝素蛋白的热稳定性。当外层的丝素蛋白被降解完全后,稳定性差的壳聚糖在高温下会被充分的分解,且由微球的热稳定性曲线发生质量损失主要是由热稳定性差的壳聚糖造成的,因此,制备的丝素蛋白/壳聚糖微球的质量损失率多于壳聚糖和丝素蛋白。同时从图中还可以看出,微球的初始分解温度为280 ℃左右,可满足后期微球功能整理加工温度的要求。
2.4 微球的抗菌性能分析
采用振荡法测定了空白丝素微球和丝素蛋白/壳聚糖微球的抗菌效果,结果如图5~7所示。
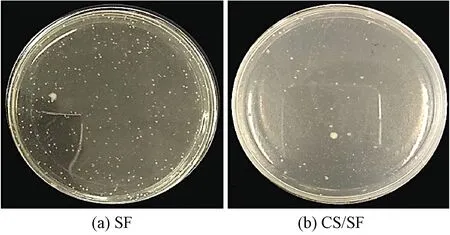
图5 SF和CS/SF微球对大肠杆菌的抗菌效果

图6 SF和CS/SF微球对金黄色葡萄球菌的抗菌效果
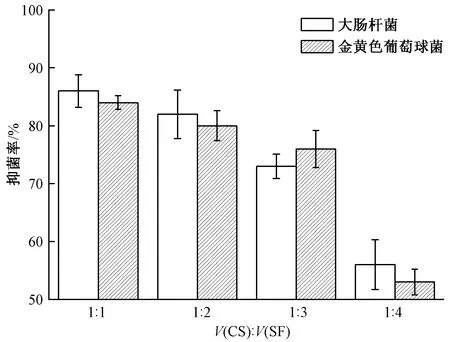
图7 不同CS和SF体积比的微球的抗菌性能
由图5、6 可以看出,大量的细菌在丝素微球培养皿中生长,表明其对金黄色葡萄球菌和大肠杆菌没有抗菌效果。而丝素蛋白/壳聚糖微球中金黄色葡萄球菌和大肠杆菌的生长呈现一定程度减少(见图5、6),当CS与SF体积比为1∶1时,制备的微球具有较强的抗菌活性,其对金黄色葡萄球菌的抑菌率为(84±1.2)%,对大肠杆菌的抑菌率为(86±2.8)%,而CS与SF体积比为1∶2所制备的微球对金黄色葡萄球菌(80±2.6)%和大肠杆菌(82±4.2)%的抑菌效果明显减小(p<0.05),并且随着二者比例的增加,微球中壳聚糖含量的减少,从而导致微球的抗菌性能减弱。壳聚糖具有一定的抗菌效果主要是由于壳聚糖大分子上的氨基在酸性条件下吸附H+形成NH3+,并与带负电的微生物细胞壁吸附,导致细胞壁溶解和破裂[19]。
2.5 微球的成球机制
丝素蛋白分子主要是由大量的亲水和疏水片段构成。丝素在有机溶剂、不同pH值和超声等外界条件下能够通过分子间自组装形成稳定的不溶于水的材料,因此,丝素中加入PEG后可以诱导其结构由silk I转变为稳定silk II结构,形成不溶于水的丝素微球。图8示出丝素/壳聚糖成球机制图。可知,当丝素中的大量疏水性氨基酸与亲水性的PEG混合时产生相分离,丝素在连续相PEG中形成分散相液滴,并且PEG将分散相中的游离水和丝素表面的结合水吸到连续相中,使失去水分子的丝素暴露疏水区,在疏水作用力下,丝素逐渐聚集并沉淀析出形成稳定的丝素微球[20],而丝素成球的过程中会将壳聚糖包裹在内部形成丝素/壳聚糖微球。
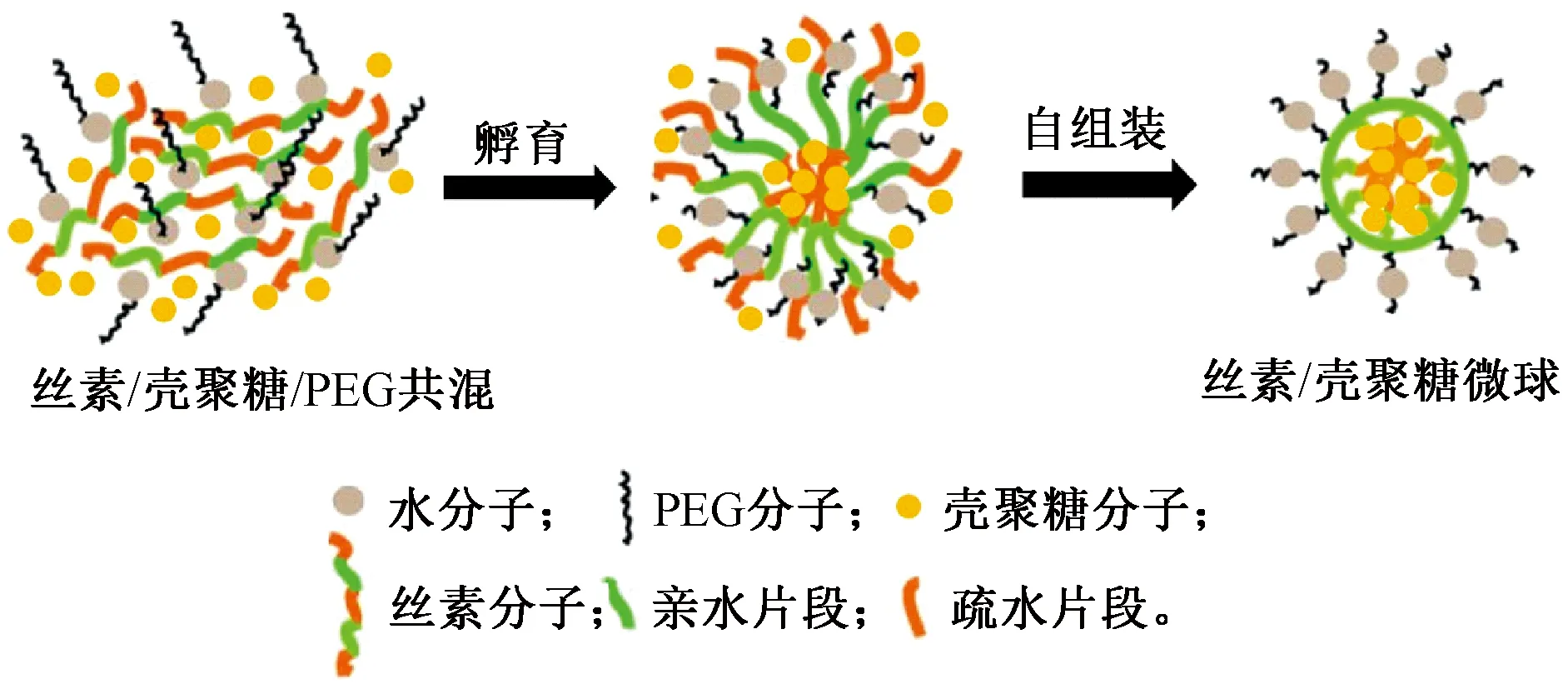
图8 丝素/壳聚糖成球机制图
3 结 论
本文制备了一种丝素蛋白/壳聚糖抗菌微球,并探讨了微球的形貌结构、二级结构、热稳定性及抗菌性能。研究结果表明:当丝素蛋白质量分数为6%,壳聚糖溶液的质量分数为3%,壳聚糖溶液与丝素蛋白溶液的体积比为1∶2,得到的微球的成形性好,表面光滑,抗菌效果较好,对大肠杆菌抑菌率为(82±4.2)%;对金黄色葡萄球菌的抑菌率为(80±2.6)%。由微球的FT-IR和XRD可知,相较于纯丝素蛋白微球,所制备的丝素蛋白/壳聚糖微球的构象发生了改变,由silk I转变为silk II。热稳定性能分析结果表明丝素/壳聚糖微球的热分解起始温度大于 250 ℃,具有良好的热稳定性。该丝素蛋白/壳聚糖抗菌微球在纺织品的后整理中具有一定的潜在价值。
