氨基糖苷类抗生素与抗菌剂不同毒性比混合对大肠杆菌的联合效应研究
2022-06-22杨越孙昊宇龙茜张跃恒林志芬印春生
杨越, 孙昊宇, 龙茜, 张跃恒, 林志芬, 印春生,*
1. 上海海洋大学海洋生态与环境学院,上海 201306
2. 污染控制与资源化研究国家重点实验室,同济大学环境科学与工程学院,上海 200092
抗菌剂是一类通过抑制病源微生物生长或代谢来治疗感染性疾病的化合物总称[1]。 由于抗菌剂具有广谱抗菌性和应用安全性等特点,被广泛应用于医疗业、农业以及畜牧业等行业[2]。 然而,抗菌剂的长期滥用导致细菌耐药性问题不断加剧,使抗菌剂的抑菌效果不断降低[3],可能对人类健康以及生态系统造成严重影响。 面对细菌耐药性的威胁,有研究人员认为将不同抗菌剂联合使用或许是控制细菌耐药性污染的重要途径之一[4]。 抗菌剂的联合使用会导致抗菌剂可能以混合污染物的形式进入生态环境中,它们之间的相互作用可能会对环境中的生物造成有别于单一抗菌剂的毒性威胁。 因此,有必要探索抗菌剂的联合毒性效应,这可以为今后抗菌剂联用诱导的环境暴露风险评估提供参考。
氨基糖苷类抗生素(aminoglycosides, AGs)是一类由单组分或多组分糖基取代的氨基环醇类化合物,具有高效、广谱的抗菌活性,已经成为治疗革兰氏阴性病原体感染的重要选择之一[5]。 随着全球抗生素耐药性问题不断恶化,AGs 在临床实践中已变得越来越重要[6]。 基于其临床使用的不可替代性[7],AGs 与其他抗菌剂的联合使用成为了抗感染研究领域的热点之一[4]。 其中,可以与AGs 联合使用的其他抗菌剂包括传统抗菌剂和新型抗菌剂。 常见的传统抗菌剂可以分为磺胺类、四环素类、大环内酯类、糖肽类和β-内酰胺类等[8],它们在农业、畜牧业和医疗业等多个领域被广泛用于治疗多种细菌感染。 新型抗菌剂则包括唑啉类、表面活性剂类和群体感应抑制剂类等类别,它们因不易产生耐药性等特点被逐渐应用于化工和食品行业,表现出较好的杀菌性能。 这些联合使用的抗菌剂主要通过医用和农用这2个途径进入生态环境中,对微生物、水生生物和人类造成潜在危害[9];同时,多种抗菌剂暴露在环境中会产生区别于单一抗菌剂的毒性效应。 那么AGs 与这些抗菌剂混合暴露在环境中又会存在怎样的环境风险?
目前有许多研究报道了AGs 与其他抗菌剂的联合效应,如 Giamarellou 等[10]研究发现 AGs 和β-内酰胺类药物对铜绿假单胞菌的联合效应表现为协同。 此外,崔洁和李志光[11]在探究甲氧苄啶与AGs对大肠杆菌的联合毒性时发现其混合暴露表现出相加的联合效应。 这些研究结果表明AGs 与抗菌剂的联合毒性效应可能与抗菌剂种类密切相关。 此外,抗菌剂以不同毒性比(毒性比是指单一抗菌剂半数最大效应浓度(EC50)的比例[12])混合也可能会导致不同的联合毒性效应,并引起不同的环境风险。 如Tian 等[13]研究氰基物质和醛类对发光菌的联合效应时发现,随着毒性比从等毒性比变为非等毒性比,混合物联合作用由协同作用变为相加作用。 Liu等[14]研究了阿莫西林和螺旋霉素对铜绿微囊藻的联合效应时发现,毒性比从等毒性比变为非等毒性比,混合物联合作用从协同作用变为了拮抗作用。 因此,有必要研究AGs 与其他不同种类抗菌剂在不同毒性比下的联合效应,为评估AGs 和其他抗菌剂不同比例混合暴露的环境风险提供依据。
大肠杆菌(Escherichia coli)具有容易获取、操作简便以及应用安全等特点,被广泛应用于细菌生理学、病毒和遗传学研究。 因此本文选择大肠杆菌作为模式生物,以磺胺类、四环素类、大环内酯类、糖肽类和β-内酰胺类抗菌剂作为传统抗菌剂的代表,以唑啉类、表面活性剂类和群体感应抑制剂类作为新型抗菌剂的代表,将这些抗菌剂与AGs 进行联合毒性实验,测定AGs 与多种抗菌剂在不同比例情况下(以1 ∶1、1∶5、5∶1 这 3 种毒性比为代表)的联合毒性效应,并对它们的联合毒性机制进行初步探讨,旨在为研究AGs与不同抗菌剂混合暴露的环境风险评估提供支撑。
1 材料与方法(Materials and methods)
1.1 试剂与生物
测试化合物中6 种AGs(硫酸庆大霉素、硫酸链霉素、硫酸新霉素、妥布霉素、硫酸卡那霉素和异帕米星)、大环内酯类(红霉素)、糖肽类抗菌剂(盐酸万古霉素)、β-内酰胺类抗菌剂(氨苄青霉素)、唑啉类抗菌剂(甲基异噻唑啉酮)以及表面活性剂类抗菌剂(十二烷基三甲基溴化铵),均购自上海阿拉丁生化科技股份有限公司(中国)。 磺胺类抗菌剂(磺胺甲恶唑)、四环素类抗菌剂(盐酸金霉素)以及群体感应抑制剂类抗菌剂(3,4-溴2(5H)呋喃酮)均购自Sigma-Aldrich化学制品有限公司(美国)。 测试抗菌剂纯度均为分析纯以上,其基本信息如表1 所示。 本实验中使用的模式生物为大肠杆菌K-12 MG1655 (Escherichia coli,E.coli),购自Biovector 生物科技有限公司(中国)。
1.2 毒性试验
1.2.1 单一毒性的测定方法
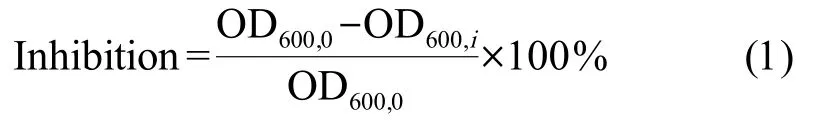
式中:OD600,0为E.coli在无染毒作用下对照组在600 nm 处的OD 平均值,OD600,i为测试抗菌剂作用下实验组在600 nm 处的OD 平均值。 单一抗菌剂对E. coli抑制率的剂量-效应关系使用Origin 软件(版本2021,OriginLab,美国)进行拟合,计算出抑制率为50%时对应的抗菌剂浓度,即为单一抗菌剂的EC50(mg·L-1)。
1.2.2 联合毒性的测定方法
根据单一化合物的EC50,配制抗菌剂A 与抗菌剂 B 在 1∶1、1∶5 和 5∶1 毒性比的混合溶液,按照单一毒性测定方法测定系列混合溶液的联合毒性,计算出EC50mix(mg·L-1)。 然后,采用毒性单位(toxicity unit,TU)法来表征联合毒性效应,TU 值的计算如下式:

式中:CA、CB是混合体系产生50%抑制效应时抗菌剂A、B 各自的浓度,EC50A和EC50B是单一抗菌剂A、B 分别作用产生50%抑制效应时的浓度。 根据Broderius 的联合毒性作用判别标准[15],当TU<0.8 认为2 组分间为协同作用;0.8≤TU≤1.2 认为2 组分间为相加作用;TU>1.2 认为2 组分间为拮抗作用。
2 结果和讨论(Results and discussion)
2.1 AGs 与测试抗菌剂对E. coli 的单一毒性作用
6 种AGs 对E. coli的单一毒性数据如表1 所示。 可以看出,测试的6 种AGs 的毒性大小较为接近,-logEC50范围为 5.71 ~6.36 mol·L-1。 AGs 的基本结构单元由一个肌醇衍生物和至少一个氨基糖组成,其余结构还包括数个自由羟基以及至少2个氨基[16]。 该结构决定着AGs 的抑菌机制(图1(a)):首先,AGs 通过被动的、非能量依赖的过程与革兰氏阴性细菌外膜中的负电荷残基静电结合;然后,AGs 通过外膜孔蛋白通道扩散并进入周质空间[17];最后,AGs 通过能量依赖阶段Ⅰ(EDP-Ⅰ)和阶段Ⅱ(EDP-Ⅱ)进入细胞质并与核糖体的30S 核糖体亚基的16S rRNA 结合以造成蛋白质的错译从而起到抑菌作用[18-19]。

表1 试剂的理化参数和单一毒性数据Table 1 The physicochemical parameters and the single toxicity data of the reagents

续表1
基于表1 中8 种测试抗菌剂的EC50,其毒性大小排序为:四环素类抗菌剂CTC>β-内酰胺类抗菌剂AMP>大环内酯类抗菌剂ERY>唑啉类抗菌剂MIT>磺胺类抗菌剂SMX>糖肽类抗菌剂VA>表面活性剂类抗菌剂DTAB>群体感应抑制剂类抗菌剂DFR。 其中毒性最大的四环素类抗菌剂 CTC 的-logEC50为7.71 mol·L-1;毒性最小的群体感应抑制剂类抗菌剂 DFR 的-logEC50为 3.83 mol·L-1。 此外,单一毒性结果还表明传统抗菌剂的毒性作用均显著强于新型抗菌剂。
所测试的8 种传统和新型抗菌剂的毒性机制按照作用位点不同可以分为以下4 类。
(1)细胞壁或细胞膜抑制类(图1(b)):糖肽类抗菌剂VA 通过与细胞壁肽聚糖的合成单体D-Ala-DAla 特异性结合,抑制细菌细胞壁肽聚糖的延伸,导致细胞死亡[20]。β-内酰胺类抗菌剂 AMP 的作用靶标是青霉素结合蛋白(PBPs),其相互作用能够抑制参与黏肽交联反应的转肽酶活性进而导致肽聚糖合成受阻,导致细胞死亡[21]。 表面活性剂DTAB 因其分子中疏水的碳氢长链容易插入到细胞膜的磷脂双分子层中,从而引起细胞膜损伤,最终导致细胞死亡[22]。
刘诚龙笔下,既有广为人知的热门人物曾国藩、左宗棠、李鸿章、翁同龢、张之洞,也有鲜为人知的冷门人物汤斌、陈廷敬;既有清官或者说好官,也有贪官乃至庸官,官场百态,或浓或淡、或明或暗呈现出来,挑拣的是文史,映照的则是现实,是竖立在反腐路上、大官小官面前的多棱镜。
(2)DNA 抑制类(图1(c)):磺胺类抗菌剂 SMX通过与对氨基苯甲酸(pABA)竞争性结合二氢叶酸合成酶(DHPS),从而阻碍DNA 复制,造成细胞死亡[23]。 唑啉类抗菌剂 MIT 主要通过与细菌体内DNA 的碱基结合形成氢键,从而破坏细胞内DNA的结构使之失去复制能力,导致细胞死亡[24]。
(3)群体感应抑制类(图1(d)):群体感应抑制剂DFR 通过与群体感应信号分子竞争性结合群体感应调控蛋白SdiA 或LsrR 蛋白,干扰细菌的群体感应,从而抑制细菌生长[25]。
(4)蛋白质合成抑制类(图1(e)):大环内酯类抗菌剂ERY、四环素类抗菌剂CTC 可以分别与细菌核糖体中的50S 亚基和30S 亚基结合,从而抑制蛋白质合成,最终导致细胞死亡[26-27]。
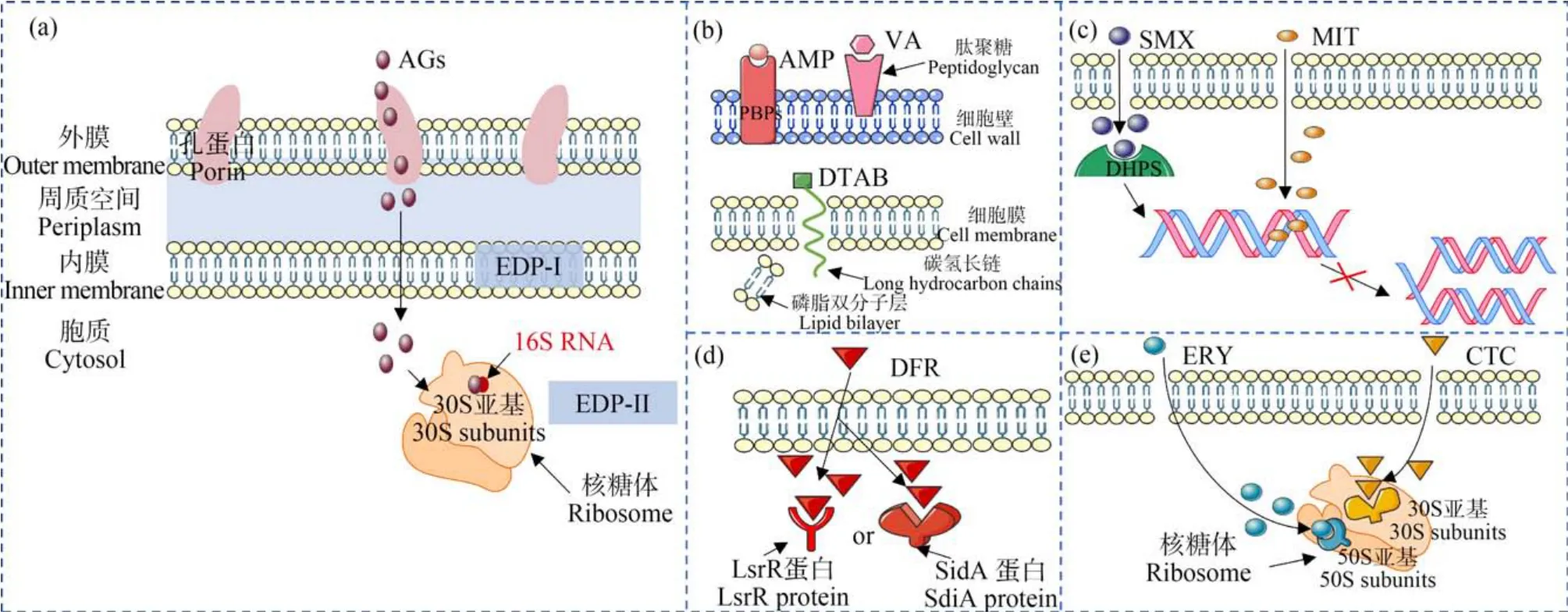
图1 AGs 及8 种测试抗菌剂的毒性机制图注:AGs 为氨基糖苷类抗生素。Fig.1 Toxic mechanism of AGs and 8 tested antimicrobial agentsNote: AGs stands for aminoglycosides.
2.2 AGs 和抗菌剂等毒性比与非等毒性比混合的联合效应
2.2.1 AGs 和传统抗菌剂等毒性比混合的联合效应
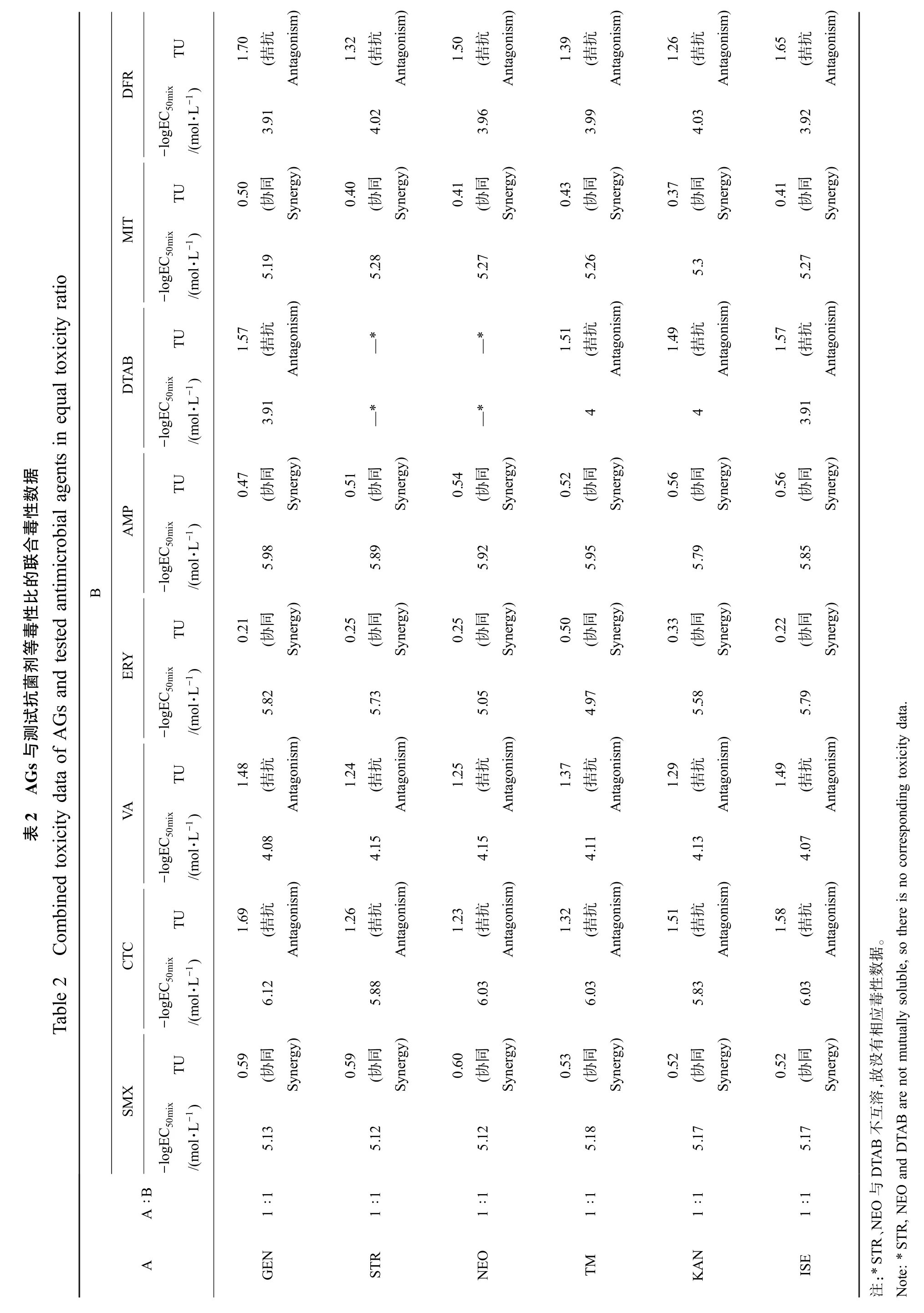
TU RDF-1)mix-logE C50/(m ol·LTU MIT-1)mix icity ratio-logE C50/(mol·L al tox TU ABDT-1)icrobial agents in equ C50 mix-logE/(mol·L据数TU性P毒AM-1)合联mix的比Gs and tested antim B -logE C50/(mol·L性毒TU等剂Y菌ER-1)抗试mix测Combined toxicity data of A -logE C50/(mol·L G s 与2 A TU VA表-1)mix-logE C50/(m ol·LTU C Table 2CT-1)mix-logE C50/(m ol·LTU XSM-1)mix-logE C50/(mol·L A ∶BA)1.70抗(拮Antagonism 3.91 0.50同(协Synergy)5.19)1.57抗(拮Antagonism 3.91 0.47同(协Synergy)5.98 0.21同(协Synergy)5.82)1.48抗(拮Antagonism 4.08)1.69抗(拮Antagonism 6.12 0.59同(协Synergy)5.131 ∶1NGE)1.32抗(拮Antagonism 4.02 0.40同(协Synergy)5.28—**—0.51同(协Synergy)5.89 0.25同(协Synergy)5.73)1.24抗(拮Antagonism 4.15)1.26抗(拮Antagonism 5.88 0.59同(协Synergy)5.121 ∶1RST)1.50抗(拮Antagonism 3.96 0.41同(协Synergy)5.27—**—0.54同(协Synergy)5.92 0.25同(协Synergy)5.05)1.25抗(拮Antagonism 4.15)1.23抗(拮Antagonism 6.03 0.60同(协Synergy)5.121 ∶1ONE)1.39抗(拮Antagonism 3.99 0.43同(协Synergy)5.26)1.51抗(拮Antagonism 4 0.52同(协Synergy)5.95 0.50同(协Synergy)4.97)1.37抗(拮Antagonism 4.11)1.32抗(拮Antagonism 6.03 0.53同(协Synergy)5.181 ∶1TM)1.26抗(拮Antagonism 4.03 0.37同(协Synergy)5.3)1.49抗(拮Antagonism 4 0.56同(协Synergy)5.79 0.33同(协Synergy)5.58)1.29抗(拮Antagonism 4.13)1.51抗(拮Antagonism 5.83 0.52同(协Synergy)5.171 ∶1NKA)1.65抗(拮Antagonism 3.92 0.41同(协Synergy)5.27)1.57抗(拮Antagonism 3.91 0.56同(协Synergy)5.85 0.22同(协Synergy)5.79)1.49抗(拮Antagonism 4.07)1.58抗(拮Antagonism 6.03 0.52同(协Synergy)5.171 ∶1E IS。有utually soluble, so there is no corresponding toxicity data.据数性毒应相,故互B are not m没 溶不AB TA DT and D与EO、N EO R, NST:*S T R注Note: *
6 种AGs 与5 种传统抗菌剂的等毒性比联合毒性数据见表2,相应的TU 分布如图2(a) (竖虚线左侧)所示。 可以看出,AGs 与磺胺类抗菌剂SMX、大环内酯类抗菌剂ERY 和β-内酰胺类抗菌剂AMP 对E. coli联合作用的TU 值均<0.8,其联合毒性效应均呈现协同作用。 基于它们的单一毒性作用机制,我们推测,AGs 作用在核糖体的30S 亚基抑制蛋白质合成,而 SMX 通过与二氢叶酸合成酶结合抑制DNA 合成,二者共同作用加速了细菌的死亡过程;ERY 能够作用于核糖体的50S 亚基上,其与AGs 具有抑制蛋白质合成的通路一致性;AMP 作用于青霉素结合蛋白(PBPs)上造成细胞壁破裂,能够促进AGs 渗入胞内发挥毒性作用。 因此,AGs 与SMX、ERY 和AMP 的联合毒性效应产生协同作用。
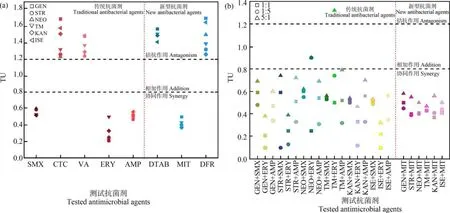
图2 AGs 与测试抗菌剂的TU 值注:(a) 等毒性比混合;(b) 非等毒性比混合。Fig.2 TU values for AGs and tested antimicrobial agentsNote: (a) The equal toxicity ratio mixing; (b) The non-equal toxicity ratio mixing.
AGs 与四环素类抗菌剂CTC 和糖肽类抗菌剂VA 对E. coli联合作用的TU 值均>1.2,其联合毒性效应呈现拮抗作用。 基于它们的单一毒性作用机制,我们推断,CTC 作用于核糖体30S 亚基上对E.coli产生抑制作用,其与AGs 具有相同的靶位点产生了特异性竞争;VA 不能穿透革兰氏阴性菌外膜,在进入细胞时将细胞膜上的孔蛋白堵塞,可能阻止AGs 进入细胞[28]。 因此,AGs 与 CTC 和 VA 的联合毒性效应呈现拮抗作用。
2.2.2 AGs 和新型抗菌剂等毒性比的联合效应
6 种AGs 与3 种新型抗菌剂的等毒性比联合毒性数据见表2,相应的TU 分布如图2(a) (竖虚线右侧)所示。 可以看出,AGs 与唑啉类抗菌剂 MIT 对E. coli联合作用的TU 值均<0.8,其联合毒性效应呈现协同作用。 基于它们的单一毒性作用机制,我们推测,AGs 作用在核糖体的30S 亚基时,抑制细菌蛋白质合成,而MIT 通过与细菌体内DNA 的碱基结合形成氢键破坏细胞内DNA 的结构,二者共同作用能够协同抑制细菌的生长。 因此,AGs 与MIT的联合毒性呈现协同作用。
AGs 与表面活性类抗菌剂DTAB 和群体感应抑制剂类抗菌剂DFR 对E. coli的联合毒性效应呈现拮抗作用。 基于它们的单一毒性作用机制,我们推断,DTAB 疏水的碳氢长链插入到细胞膜的磷脂双分子层时,能够阻止AGs 进入细胞产生毒性作用;AGs 通过抑制蛋白质合成使群体感应调控蛋白减少,降低DFR 与群体感应蛋白(SidA 或LsrR)相互作用。 因此,AGs 与 DTAB 和 DFR 的联合毒性呈现拮抗作用。
基于上述研究结果,可以看出AGs 与传统抗菌剂中的四环素抗菌剂CTC、糖肽类抗菌剂VA 以及与新型抗菌剂中的表面活性类抗菌剂DTAB 和群体感应抑制剂类抗菌剂DFR 在等毒性比下呈现拮抗作用,说明这些产生拮抗作用的混合物暴露在环境中能够降低单一抗菌剂的毒性作用,可能降低单一抗菌剂的环境风险。
AGs 与传统抗菌剂中的磺胺类抗菌剂SMX、大环内酯类抗菌剂ERY 和β-内酰胺类抗菌剂AMP 以及与新型抗菌剂中的唑啉类抗菌剂MIT 在等毒性比混合下均呈现协同作用,说明当AGs 与这些抗菌剂混合暴露在环境中时,其暴露风险大于单一抗菌剂的环境暴露风险。 那么AGs 与产生这些抗菌剂在非等毒性比作用下还可以产生协同作用吗? 这些问题还有待进一步讨论。
2.2.3 AGs 与传统抗菌剂非等毒性比混合的联合效应
AGs 与磺胺类抗菌剂SMX、大环内酯类抗菌剂ERY 和β-内酰胺类抗菌剂 AMP 在 1 ∶5 和 5 ∶1 毒性比的实验结果如表3 所示,相应的TU 分布如图2(b)(竖虚线左侧)所示,由表 3 可知,AGs 与 SMX 和 AMP对E.coli非等毒性比的联合毒性效应均呈现协同作用。 AGs 与 ERY 的结果中,硫酸新霉素(NEO)与ERY 在 1∶5 和 5∶1 毒性比混合时呈现相加作用,以及妥布霉素(TM)与ERY 在1∶5 毒性比混合作用呈现拮抗作用,其余情况下联合毒性效应均为协同作用。 此外,根据TU 值的大小(TU 值越小表明协同效果越强),可以看出毒性比的改变会影响协同效果,从表3和图2(b) (竖虚线左侧)可以看出,AGs 与SMX、ERY和 AMP 在毒性比 1∶5 时较毒性比 1∶1 和 5∶1 时呈现更好的协同作用,可能产生更大的环境暴露风险。
2.2.4 AGs 与新型抗菌剂非等毒性比的联合效应
AGs 与唑啉类抗菌剂 MIT 在 1 ∶5 和 5 ∶1 毒性比的实验结果如表3 所示,相应的TU 分布如图2(b) (竖虚线右侧)所示,由表 3 可知,AGs 与 MIT 对E. coli的非等毒性比联合毒性效应均呈现协同作用。 此外,根据TU 值的大小,可以看出毒性比的改变会影响协同效果,由表3 和图2(b) (竖虚线右侧)可知,AGs 与 MIT 在毒性比 1 ∶5 时较毒性比 1 ∶1 和5 ∶1 时呈现更好的协同作用,可能产生更大的环境暴露风险。
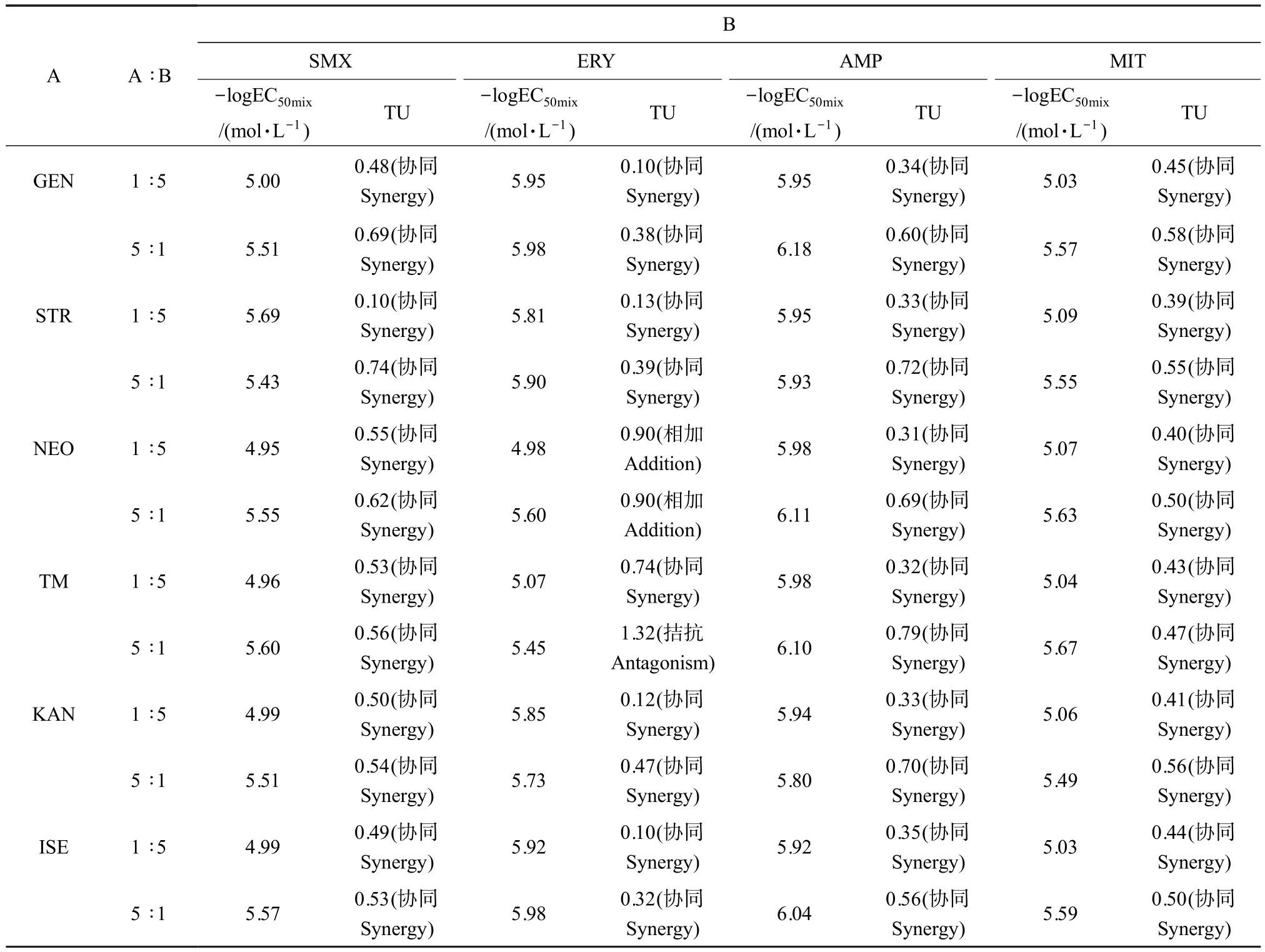
表3 AGs 与测试抗菌剂非等毒性比的联合毒性数据Table 3 Combined toxicity data of AGs and tested antimicrobial agents in non-equal toxicity ratio
基于以上研究结果,AGs 与磺胺类抗菌剂SMX、β-内酰胺类抗菌剂 AMP 和唑啉类抗菌剂MIT 在毒性比 1 ∶1、1 ∶5 和 5 ∶1 时对E.coli的联合毒性效应均呈现协同作用。 此外,AGs 与抗菌剂的毒性比为 1 ∶5 时较 1 ∶1 和 5 ∶1 时的联合暴露风险更大。 以往的研究表明,AGs 与抗菌剂联合暴露时,抗菌剂剂量增加增大了它们的联合暴露风险。 Delis 等[29]在研究体外抗菌药物相互作用时,阿米卡星和2 种氟喹诺酮类药物之间的联合毒性效应部分观察到协同作用,但在氟喹诺酮浓度增加后,协同效果更为明显;Nøhr-Meldgaard 等[30]在研究白藜芦醇与AGs 中的庆大霉素对金黄色葡萄球菌的协同作用时发现,在白藜芦醇剂量增加的情况下,会产生更好的协同效果;Mitchell 等[31]研究托马替丁与AGs 联合使用的抗菌活性时,发现它们之间的协同效果仅在托马替丁增加时更加明显。 因此,我们推测,当AGs 和与其具有协同作用的抗菌剂混合暴露时,提高混合体系中这种抗菌剂相对于AGs 的比例,可能使得AGs 与抗菌剂同时作用时AGs 更容易进入细胞并增强AGs 对细菌的毒性作用。 所以,从环境风险看,AGs 和与其具有协同作用的抗菌剂在环境中共同暴露会提升对生物体的毒性作用;此外,当抗菌剂在混合体系中相较于AGs 具有更高的比例时,其混合物的环境风险会进一步增加。
综上,本文对AGs 与抗菌剂在不同毒性比下对E. coli的联合毒性效应进行探究,研究结果总结如下:(1) AGs 与传统抗菌剂中的四环素抗菌剂CTC、糖肽类抗菌剂VA,与新型抗菌剂中的表面活性剂类抗菌剂DTAB 和群体感应抑制剂类抗菌剂DFR在等毒性比时均呈现拮抗作用。 这些产生拮抗作用的抗菌剂暴露在环境中可减弱单一毒性风险,从而降低环境风险;(2) AGs 与传统抗菌剂中的磺胺类抗菌剂SMX、大环内酯类抗菌剂ERY 和β-内酰胺类抗菌剂AMP,与新型抗菌剂中的唑啉类抗菌剂MIT在等毒性比下均呈现协同作用;(3) AGs 与SMX、AMP 和 MIT 在 1 ∶5 和 5 ∶1 毒性比时的联合毒性效应呈现协同作用,且AGs 与抗菌剂的毒性比为1 ∶5时的效果较 1 ∶1 和 5 ∶1 时的效果好。 所以,在环境风险方面,具有协同作用的AGs 与抗菌剂在环境中共同暴露时,会提高单一药物对生物体的毒性作用;同时,混合体系中抗菌剂相对于AGs 比例的提高可能会进一步增强联合暴露的环境风险,对人类健康以及生态环境造成威胁。 本研究能够为环境中AGs与抗菌剂联合暴露的风险评估提供参考与支撑。
