具有α-葡萄糖苷酶和二肽基肽酶IV 抑制作用降糖益生菌的筛选
2019-10-29闫芬芬史佳鹭岳莹雪李慧臻霍贵成
闫芬芬,史佳鹭,李 娜,岳莹雪,李慧臻,宋 月,霍贵成*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
糖尿病是一种慢性代谢性疾病,典型临床症状是高血糖,是由胰岛素缺乏、胰岛素抵抗或两者兼有而导致的[1]。国际糖尿病联盟将糖尿病分为1型糖尿病、2型糖尿病、妊娠糖尿病和其他类型的糖尿病,其中2型糖尿病患者最多,占总患病人数的85%~95%,主要与全身炎症[2]和氧化应激[3]增加有关,分子和代谢机制与β细胞功能障碍和胰岛素抵抗有关[4]。根据世界卫生组织的数据,2015年全球成人糖尿病患者人数达到4.15亿,预计到2040年这一数字将达到6.42亿。此外,糖尿病患者逐渐变得年轻化,2017年青少年糖尿病全球发病率为8%,预计到2040年将达到10%[5]。中国已成为世界上糖尿病患者人数最多的国家,糖尿病患者超过1亿。由于该疾病的复杂发病机制和众多影响因素,目前尚无有效的防治措施。
人体摄取的碳水化合物必须通过肠内的关键消化酶(α-淀粉酶和α-葡萄糖苷酶)水解成葡萄糖单体,以被人体吸收。α-葡萄糖苷酶是一种存在于小肠黏膜刷状缘的专门负责催化碳水化合物(低聚糖、二糖等)水解的水解酶[6-7]。因此,通过抑制α-葡萄糖苷酶活性降低餐后血糖已成为糖尿病临床干预的有效靶点。临床上使用的药物主要包括阿卡波糖、伏格列波糖和米格列醇。目前,研究发现一些α-葡萄糖苷酶抑制剂主要通过影响酶催化位点和模仿酶作用底物抑制该酶的活性[8-9]。阿卡波糖就是通过模仿酶作用底物治疗糖尿病[10]。此外,有一些酶抑制剂不仅具有与底物相似的结构,而且还与酶的活性位点形成共价键,从而通过这种竞争性抑制延迟碳水化合物的消化和吸收,降低餐后血糖。二肽基肽酶IV(dipeptidyl peptidase IV,DPP-IV)是一种非常稳定的细胞表面的丝氨酸蛋白酶,在肠中高表达,此外在肝脏、胰腺、胎盘、胸腺等也有表达,部分以可溶形式存在于循环血液中,从而作用于组织和器官[11]。DPP-IV可以作用于生理激素,如胰高血糖素样肽(GLP-1)、肽YY(PYY)等,从而减少其半衰期[12]。目前的研究发现,GLP-1在调节人体糖脂代谢中起重要作用。GLP-1可通过结合相应的受体来减缓胃排空,抑制食欲,增加胰岛素的分泌和降低胰高血糖素的分泌。GLP-1还可促进β细胞增殖,抑制β细胞凋亡[13]。因此,抑制DPP-IV的活性,可增加GLP-1半衰期,促进胰岛素分泌。此外,GLP-1的促胰岛素活性依赖于葡萄糖浓度,从而预防低血糖症[14]。
近年来益生菌的健康效益越来越受到人们的关注,它在健康和疾病中起着重要作用[15]。益生菌在改善免疫系统功能和预防腹泻方面具有良好的保健作用[16-17]。研究也证明益生菌具有改善炎症,降低血脂、血糖,缓解代谢综合症的作用[18]。一些动物和临床实验证实了益生菌在缓解2型糖尿病中的作用。李向菲[19]发现,产胞外多糖的乳酸菌可以降低链脲佐菌素诱导的2型糖尿病小鼠的空腹血糖、糖化血红蛋白、HOMA-IR指数、肿瘤坏死因子和白细胞介素-6,提高机体对胰岛素的敏感性,并通过细胞实验证实,乳酸菌产生的胞外多糖可以上调与GLP-1合成相关的基因的表达。Lactobacillus reuteri GMNL-263(109CFU/mL))可以显著降低糖尿病大鼠的空腹血糖、胰岛素、肝损伤标志物、脂肪组织中的白细胞介素-6和肿瘤坏死因子,改善血液和肝脏中血脂代谢,增加PPAR-γ和GLUT4基因表达,增加粪便中双歧杆菌和乳酸杆菌的数量[20]。Jayashree等[21]研究发现,受试者摄入混合多种益生菌酸奶8 周后,糖化血红蛋白、肿瘤坏死因子、白细胞介素-6显著降低。Ejtahed等[22]研究发现2型糖尿病患者摄入含有益生菌的酸奶6 周后,空腹血糖、糖化血红蛋白、氧化应激参数均降低。然而也有研究显示益生菌无论是单独食用还是作为食物添加剂食用,均不能有效地降低血糖,缓解2型糖尿病[23]。尽管目前的研究结果存在差异,但并不能排除益生菌能够缓解糖尿病的潜力。
本实验以中国传统乳制品中分离出的13 株乳酸杆菌为研究对象。前期研究发现这些菌株具有抑菌活性[24],抗氧化性能[25]以及降胆固醇[26]等功能。基于前人研究,首先根据菌株细胞代谢物(cell-free excretory supernatants,CFS)和细胞内容物(cell-free extracts,CFE)对α-葡萄糖苷酶和DPP-IV活性的抑制率进行降糖作用的筛选;在此基础上,对筛选菌株进行益生特性评价;最后通过主成分分析,从中筛选出性能最优的降糖菌株。
1 材料与方法
1.1 材料与试剂
13 株乳酸杆菌由东北农业大学乳品科学教育部重点实验室工业微生物菌种保藏中心提供,鼠李糖乳杆菌LGG ATCC 53103用作参考菌株,并已通过16S rRNA基因测序鉴定。
4-硝基苯基-D-吡喃葡糖苷(p-nitrophenyl-D-galactopyranoside,PNPG)、α-葡萄糖苷酶、甘氨酸-脯氨酸-对硝基苯胺盐酸盐 美国Sigma公司;重组人DPPIV ProSpec 艾美捷科技有限公司;diprotin A强耀生物科技公司;其余试剂均为分析纯。
1.2 仪器与设备
LDZF-50KB-II立式蒸汽灭菌器 上海申安医疗器械厂;CJ-2D超净工作台 天津泰斯特仪器有限公司;DHP-927型电热恒温培养箱 上海一恒科技有限公司;台式冷冻高速离心机 美国Sigma公司;UV-2401PC型紫外分光光度计 日本岛津公司;JY-92-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;Infinite®M1000 Pro多功能酶标仪 瑞士Tecan公司。
1.3 方法
1.3.1 菌种的活化及其菌落总数的测定
将冻存于-80 ℃甘油保藏的14 株乳酸杆菌以2%(体积分数)的接种量接种到MRS肉汤培养基中,37 ℃培养24 h,连续培养2 次,第3次培养18 h后收集菌液,并将菌液浓度调节为1×109CFU/mL。
1.3.2 样品的制备
1.3.2.1 CFS的制备
乳酸杆菌于MRS培养基中37 ℃静置培养18 h后,4 ℃、8 000 r/min离心15 min收集菌体。用无菌0.1 mol/L磷酸盐缓冲溶液(phosphate buffered saline,PBS,pH 6.8)洗涤2 次,将菌体重悬于PBS中,并将细菌浓度调至1×109CFU/mL。37 ℃孵育12 h,4 ℃、8 000 r/min离心15 min,将上清液通过0.22 μm水系微滤膜过滤以获得CFS,-80 ℃保存。
1.3.2.2 CFE的制备
乳酸杆菌在MRS培养基中于37 ℃培养18 h后,4 ℃、8 000 r/min离心15 min以收集菌体。无菌0.1 mol/L PBS(pH 6.8)洗涤2 次,菌体重悬于PBS中,将菌液浓度调至1×109CFU/mL,并在冰浴条件下超声破碎。超声破碎的条件为:功率200 W,以3 s-5 s(工作3 s,停5 s)的脉冲破碎15 min。超声后的破碎液在4 ℃、12 000 r/min离心15 min,将上清液通过0.22 μm水系微滤膜过滤以获得CFE,-80 ℃保存。
1.3.3 α-葡萄糖苷酶抑制活性的测定
按照文献[27]的方法,取96 孔微量滴定板,向反应孔中加入25 μL 2.5 mmol/L PNPG和25 μL CFS或CFE;于37 ℃孵育10 min,再加入50 μL 0.2 U/mL的α-葡萄糖苷酶;37 ℃反应15 min,最后加入100 μL 0.2 mol/L Na2CO3溶液终止反应,使用酶标仪于波长405 nm处检测反应溶液的吸光度(A)。以阿卡波糖为阳性对照,抑制率计算如式(1)所示:

式中:阳性为PNPG+PBS(0.1 mol/L,pH 6.8)+酶+Na2CO3;阴性为PNPG+PBS(0.1 mol/L,pH 6.8)+PBS(0.1 mol/L,pH 6.8)+Na2CO3;样品为PNPG+样品+酶+Na2CO3;样品空白为PNPG+样品+PBS(0.1 mol/L,pH 6.8)+Na2CO3。
1.3.4 DPP-IV抑制活性的测定
按照文献[28]的方法,取96 孔微量滴定板,在反应孔中加入25 μL 0.2 mmol/L甘氨酰-脯氨酰-对硝基苯和25 μL CFS或CFE;于37 ℃孵育10 min,再加入50 μL 0.01 U/L DPP-IV;37 ℃反应60 min,最后加入100 μL 1 mol/L醋酸钠缓冲溶液(pH 4.0)终止反应,使用酶标仪在波长405 nm处检测反应溶液的吸光度。以抑二肽素作阳性对照,抑制率计算如式(2)所示:

式中:阳性为甘氨酰-脯氨酰-对硝基苯胺+Tris-HCl buffer(100 mmol/L,pH 8.0)+DPP-IV+醋酸钠缓冲溶液;阴性为甘氨酰-脯氨酰-对硝基苯胺+Tris-HCl buffer(100 mmol/L,pH 8.0)+Tris-HCl buffer+醋酸钠缓冲溶液;样品为甘氨酰-脯氨酰-对硝基苯胺+样品+DPP-IV+醋酸钠缓冲溶液;样品空白为甘氨酰-脯氨酰-对硝基苯胺+样品+Tris-HCl buffer(100 mmol/L,pH 8.0)+醋酸钠缓冲溶液。
1.3.5 益生菌特性
1.3.5.1 酸耐受实验
4 株乳酸杆菌在MRS培养基中培养18 h,4 ℃、8 000 r/min离心15 min,收集菌体,菌体用PBS(pH 7.2)洗涤2 次,重悬于PBS。处理后的菌体分别放入pH 2.0和pH 3.0的无菌PBS中,并调整菌体的浓度至109CFU/mL,37 ℃培养0、1、2 h和3 h,取样进行菌落计数,结果表示为lg(CFU/mL)。
1.3.5.2 胆盐耐受实验
根据文献[29]的方法,4 株乳酸杆菌以2%接种量,接种于MRS(含有0.3%胆盐)培养基中,37 ℃条件下连续培养8 h,每隔1 h检测波长620 nm处的吸光度,并将不含有胆盐的MRS作为对照。胆盐耐受能力用含有0.3%胆盐MRS的营养肉汤中,A620nm达到0.3 个单元所需的时间与不加胆盐的MRS的营养肉汤所需时间的差值表示。
1.3.5.3 疏水性实验
根据文献[30]的方法,将乳酸杆菌以2%接种量接在MRS液体培养基中,并在37 ℃培养24 h,以同样的方式培养3 代,4 ℃、8 000 r/min离心10 min,收集18 h的菌体,用无菌的PBS(pH 7.4)冲洗2 次,最后悬浮于PBS(pH 7.4)中。将菌液的浓度调至1×108CFU/mL,并检测波长600 nm处的OD值。取3.0 mL菌悬液分别与1.0 mL二甲苯、氯仿、乙酸乙酯混合,旋涡振荡2 min后室温静置30 min,出现分层,小心吸取水层,600 nm波长处测定水相的OD值,实验重复3 次,根据式(3)计算疏水性:

1.3.6 主成分分析
首先筛选具有高α-葡萄糖苷酶和DPP-IV抑制活性的菌株,然后对筛选菌株的α-葡萄糖苷酶和DPP-IV抑制活性、酸耐受性、胆盐耐受性、细胞疏水性指标进行主成分分析,以期筛选出性能最优的降糖菌株。
1.4 数据统计分析
应用SPSS 17.0进行数据处理,显著性分析和主成分分析,Origin 9.0进行绘图分析。
2 结果与分析
2.1 具有α-葡萄糖苷酶抑制活性菌株的筛选

表1 乳酸杆菌对α-葡萄糖苷酶活性的抑制率Table 1 α-Glucosidase inhibitory rate of Lactobacillus
如表1所示,14 株乳酸杆菌的CFS对α-葡萄糖苷酶具有不同的抑制作用,抑制率为0%~12.13%。其中嗜酸乳杆菌KLDS1.0901、KLDS1.1003和参考菌株LGG的CFS显示出更好的抑制活性,分别为12.13%、10.29%和10.89%,显著高于其他菌株(P<0.05)。鼠李糖乳杆菌KLDS1.0205、植物乳杆菌KLDS1.0318、KLDS1.0344、KLDS1.0386和德式乳杆菌保加利亚亚种KLDS1.0207对α-葡萄糖苷酶活性无抑制作用。所有受试乳酸杆菌的CFE未显示出对α-葡萄糖苷酶的抑制作用。
2.2 具有DPP-IV酶抑制活性菌株的筛选
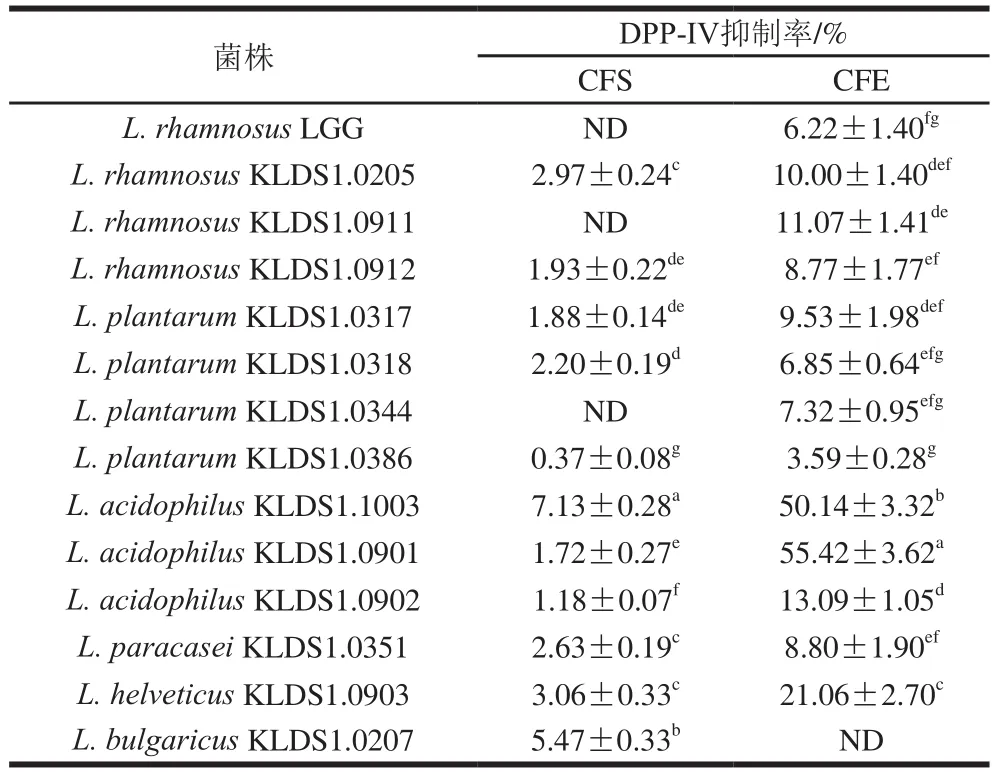
表2 乳酸杆菌对DPP-IV活性的抑制率Table 2 DPP-IV inhibitory rate of Lactobacillus
由表2可以看出,14 株乳酸杆菌的CFS对DPP-IV表现出不同的抑制效果,抑制率为0%~7.13%。其中嗜酸乳杆菌KLDS1.1003和德式乳杆菌保加利亚亚种KLDS1.0207的CFS显示出较好的抑制活性,两者分别为7.13%和5.47%,显著高于其他菌株(P<0.05)。鼠李糖乳杆菌KLDS1.0911、植物乳杆菌KLDS1.0344和参考菌株LGG的CFS对DPP-IV无抑制作用。CFE对DPP-IV的抑制率为0%~55.42%,嗜酸乳杆菌KLDS1.0901具有最高的抑制率55.42%,其次是嗜酸乳杆菌KLDS.1003,抑制率为50.14%,参考菌株LGG抑制率为6.22%。
2.3 益生菌特性分析
2.3.1 益生菌的酸耐受性

图1 乳酸杆菌对pH 2.0和pH 3.0的酸耐受性Fig. 1 Viability of three selected strains at pH 2.0 or 3.0
由图1可知,3 株受试菌株和1 株参考菌株对pH 3.0具有较强的耐受性,并且可以存活3 h。在pH 2.0的酸性条件下孵育1 h后,所有菌株的活菌数显著下降;孵育2 h后,嗜酸乳杆菌KLDS1.0901和KLDS1.0902有存活菌数;孵育3 h后,仅有嗜酸乳杆菌KLDS1.0901有存活率。与所有其他菌株相比,嗜酸乳杆菌KLDS1.0901的酸耐受最强。
2.3.2 益生菌的胆盐耐受性
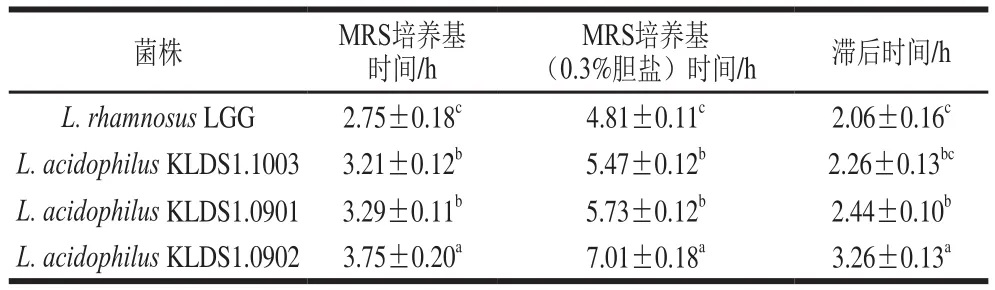
表3 乳酸杆菌的胆盐耐受性Table 3 Effect of bile on the growth rate of selected strains
从表3可以看出,4 株乳酸杆菌能够在含0.3%胆盐的MRS培养基中生长。其中菌株LGG的胆盐耐受性最好,滞后时间最短为2.06 h,嗜酸乳杆菌KLDS1.0902对胆盐的耐受能力最差,滞后时间最长为3.26 h,但嗜酸乳杆菌KLDS1.1003和LGG差异不显著(P>0.05),说明嗜酸乳杆菌KLDS1.1003和LGG更能耐受肠道胆盐环境。
2.3.3 益生菌的疏水性

图2 乳酸杆菌的表面疏水性Fig. 2 Cell surface hydrophobicity of selected strains
图2 为4 株乳酸杆菌在二甲苯、乙酸乙酯和氯仿3 种有机溶剂中疏水性的结果。在二甲苯溶剂中,嗜酸乳杆菌KLDS1.1003和KLDS1.0901的疏水性较高,疏水率分别为134.33%和130.58%,而LGG具有最低的疏水性。在乙酸乙酯溶剂中,嗜酸乳杆菌KLDS1.0901的疏水性最高,显著高于其他菌株(P<0.05)。在氯仿溶液中,嗜酸乳杆菌KLDS1.1003具有最高的疏水性,疏水性为344.08%。通常,高疏水性的菌株对细胞具有强黏附性,疏水性实验结果显示,嗜酸乳杆菌KLDS1.1003具有较好的疏水性,该菌株可能具有较强的黏附能力。
2.3.4 主成分分析
图3A为各个特性在各主成分中占的载荷分布图。第1主成分可以解释4 个特性:其成分载荷分别为酸耐受性0.982、CFE对DPP-IV的抑制性0.920、在乙酸乙酯中的疏水性0.867、在二甲苯中的疏水性0.845;第2主成分主要解释3 个特性:胆盐耐受性-0.787、在氯仿中的疏水性0.785、CFS对DPP-IV的抑制性0.726、CFS对α-葡萄糖苷酶的抑制性0.564。
图3B展示了所选益生菌的分布,根据图3B和表4可以看出,嗜酸乳杆菌KLDS1.1003的综合得分最高,为1.21,明显高于其他3 种菌株,LGG的综合得分最低。该结果表明嗜酸乳杆菌KLDS1.1003可用作潜在的降糖益生菌。
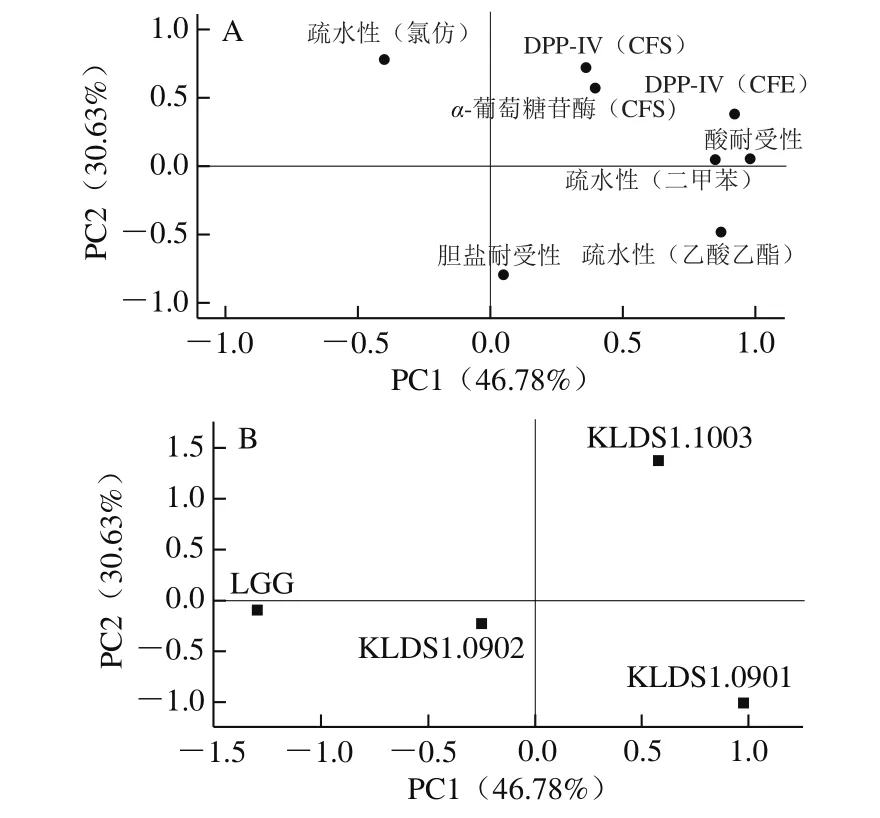
图3 主成分分析的因子载荷图(A)和因子得分图(B)Fig. 3 Loadings and scores plots of principle components analysis

表4 因子得分Table 4 Scores of fi rst two principal components
3 讨 论
以实验室保藏的13 株乳酸杆菌为研究对象,从菌株的CFS和CFE分析菌株对α-葡萄糖苷酶和DPP-IV的抑制活性,以期筛选出能够通过抑制α-葡萄糖苷酶和DPP-IV活性而发挥降糖作用的益生菌。糖尿病的典型临床症状为高血糖。因此,在糖尿病早期阶段控制糖尿病患者的餐后血糖尤为重要。通过抑制人体糖代谢吸收的关键酶(α-葡萄糖苷酶)的活性,减少葡萄糖的吸收,从而降低餐后高血糖的影响。目前,临床上常见的α-葡萄糖苷酶抑制药物对人体有不可忽视的副作用。因此,近年来关于植物多糖[31]、黄酮[32]等天然物质对α-葡萄糖苷酶抑制作用的研究增多。本实验研究了乳酸杆菌对α-葡萄糖苷酶的抑制作用,结果表明,多数菌株的CFS对α-葡萄糖苷酶具有抑制作用,尤其是嗜酸乳杆菌KLDS1.0901和KLDS1.1003的抑制率达到了10%及以上,抑制作用明显,并且与参考菌株LGG无显著差异。然而,包括参考菌株在内的所有受试菌株的CFE都没显示出α-葡萄糖苷酶抑制作用。田芬等[33]研究发现,77 株益生菌中仅有13 株菌的CFS对α-葡萄糖苷酶有抑制作用,所有菌株的CFE对该酶没有抑制作用,与本研究结果一致。Zeng Zhu等[34]发现,当菌液浓度为1×1010CFU/mL时,LGG的CFS和CFE对α-葡萄糖苷酶具有一定的抑制活性,抑制率分别为28.3%和2.5%;菌株ZF06-3、IF13和IF2-17的CFS对α-葡萄糖苷酶的抑制率分别为34.9%、28.0%和18.7%,但是3 株菌的CFE均未表现出抑制作用,与本实验研究结果相同。本实验最终筛选得到的嗜酸乳杆菌KLDS1.1003的CFS的α-葡萄糖苷酶抑制活性为12.13%,该结果低于Zeng Zhu等[34]的结果,可能是由菌浓度较低导致的。此外,嗜酸乳杆菌KLDS1.1003的CFS的酶抑制率与商业菌株LGG无显著差异(P>0.05)。目前,研究发现乳酸菌产生的胞外多糖能够抑制α-葡萄糖苷酶活性[35]。此外,有研究显示一些小分子肽也可以抑制α-葡萄糖苷酶的活性[36]。
DPP-IV抑制实验结果显示,11 株乳酸杆菌的CFS对DPP-IV有抑制作用,而商业菌株LGG未表现出抑制作用。除菌株KLDS1.0207外,其他菌株的CFE均表现出不同的DPP-IV抑制活性,并且有6 株乳酸菌的抑制率高达10%及以上,抑制作用明显。此外,CFE的酶抑制率普遍高于CFS。Zeng Zhu等[34]研究发现LGG的CFS对DPPIV的抑制率为9.2%,CFE的抑制率为14.6%;其他受试菌株也都表现出不同的酶抑制活性,CFE的抑制率普遍高于CFS,这与本实验研究结果相同。此外,进一步研究发现CFS对酸碱、温度不敏感,但是对蛋白酶敏感,CFS经蛋白酶处理后酶抑制活性增大,说明可能是CFS中的蛋白或肽类物质发挥作用。本实验筛选得到的最优菌株为嗜酸乳杆菌KLDS1.1003,CFS的DPP-IV抑制率为7.13%,与Zeng Zhu等[34]的结果相比其抑制率较低,这可能与菌液浓度和DPP-IV的来源有关。Lacroix等[37]比较研究了一些食源蛋白的天然肽序列对猪和人源DPP-IV的抑制特性,结果显示,不同天然肽表现出的抑制活性在两种酶间有显著差异。张颖[38]研究发现合成肽对猪源DPPIV的抑制作用比对人源DPP-IV更加敏感。
为保证所选益生菌能够有效发挥降糖作用,本研究又对酶抑制性较好的菌株进行了益生特性的评价。在酸耐受实验中,选择pH 2.0和pH 3.0进行了研究,嗜酸乳杆菌KLDS1.1003、KLDS1.0901、KLDS1.0902和LGG在pH3.0的酸性条件下均有较高的存活率,在pH 2.0的酸性条件下孵育3 h,仅菌株KLDS1.0901能够部分存活。Matsumoto等[39]研究发现菌株的耐酸能力大小与菌株的H+-ATP酶活性有关。因此,嗜酸乳杆菌KLDS1.0901的酸耐受性很可能与该酶活性有关。在胆盐耐受性实验中,在0.3%胆盐条件下,4 株菌的生长滞后时间不一,其中商业菌株LGG的胆盐耐受性最好,滞后时间为2.06 h,其次为嗜酸乳杆菌KLDS1.1003,但二者差异不显著(P>0.05)。有研究报道显示,有些乳酸菌能够调节一些主要负责保持细胞膜完整性基因的表达,从而增强胆汁盐耐受性[40]。此外,某些乳酸菌能够通过胆盐水解酶水解胆汁盐降低胆盐的影响[41]。在疏水性实验中,各菌株间有所差异,嗜酸乳杆菌KLDS1.0901和KLDS1.1003的疏水性明显高于菌株LGG和KLDS1.0902。
4 结 论
本研究所筛选出的具有高α-葡萄糖苷酶和DPP-IV抑制活性的菌株为嗜酸乳杆菌KLDS1.1003、KLDS1.0901和KLDS1.0902,而它们的益生特性有所不同。主成分分析对α-葡萄糖苷酶、DPP-IV抑制率及益生特性进行综合评估,结果表明嗜酸乳杆菌KLDS1.1003的得分最高,具有良好的耐受性和降糖潜力。
