氧化强度对肌原纤维蛋白结构及凝胶性能的影响
2019-10-29曹云刚马文慧艾娜丝闫林林赵倩倩闵红卫黄峻榕
曹云刚,马文慧,艾娜丝,闫林林,赵倩倩,闵红卫,白 雪,黄峻榕,*
(1.陕西科技大学食品与生物工程学院,陕西 西安 710021;2.北京工商大学 北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京 100048;3.中国林业科学研究院林产化学工业研究所,江苏 南京 210042)
国民经济和社会发展统计公报显示,2017年我国猪牛羊禽肉产量达8 431万 t,其中猪肉产量为5 340万 t,肉制品加工业已成为我国食品加工业的重要组成部分。在肉及肉制品的加工和贮藏过程中蛋白氧化无法避免,氧化会诱导蛋白结构发生变化,进而影响其功能特性及消化率,最终影响肉及肉制品的品质[1-3],给企业带来巨大的经济损失。肉蛋白的热诱导凝胶特性是肉糜制品加工的基础,直接关系到肉制品的品质[3]。氧化对于蛋白质凝胶性能的影响是近年研究热点,但现有研究报道并不一致。李学鹏[4]和李银[5]等的研究结果表明适度氧化并未改善肉蛋白的凝胶性能。相关研究发现适度氧化能提高肉蛋白凝胶性能[3,6-7],但这些研究均认为过度氧化会严重损害蛋白凝胶性能。可见,蛋白氧化程度与其凝胶性能改变之间的关系有待进一步系统研究。
已有研究认为,与脂肪氧化类似,蛋白质的氧化也是一个自由基链式反应过程[1-3]。肉制品中常见的蛋白氧化体系主要有3 种:羟自由基氧化体系、脂肪氧化产物诱导的氧化体系和高铁肌红蛋白氧化体系[2],其中羟自由基氧化体系是肉制品加工中最普遍存在的一种氧化体系,羟自由基也是活性氧自由基中氧化能力最强的自由基[2]。肌原纤维蛋白(myofibrillar protein,MP)占整个肌肉蛋白含量的55%~60%,对肉制品的凝胶性能及感官品质起着决定性作用[3]。因此,本研究借助芬顿体系(FeCl3-VC-H2O2)构建羟自由基模拟氧化体系,探究不同氧化强度下,MP氨基酸侧链修饰、蛋白构象、蛋白交联和聚集行为以及蛋白热诱导凝胶性能的变化,探究蛋白氧化程度、结构变化和凝胶性能变化之间的内在联系,为深入了解蛋白氧化机制、有效调控蛋白氧化程度、提高肉品品质提供理论参考。
1 材料与方法
1.1 材料与试剂
猪外脊肉(longissimus lumborum)购于当地超市,置于冰盒中运回实验室后剔除可见脂肪组织,垂直于肌纤维走向切成约100 g的肉排,真空包装后置于-18 ℃冷冻备用。
水溶性VE(Trolox) 美国Sigma-Aldrich公司;2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonic acid,TNBS) 美国Ark Pharm公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 上海源叶生物科技有限公司;5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithio-bis-(2-nitrobenzoic acid),DTNB)上海麦克林生化科技有限公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、哌嗪-N,N’-双(2-乙磺酸)(piperazine-N,N’-bis(2-ethanesulfonic acid),PIPES)、二硫苏糖醇(dithiothreitol,DTT)、30%丙烯酰胺-甲叉双丙烯酰胺(29∶1,V/V)溶液、过硫酸铵(ammonium persulfat,APS) 生工生物工程(上海)股份有限公司;30% H2O2、FeCl3、抗坏血酸、2-硫代巴比妥酸(2-thiobarbituric acid,TBA)(均为分析纯) 天津市科密欧化学试剂有限公司。
1.2 仪器与设备
HR/T20MM立式高速冷冻离心机 湖南赫西仪器装备有限公司;CP213电子天平 奥豪斯仪器(常州)有限公司;PHS-25型数显pH计 上海仪电科学仪器股份有限公司;微量移液器 赛多利斯科学仪器(北京)有限公司;UV2900紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;TA.Plus物性测试仪 英国Stable Micro System公司;Fluoro Max-4 荧光分光光度计日本Horiba公司;Mini-PROTEAN 3 Cell电泳仪 美国Bio-Rad公司;CM-5分光测色计 柯尼卡美能达(中国)投资有限公司。
1.3 方法
1.3.1 MP的提取
参照Park等[8]的方法。将猪外脊肉去除脂肪、结缔组织等后切成小条称质量,置于组织捣碎机中并加入4 倍体积的僵直液(0.1 mol/L NaCl、2 mmol/L MgCl2、10 mmol/L Na3PO4、1 mmol/L乙二醇-双-(2-氨基乙醚)四乙酸、pH 7.0),匀浆捣碎(15 s、4 次)后离心(2 000×g,15 min,4 ℃)。所得沉淀再次加入4 倍体积僵直液,重复上述步骤共3 次。此时所得沉淀加入4 倍体积0.1 mol/L NaCl溶液,匀浆搅拌后经4 层纱布过滤,用0.1 mol/L HCl溶液将滤液pH值调至6.25,再次离心后所得沉淀即为MP。全部提取过程保持在0~4 ℃之间,所得蛋白膏置于塑料离心杯于碎冰中保存,并于48 h内使用。以牛血清白蛋白为标准,采用双缩脲法测定蛋白浓度。
1.3.2 MP的氧化处理
参考Cao Yungang等[9]的方法,用15 mmol/L pH 6.25的PIPES缓冲液(含0.6 mol/L NaCl)将MP蛋白膏稀释为45 mg/mL。分别加入不同强度氧化体系,最终体系蛋白质量浓度为30 mg/mL,氧化体系为10 µmol/L FeCl3、100 µmol/L抗坏血酸,0、0.5、1、3、5、10 mmol/L H2O2。所有样品均置于4 ℃氧化12 h。氧化反应通过添加Trolox(终浓度1 mmol/L)终止。未添加氧化体系的蛋白溶液作为空白对照。
1.3.3 脂肪氧化测定
不同处理引起的脂肪氧化采用硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)法测定[10]。称取约2 g蛋白样品于玻璃试管中并准确记录质量,分别加入1.5 mL TBA和8.5 mL TCA 溶液,混匀后于100 ℃水浴反应30 min后取出,放入冷水浴中冷却至室温。通风橱下,移取5 mL上清液至离心试管中,加入5 mL氯仿,密封混匀,3 500 r/min离心10 min后转移3 mL上层液体至一套新的离心管内,加入1.5 mL石油醚,混匀并离心后,转移2 mL下层清液于试管后,于532 nm波长处测定吸光度。空白试剂以2 mL 15 mmol/L PIPES溶液替代蛋白样品溶液。单位以每千克蛋白样品质量计。TBARS值按式(1)计算:

式中:ABS为扣除试剂空白后532 nm波长处的吸光度;m为样品质量/g。
1.3.4 活性氨基酸残基修饰程度分析
羰基含量:采用DNPH法进行测定[10],采用摩尔消光系数22 000 L/(mol•cm)进行计算;总巯基含量:按照Cao Yungang等[11]的方法,采用DTNB法进行测定;NH3含量:利用TNBS试剂测定;自由氨基含量:参照Adler-Nissen[12]的方法经过适当调整后进行测定;样品自由氨基含量通过L-亮氨酸制作的标准曲线确定。其中,羰基、总巯基、自由氨基含量以每毫克蛋白样品物质的量计(nmol/mg)。
1.3.5 蛋白构象变化分析
内源性色氨酸荧光测定:用15 mmol/L PIPES缓冲液(含0.6 mol/L NaCl,pH 6.25)将样品稀释为0.4 mg/mL,利用Fluoro Max-4荧光分光光度仪于283 nm激发,记录290~400 nm的发射光谱,激发和发射狭缝宽度均设置为1.5 nm。相同条件下记录溶剂发射光谱,并从样品发射光谱中扣除以排除干扰。
表面疏水性:采用经典的ANS荧光探针技术进行表征,参照Hayakawa等[13]的方法并略作修改进行测定。用15 mmol/L PIPES缓冲液(含0.6 mol/L NaCl,pH 6.25)将样品稀释为蛋白质量浓度为0.1、0.2、0.3、0.4 mg/mL和0.5 mg/mL的一系列蛋白稀释液。准确吸取25 μL 8.0 mmol/L的ANS溶液(溶解于pH 8.2的磷酸盐缓冲液)加入5.0 mL蛋白稀释液中,试剂空白吸取25 μL pH 8.2的磷酸盐缓冲液加入到5.0 mL蛋白稀释液中,涡旋混匀。避光反应15 min后进行荧光测定,激发和发射波长分别设定为390 nm和450 nm,狭缝宽度均设置为5 nm。试剂空白在分析数据时扣除。荧光强度对蛋白质量浓度作图所得斜率为表面疏水性指数(So)。
溶解度测定:用15 mmol/L PIPES缓冲液(含0.6 mol/L NaCl,pH 6.25)将蛋白样品稀释为2 mg/mL,5 000×g、4 ℃离心15 min。上清液蛋白质量浓度(双缩脲法测定)占2 mg/mL的百分比即为溶解度,按式(2)计算:

十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)参考Laemmli[14]的方法适当调整。氧化诱导的蛋白交联和聚集分别在还原和非还原条件下采用SDS-PAGE分析,浓缩胶和分离胶分别选用4%和12%,每孔上样量25 µL。染色脱色后拍照并对电泳条带进行分析。
1.3.6 MP凝胶性能测定
热诱导凝胶制备:准确称取5 g MP溶胶样品置于小玻璃瓶中,用保鲜膜轻轻密封后,置于水浴锅中,以1 ℃/min从20 ℃加热至75 ℃,并在75 ℃保温10 min。取出放入冰水浴中冷却30 min后置于4 ℃冰箱过夜。测定凝胶性能前,需将凝胶样品在室温下平衡2 h。
蒸煮损失测定:用小铲将凝胶轻轻地与小玻璃瓶壁分开(避免瓶壁的牵引力),倒置于滤纸上20 min,待蒸煮汁液流尽后称量凝胶质量[15]。蒸煮损失按式(3)计算:

凝胶白度测定:参照Xia Xiufang等[16]方法略作修改。分光测色计经自检及零点、白板校正后,进行样品测定。每个样品3 组平行,取平均值。凝胶白度值按式(4)计算:

式中:L*为亮度值;a*为红度值(正值表示偏红,负值表示偏绿);b*为黄度值(正值表示偏黄,负值表示偏蓝)。
凝胶强度测定:样品凝胶强度用TA-XT Plus物性分析仪进行测定。测定模式:测前速率5 mm/s;测中速率1 mm/s;测后速率5 mm/s;下压距离8 mm;探头型号P/0.5。凝胶强度定义为刺破凝胶所需的初始压力(N)[17]。
1.4 数据统计
本研究中所有实验均设置2~3 次重复(不同日期),使用Statistix 9.0分析软件的一般线性模型程序进行方差分析,采用最小显著差法全配对多重比较进行显著性分析(P<0.05),借助SPSS软件进行各指标之间的相关性分析,采用SigmaPlot 12.5软件进行数据绘图。
2 结果与分析
2.1 H2O2浓度对MP中脂肪氧化的影响
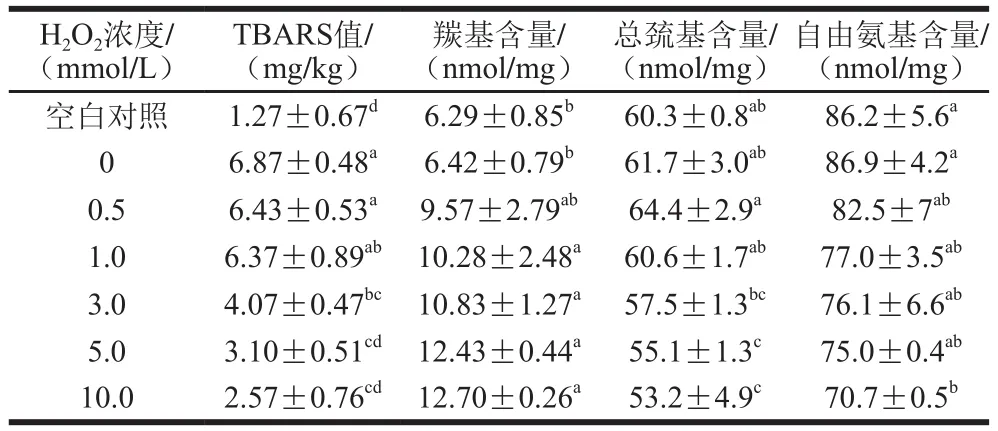
表1 氧化强度对脂肪和蛋白氧化的影响Table 1 Effects of different oxidation degrees on lipid and protein oxidation
本研究所用方法提取的MP中不可避免会含有少量脂肪。Xiong Youling等[18]研究发现,MP中残余脂肪约占其干质量的0.49%,主要来源于肌肉细胞膜中的磷脂。由于磷脂富含不饱和脂肪酸极易发生氧化,从而生成醛、酮、醇、酸等物质,其中的醛类等活性物质可进一步与蛋白氨基酸侧链发生化学反应,诱导蛋白质氧化。因而评价不同氧化强度处理对脂肪氧化的影响对于分析其对蛋白氧化的影响意义重大。TBARS法主要用于脂肪次级氧化产物(如丙二醛等)含量的测定,因而在本研究中被选用于脂肪氧化程度评价。
如表1所示,空白对照样品的T B A R S值约为1.27 mg/kg,添加Fe3+和VC(H2O2浓度为0.0 mmol/L)样品的TBARS值上升至约6.87 mg/kg,说明Fe3+和VC可以诱导脂肪氧化。王燕荣[19]研究发现在各种包装(真空、高氧气调和低氧气调)条件下VC都有促进冷却肉中脂肪氧化的作用,这可能与肉中含有金属离子(如Fe3+等)有关。杨念[20]研究发现2 mg/kg Fe3+明显降低BHT在鸡油中的抗氧化性,这可能与Fe3+自身的促氧化性有关。添加芬顿体系(Fe3+、VC和H2O2)的样品,当H2O2浓度为0.5 mmol/L和1.0 mmol/L时,其TBARS值均在6.0 mg/kg以上,但此后随H2O2浓度升高TBARS值呈下降趋势,这可能是强氧化条件下脂肪氧化生成的醛类物质与蛋白质氨基酸侧链发生了共价结合。章银良等[21]研究发现蛋白与氧化脂肪结合导致体系中TBARS值下降,同时蛋白羰基含量升高。
2.2 H2O2浓度对MP氨基酸侧链修饰的影响
蛋白质中羰基含量是蛋白氧化的重要指标,一般来说,羰基含量越高代表蛋白氧化程度越高。如表1所示,空白对照样品的羰基含量为6.29 nmol/mg,与李学鹏等[4]报道的未氧化草鱼MP羰基含量基本一致(5.37 nmol/mg)。但李银等[5]研究发现未氧化猪肉MP羰基含量约为1.17 nmol/mg,与本研究结果差异较大,这可能与实验用肉来源等不同有关。添加Fe3+和VC(H2O2浓度为0.0 mmol/L)样品的羰基含量为6.42 nmol/mg,与空白对照相比无显著性差异(P>0.05)。值得注意的是相同处理导致样品的TBARS值急剧上升,但蛋白羰基、总巯基和自由氨基含量无显著变化(表1),说明脂肪氧化与蛋白氧化并不同步。添加芬顿体系(Fe3+、VC和H2O2)的样品,随着H2O2浓度的增加,MP羰基含量呈现上升趋势(P<0.05)。当H2O2浓度为10.0 mmol/L时,蛋白羰基含量升至12.70 nmol/mg,与空白对照组相比增加了102%。与本实验结果类似,前人研究发现猪肉MP羰基含量随芬顿体系H2O2浓度增加而显著上升[3,10,22]。
MP富含巯基,暴露于氧化条件下易转化为二硫键(—S—S—)导致巯基含量降低,因而巯基含量是蛋白氧化的重要指标。如表1所示,空白对照样品的总巯基含量约为60.3 nmol/mg,添加Fe3+和VC(H2O2浓度为0.0 mmol/L)样品的总巯基含量约为61.7 nmol/mg,二者之间无显著性差异。添加芬顿体系(Fe3+、VC和H2O2)的样品,当H2O2浓度为0.5 mmol/L和1.0 mmol/L时,其总巯基含量与空白对照相比均无显著性差异(P>0.05)。但随着H2O2浓度的增加,MP总巯基含量显著下降(P<0.05),当H2O2浓度为10.0 mmol/L时,蛋白总巯基含量降至53.2 nmol/mg,与空白对照组相比降低了12%。这与胡忠良等[23]报道的三黄鸡MP总巯基下降趋势总体一致。
赖氨酸的ε-NH2基团非常容易受到羟自由基攻击转化为羰基,而形成的羰基与氨基可进一步反应形成席夫碱,从而使自由氨基含量进一步下降[24-25]。如表1所示,空白对照样品的自由氨基含量为86.2 nmol/mg,添加Fe3+和VC(H2O2浓度为0.0 mmol/L)样品的自由氨基含量约为86.9 nmol/mg,二者之间无显著性差异(P>0.05)。添加芬顿体系(Fe3+、VC和H2O2)的样品,随H2O2浓度增加自由氨基含量显著降低,当H2O2浓度为10.0 mmol/L时,自由氨基含量约为70.7 nmol/mg,与空白对照组相比降低了约18%。
2.3 H2O2浓度对MP构象稳定性的影响
蛋白质内源荧光特性对于其所处微环境十分敏感,可被用来反映蛋白质构象的变化。一般来说,当蛋白质处于折叠状态时,其荧光强度较强而最大发射波长相对较短;当蛋白结构展开时,荧光强度较低而λm较长。如图1所示,空白对照样品最大发射波长处的荧光强度约为66.9×104,添加Fe3+和VC(H2O2浓度为0.0 mmol/L)样品的荧光强度约为68.9×104,与空白对照相比荧光强度略有上升,并且最大发射波长从328 nm红移到331 nm。这可能与Fe3+和VC添加诱导的脂肪氧化产物对MP色氨酸所处微环境的影响有关。添加芬顿体系(Fe3+、VC和H2O2)的样品,随着H2O2浓度的增加,荧光强度显著下降,尤其是当H2O2浓度超过1.0 mmol/L时,下降尤为显著(P<0.05)。当H2O2浓度为10.0 mmol/L时,荧光强度约为44.9×104,与空白对照相比降低了33%,这是由于随着氧化强度的增加,MP结构逐渐展开,使色氨酸残基等荧光基团暴露于极性环境中,从而导致MP荧光强度降低。
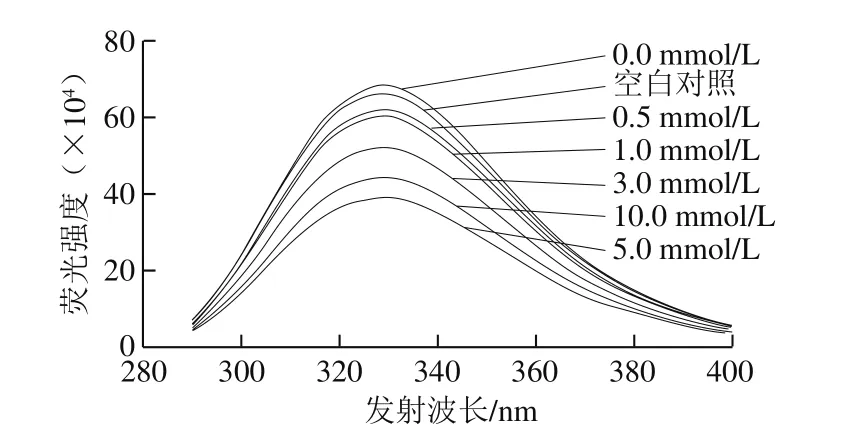
图1 氧化强度对MP内源荧光的影响Fig. 1 Effect of different oxidation degrees on intrinsic fluorescence intensity of myofibrillar protein

图2 氧化强度对MP表面疏水性的影响Fig. 2 Effect of different oxidation degrees on surface hydrophobicity of myofibrillar protein
ANS荧光探针可与蛋白分子表面的疏水性氨基酸结合,如苯丙氨酸和色氨酸[26],从而确定蛋白表面疏水性氨基酸的相对含量,进而反映蛋白质分子构象变化。如图2所示,空白对照样品的表面疏水性约为718.8,添加Fe3+和VC(H2O2浓度为0.0 mmol/L)样品的表面疏水性约为708.7,二者之间无显著性差异(P>0.05)。添加芬顿体系(Fe3+、VC和H2O2)的样品,当H2O2浓度在0.5~3.0 mmol/L范围时,随着H2O2浓度的增加,MP的表面疏水性显著下降(P<0.05),当H2O2浓度在3.0~10.0 mmol/L范围时,MP的表面疏水性略有上升但无显著性差异,当H2O2浓度为10.0 mmol/L时,表面疏水性约为642.8,与空白对照组相比降低了11%。这可能是由于随着氧化强度增强,MP结构展开疏水集团暴露后,又通过疏水相互作用聚集(图2,溶解度下降)使得表面疏水性降低。
2.4 H2O2浓度对MP交联聚集及溶解度的影响

图3 不同氧化程度的MP SDS-PAGE图谱Fig. 3 SDS-PAGE patterns of myofibrillar protein at different oxidation degrees
氧化会诱导蛋白质分子内和分子间二硫键及其他共价键交联,进而可能影响蛋白的溶解性及其他功能特性,比如凝胶性能[1]。在非还原条件下(图3a),随着H2O2浓度的增加,MP样品中肌球蛋白重链和肌动蛋白条带逐渐变浅,同时浓缩胶顶端大分子聚合物明显增多,说明这些聚合物中主要包含了肌球蛋白重链和肌动蛋白。在还原条件下(加入还原剂DTT后,图3b),浓缩胶顶端聚合物条带明显减弱,肌球蛋白重链和肌动蛋白条带明显加粗,说明这些聚合物主要是由二硫键交联形成的,但仍有些许肌球蛋白重链条带没有恢复,说明聚合物中还存在其他共价键,如酪氨酸-酪氨酸和活性羰基-氨基等[1,27]。
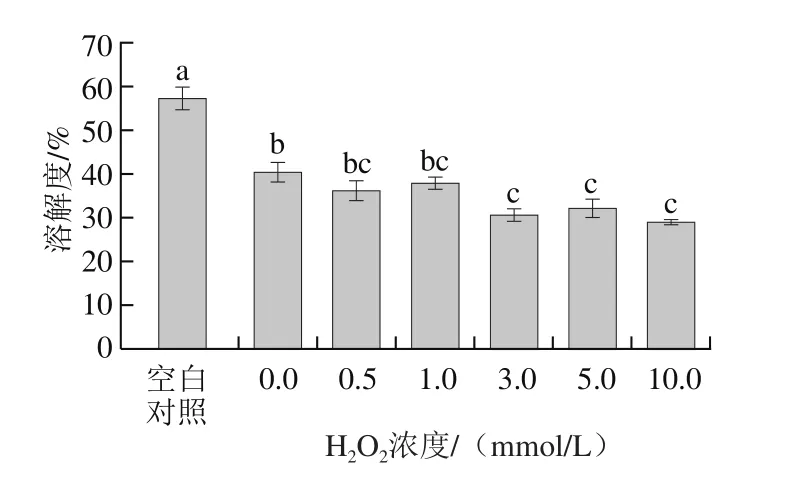
图4 氧化程度对MP溶解度的影响Fig. 4 Solubility of myofibrillar protein at different oxidation degrees
如图4所示,空白对照样品的溶解度约为57.1%,添加Fe3+和VC(H2O2添加量为0.0 mmol/L)样品的溶解度约为40.4%,与空白对照相比显著减小(P<0.05)。添加芬顿体系(Fe3+、VC和H2O2)的样品,随着H2O2浓度的增加,MP溶解度显著下降(P<0.05),当H2O2浓度为10.0 mmol/L时,蛋白溶解度降至28.9%,与空白对照组相比降低了49%。这与Srinivasan等[28]报道的氧化能显著降低鱼肉蛋白的溶解度基本一致。氧化导致MP溶解度下降可归因于2 个方面:第一,氧化导致MP结构展开疏水基团暴露,蛋白分子间疏水相互作用增强,导致蛋白聚集溶解度下降;第二,氧化导致巯基向二硫键转化从而引起蛋白质聚集,导致MP溶解度降低。
2.5 H2O2浓度对MP凝胶性能的影响
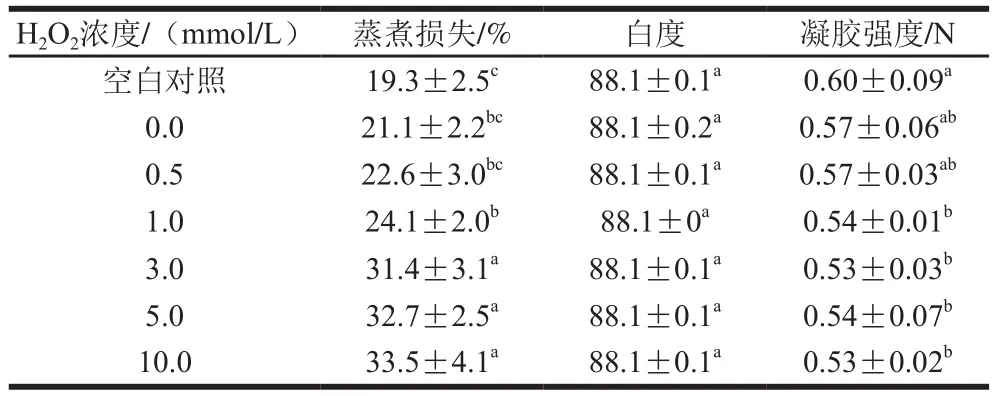
表2 氧化强度对MP热诱导凝胶性能的影响Table 2 Effects of different oxidation degrees on heat-induced gel properties of myo fi brillar protein
如表2所示,空白对照样品的蒸煮损失约为19.3%,添加Fe3+和VC(H2O2浓度为0.0 mmol/L)样品的蒸煮损失约为21.1%,与空白对照对比略上升但并不明显(P>0.05)。添加芬顿体系(Fe3+、VC和H2O2)的样品,随着H2O2浓度的增加,蒸煮损失明显上升,当H2O2浓度为10.0 mmol/L时,蛋白蒸煮损失为33.5%,与空白对照相比升高了74%。这可以归因于随着氧化强度的增加,MP溶解度显著下降(图3),导致参与成胶的蛋白大大减少,凝胶孔隙增大、持水性严重降低,蒸煮损失显著上升(P<0.05)。
不同处理MP热诱导凝胶的白度均为88.1,无显著性差异(P>0.05),说明凝胶白度受氧化程度影响不显著。李银等[5]研究发现随着氧化强度增强,猪肉MP热诱导凝胶白度呈下降趋势。这些不一致的实验结果可能与实验所用MP来源不同等因素有关。
空白对照样品的凝胶强度为0.60 N,添加Fe3+和VC(H2O2浓度为0.0 mmol/L)样品的凝胶强度为0.57 N,与对照相比略有降低但无显著性差异(P>0.05)。添加芬顿体系(Fe3+、VC和H2O2)的样品,当H2O2浓度在0.5~1.0 mmol/L范围时,蛋白凝胶强度降至0.54 N,与空白对照组相比降低了12%(P<0.05)。此后随着H2O2浓度的增加,MP凝胶强度无明显变化(P>0.05)。
2.6 相关性分析
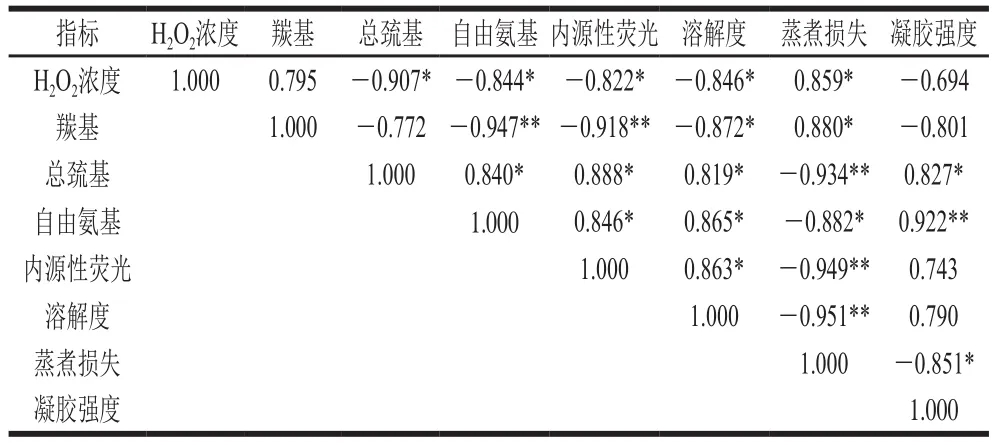
表3 各指标相关性分析Table 3 Correlation analysis between H2O2 concentration and physicochemical and heat-induced gel properties of myo fi brillar protein
如表3所示,H2O2浓度与MP中羰基含量正相关(r=0.795,P=0.059);与总巯基含量(r=-0.907,P<0.05)、自由氨基含量(r=-0.844,P<0.05)、内源性荧光(r=-0.822,P<0.05)和溶解度(r=-0.846,P<0.05)显著负相关;与凝胶强度呈负相关(r=-0.694),但相关性不显著(P>0.05)。蛋白氧化指标(羰基、总巯基、自由氨基和内源性荧光)均与MP溶解度和热诱导凝胶蒸煮损失呈显著相关;同时总巯基及自由氨基含量与凝胶强度分别呈显著(r=0.827,P<0.05)或极显著(r=0.922,P<0.01)正相关;蛋白溶解度与凝胶强度呈正相关(r=0.790,P=0.062),与蒸煮损失呈极显著(r=-0.951,P<0.01)负相关。这表明H2O2浓度越高,蛋白氧化程度越严重,蛋白质溶解度越低,蒸煮损失越严重,凝胶强度越低。
3 结 论
本实验主要研究不同氧化强度对猪MP结构和热诱导凝胶性能的影响及其相关性。结果表明:随着H2O2浓度升高,羰基含量上升,总巯基、自由氨基和内源荧光强度下降,蛋白质交联聚集行为增强,溶解度下降,热诱导凝胶蒸煮损失上升,凝胶强度下降,但凝胶白度无明显变化。同时实验探究了不同氧化强度对MP中残余脂肪氧化的影响,结果表明当H2O2浓度为0 mmol/L时脂肪氧化程度(TBARS值)最大,随H2O2浓度增大TBARS值呈下降趋势。这表明Fe3+和VC即可显著诱导脂肪氧化,脂肪氧化与蛋白氧化并不同步。
