山奈酚抑制人胆囊癌细胞增殖及其对mTORC1通路的影响
2019-10-25侯敬申梁颖涛王伟雄赵莉
侯敬申,梁颖涛,王伟雄,赵莉
(1.广州医科大学 附属第二医院 急诊外科,广东 广州 51026;2.广州医科大学 药学院,广东 广州 511436)
起源于胆囊上皮的胆囊癌(gallbladder cancer, GBC)是胆道系统中常见的恶性肿瘤,早期缺乏典型症状而不易诊断,同时因胆囊特殊的解剖结构和复杂的毗邻关系,其根治性切除率低,预后极差[1].目前最主要的治疗手段是手术治疗,结合辅助化疗,但其化疗敏感性较差且耐药谱较广[2].目前胆囊癌的整体治疗效果并不理想,5年生存率为5%~10%[3].临床需要一种更安全有效的治疗方式来改善胆囊癌患者术后的生活质量.
本研究通过一系列实验观察不同浓度山奈酚对人胆囊癌细胞株SGC-996细胞增殖、凋亡以及哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1, mTORC1)通路相关蛋白表达的影响,来探讨山奈酚对人胆囊癌细胞增殖的影响及其机制.
1 材料与方法
1.1 材料及试剂
人胆囊癌细胞株SGC-996细胞购于中科院上海细胞库;山奈酚(kaempferol)(纯度>97%)、三羟甲基氨基甲烷(Tris)、β-巯基乙醇及十二烷基硫酸钠(sodium dodecyl sulfate,SDS)均购于美国Sigma公司;细胞培养级二甲基亚砜(dimethyl sulfoxide,DMSO)购于美国Invitrogen公司;高糖DMEM培养基购于美国Hyclone公司、细胞增殖-毒性检测试剂盒(cell counting kit-8,CCK-8)购于日本Dojindo株式会社;细胞培养板、培养皿、离心管均购于美国Corning公司;胰蛋白酶、新生牛血清(newborn calf serum, NCS)均购于澳大利亚Serana公司;兔多克隆抗体p-AKT(Ser473)购于美国Cell Signaling Technology公司;小鼠单克隆抗体β-actin,辣根过氧化物酶标记的羊抗兔、羊抗鼠二抗均购于美国Santa Cruz公司;蛋白marker、BCA法蛋白定量试剂盒均购于美国Thermo Fisher Scientific公司;硝酸纤维素膜(nitrocellulose filter membrane, NC膜)购于美国BioRad公司;细胞凋亡检测试剂盒购于中国南京建成生物工程研究所;分析纯丙三醇(甘油)购于中国广州化学试剂厂.
1.2 实验方法
1.2.1 试剂配制
25 mg山奈酚粉末溶于873 μL DMSO,充分溶解配成浓度为100 mmol/L的储液,分装并于-20 ℃避光保存.取浓度为1 mol/L的Tris-HCl (pH 6.8)体积0.625 mL,SDS质量0.2 g,甘油体积1 mL,β-巯基乙醇体积0.5 mL,加双蒸水补至体积5 mL,配制成2× Laemmli Sample Buffer.
1.2.2 细胞培养
SGC-996细胞使用含质量分数10% NCS的低糖DMEM培养基,于37 ℃、体积分数为5%的CO2培养箱内常规培养.
1.2.3 CCK-8法检测细胞体外增殖能力
将对数生长期的SGC-996细胞以1×105/孔接种于96 孔细胞培养板,12 h后进行无血清同步化,12 h后分别加入浓度为0、25、50、75、100、125、150、175 μmol/L的山奈酚,每组设6个平行孔.药物干预47 h时,每孔加入体积为10 μL的CCK-8试剂,继续于细胞培养箱内培养1 h.将96孔板置于酶标仪450 nm波长处检测各孔光密度D(450 nm).以各组光密度值做细胞生长曲线,实验重复3次.
1.2.4 流式细胞仪检测细胞凋亡
生长状态良好的SGC-996细胞以2×106/孔接种于6孔细胞培养板.12 h后,根据细胞增殖实验及凋亡预实验结果,弃去原来培养基,分别加入浓度为0、50及100 μmol/L的山奈酚继续干预细胞48 h,弃去原有培养基,用不含EDTA的胰蛋白酶消化细胞,用新鲜培养基收集细胞,1 000 r/min离心5 min后,弃上清,加入预冷PBS重悬吹散细胞,再次离心后,以新鲜PBS重悬细胞,按照南京建成Annexin Ⅴ凋亡检测试剂盒说明书操作,流式细胞仪检测凋亡和死亡细胞比例.
1.2.5 Western blot法检测蛋白表达
生长状态良好的SGC-996细胞以2×106/孔接种于6孔细胞培养板,12 h后,根据细胞增殖实验的结果,选择加入浓度为0、25、50、100及150 μmol/L的山奈酚进行干预,培养48 h,弃掉培养基,加入2× LaemmLi Buffer,刮取并收集细胞裂解液,BCA法进行蛋白定量分析,100 ℃煮沸5 min,低温高速离心3 min,立刻进行SDS-PAGE凝胶电泳.电泳结束后,1×TBST洗膜3次,每次7 min,加入脱脂牛奶室温封闭1 h,1×TBST洗膜3次,加入稀释后的一抗(V一抗∶V抗体稀释液=1∶1 000),4 ℃孵育过夜;1×TBST洗膜3次后,加入稀释后HRP标记的羊抗鼠、羊抗兔或者兔抗羊二抗(V二抗∶V抗体稀释液=1∶1 500),室温孵育50 min,1×TBST洗膜3次后,加入化学发光试剂显色1 min左右,压片检测mTORC1信号通路中目的蛋白的变化.
1.3 统计学方法
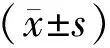
2 结果
2.1 山奈酚对SGC-996细胞体外增殖能力的影响
CCK-8实验结果显示,与0 μmol/L组比较,75 μmol/L及以上浓度组的SGC-996细胞体外增殖能力下降,具有统计学差异(P<0.05);随作用时间继续延长至72 h,浓度为50 μmol/L的山奈酚对SGC-996细胞体外增殖能力也表现出抑制作用,具有统计学差异(P<0.05)(图1).
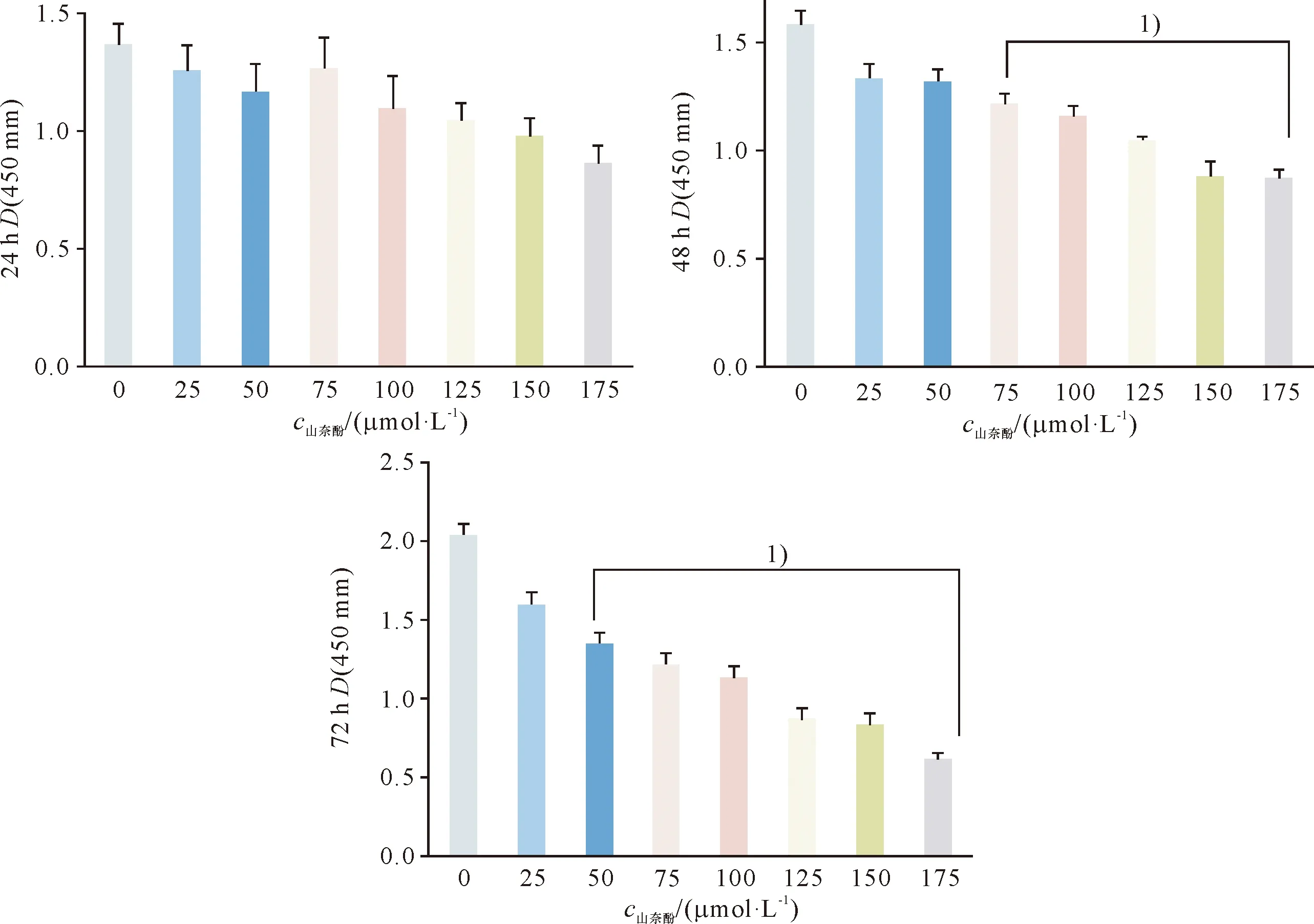
1)与0 μmol/L组比较,P<0.05.
2.2 山奈酚对SGC-996细胞凋亡的影响
流式细胞仪检测结果显示,干预48 h后,与0 μmol/L组相比,100 μmol/L组的山奈酚能明显诱导SGC-996细胞发生凋亡(20.29±1.62vs12.42±2.37,P<0.05).图2为其中一次流式检测的结果.

1)与0 μmol/L组比较,P<0.05.
2.3 山奈酚对SGC-996细胞mTORC1通路蛋白表达的影响
为了明确mTORC1通路在山奈酚抑制SGC-996细胞增殖中的作用,本研究检测了该通路相关蛋白的表达变化.结果发现,与0 μmol/L组相比,浓度为100及150 μmol/L的山奈酚干预48 h后,P-S6K1及P-S6蛋白表达水平较明显下降,具有统计学差异(P<0.05)(图3).
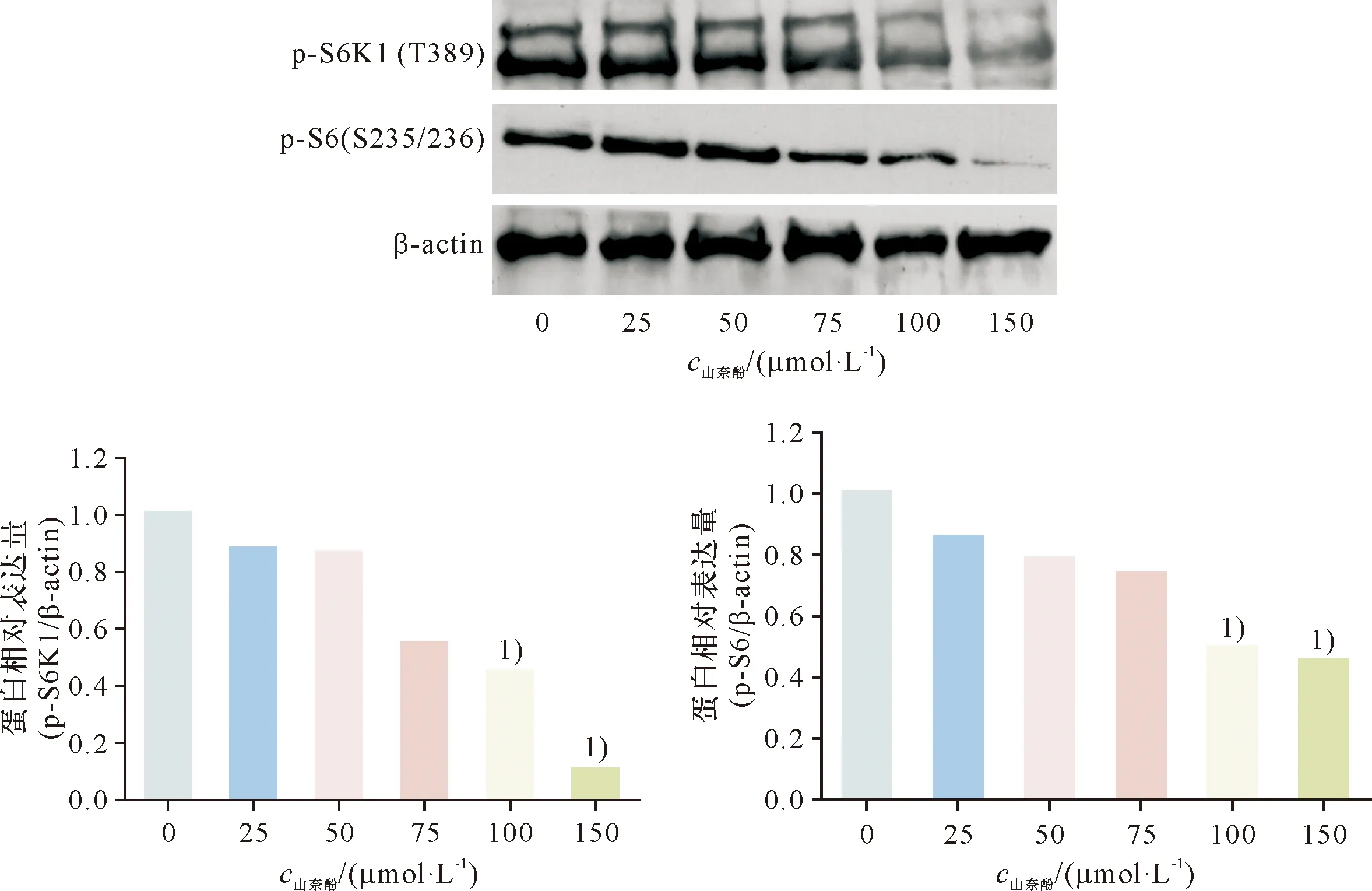
1)与0 μmol/L组比较,P<0.05.
3 讨论
山奈酚为黄色针晶,微溶于水,溶于热乙醇、乙醚和碱.主要来源于姜科植物山奈和小檗科植物窝儿七的根茎,属于黄酮醇类,存在于多种植物中的多酚化合物,具有抗肿瘤等多种药用价值.现有文献报道,山奈酚抗肿瘤作用主要表现在抗细胞增殖、诱导细胞凋亡、干预细胞信号转导和增强抑癌基因活性及抑制癌基因表达等方面.有研究报道山奈酚可通过不同作用机制抑制结直肠癌细胞、大鼠前列腺癌细胞、人乳腺癌细胞、成髓细胞瘤细胞、大鼠嗜碱性白血病细胞和人宫颈癌 HeLa细胞等多种肿瘤细胞的生长或诱导其凋亡[4-8].近年来国内外大量研究表明山奈酚在体外能够抑制多种肿瘤细胞的生长,且可通过多种途径诱导细胞的凋亡,而具体的凋亡机制可能与细胞的类型、状态、信号途径中的各个效应器的活性和功能相关[9-16].
胆囊癌是胆道系统最常见的恶性肿瘤,其发病率在我国逐年增高.由于无特异性的临床表现,胆囊癌临床发现时多属中晚期,根治性切除率低,预后差,严重危害人类健康.近年研究发现,山奈酚具有抗菌、抗炎、抗肿瘤作用,具有诱变剂活性,浓度为100 μmol/L时可抑制淋巴细胞增殖[4, 17].本研究结果显示在0~175 μmol/L 浓度范围内的山奈酚干预48 h后,与0 μmol/L组相比,浓度为75 μmol/L及以上的山奈酚对人胆囊癌细胞株SGC-996细胞开始发挥抑制增殖的作用,随着作用时间延长到72 h时,浓度为50 μmol/L的山奈酚也明显抑制SGC-996细胞的增殖,这种抑制作用随着山奈酚干预浓度的增加而增强.
细胞增殖主要受细胞周期和细胞凋亡两个因素影响.本研究利用流式细胞仪检测SGC-996细胞的凋亡情况,结果显示:与0 μmol/L组比较,浓度为50 μmol/L的山奈酚干预48 h对SGC-996细胞的诱导凋亡作用不明显,而浓度为100 μmol/L的山奈酚干预下的SGC-996细胞则已发生明显的凋亡.
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种进化上保守的、相对分子量为289的丝/苏氨酸蛋白激酶,属于磷酸肌醇3激酶(phosphoinositide 3-kinase,PI3-K)相关激酶(PI3-K-related kinase,PIKK)家族.mTOR信号通路整合来自细胞内外的各种信号,对细胞的代谢、生长增殖及存活等生理过程发挥着中心调节作用.营养(氨基酸、生长因子)、能量、氧气及应激等细胞内外的各种刺激可通过mTOR信号通路调节蛋白质翻译、脂类合成、线粒体能量代谢、细胞生长增殖、衰老等重要生理过程[18-23].mTOR通路在多种细胞生理或病理进程中都呈现过度活化状态(例如肿瘤形成和血管生成、胰岛素抵抗、脂肪合成以及T淋巴细胞活化等),而在许多人类疾病,如癌症和2型糖尿病中,mTOR信号通路的调节均发生异常.这些研究结果使mTOR信号通路成为基础研究和临床研究的热点,随着mTOR抑制剂(雷帕霉素及其类似物)广泛应用于临床治疗,例如对于实体瘤、器官移植、冠状动脉再狭窄以及类风湿性关节炎的治疗,mTOR信号通路的重要性越发突显[24].
细胞内mTOR信号通路主要有两种活性形式mTORC1(mTOR complex 1)和mTORC2(mTOR complex 2).mTORC1信号通路由mTOR、mTOR调节相关蛋白(regulatory associated protein of mTOR, Raptor)、mLST8(mammalian lethal with SEC13 protein 8)和相对分子量为40的富含脯氨酸蛋白激酶B底物(protein-rich Akt substrate of 40, PRAS40)组成,接受激素、生长因子、氨基酸及能量、应激等刺激.其直接底物为40S核糖体蛋白S6激酶(40S ribosomal protein S6 kinase 1,S6K1)和真核细胞翻译起始因子4E-结合蛋白1(eukaryotic translation initiation factor 4E binding protein 1, 4E-BP1).S6K1的389位苏氨酸被磷酸化后,使S6K1激活后,通过磷酸化其底物核糖体蛋白S6的235/236位丝氨酸,进而促进核糖体的发生;而4E-BP1磷酸化后其活性则被抑制,不能再结合并抑制真核起始因子4E(eukaryotic initiation factor 4E,eIF4E),eIF4E是一种帽结合蛋白,可以特异性地识别mRNA的5′端的帽子(cap)结构,从而启动cap依赖的蛋白翻译过程.二者磷酸化后能共同促进蛋白质的合成及细胞生长与增殖[22,24].S6K1是mTORC1信号通路最具特征的效应分子,其调节方式常被作为研究mTORC1信号通路的模型.本研究结果发现,在浓度为0~150 μmol/L 的山奈酚干预48 h后,浓度为100及150 μmol/L的山奈酚干预的SGC-996细胞中P-S6K1及P-S6蛋白表达水平较0 μmol/L组显著下降,这间接提示山奈酚可以抑制mTORC1信号通路的活性.
本研究表明山奈酚在一定浓度范围内可剂量和时间依赖性地抑制胆囊癌细胞株SGC-996的增殖,并诱导其凋亡,而对细胞增殖的抑制作用可能是通过影响mTORC1信号通路而实现的,但是具体通过何种机制影响mTORC1信号通路尚有待进一步深入探讨.
