斑马鱼Pax3a结构域过表达对瓦登伯革氏症候群疾病影响
2019-10-25程梦楠浦逸晟李乐诗范纯新严继舟
程梦楠,浦逸晟,李乐诗,范纯新,4,严继舟,2,3,4
(1.上海海洋大学 水产科学国家级实验教学示范中心,上海 201306;2.上海海洋大学 农业部淡水水产种质资源重点实验室,上海 201306;3.上海海洋大学 农业部鱼类营养与环境生态研究中心,上海 201306;4.上海海洋大学 海洋生态系统和神经科学研究所,上海 201396)
PAX3(paired box3)基因编码是一个具有高度保守的基序的转录因子[1],被认为是哺乳类肌先祖细胞的标志基因,能调节间质-上皮和间质-肌肉表型的互转[2-3].在早期胚胎发育过程中PAX3可调控神经嵴的分化、神经嵴细胞的迁移以及许多组织器官的发育.与PAX3基因多功能相对应的瓦登伯革综合征(Waardenburg syndrome,WS),又叫瓦登伯革氏症候群(简称瓦氏症),是一种遗传性听觉-色素综合征[4],临床特征为听力障碍、白额发、虹膜异色症、鼻根宽阔、眉毛中部多毛以及内眦异位[5].
WS病是多基因多表型的遗传性发育疾病,发病机制仍然不清楚.目前认为主要是由于神经嵴细胞发育缺陷或功能障碍所致.已鉴定了6个相关基因:PAX3、MITF(microphthalmia-associated transcription factor)、SOX10(SRY-related HMG-box 10 protein)、SNAI2(snail family transcriptional repressor 2)、ENDRB(endothelin receptor type B)、EDN3(endothelin-3)[6],其中WS1和WS3是由PAX3基因突变引起.WS2的致病基因为MITF和SNAI2.WS4的致病基因为SOX10、ENDR3和EDN3[7].
PAX3与较多的转录因子如SOX10、ETS1(protein C-ets-1)、GLI2(zinc finger protein GLI2)以及ZIC2(zinc finger protein ZIC 2)靶蛋白,Hippo通路TAZ(tafazzin)和YAP65(yes associated protein 1),染色质蛋白,以及蛋白p53(cellular tumor antigen p53)和Mdm2(e3 ubiquitin-protein ligase Mdm2)等相互作用.另外,PAX3含有DNA结合结构域,能与DNA染色质结合[8-9].在哺乳类动物实验中,通过Wnt(wingless-integrated)、TGFβ(transforming growth factor beta)、TLR2(toll like receptor 2)和MAPK(mitogen-activated protein kinase)等信号通路[10-12]可以调节间质-上皮细胞和间质-肌肉细胞表型的互转.尽管国外有较多文献报道人类瓦氏症与PAX3基因突变关系密切,但国内报道不多.鉴于PAX3基因含4个保守结构域,推测PAX3功能的复杂多变可能与其含有多结构域有关.斑马鱼基因组中PAX3直系同源基因有Pax3a和Pax3b两个亚型拷贝[3].Pax3a结构域所在位置(图1).本研究选择克隆斑马鱼Pax3a对应的4个结构域,研究每个结构域表达引起的细胞表型特征及与瓦氏症表型之间的关系.Pax3a的结构域分为paired box domain 3(PD3):CDS 34-158;homeo box domain(HD):CDS 222-275;g-protein pathway suppressor domain(GPD):CDS 273- 427;paired box domain 7(PD7):CDS 349-393.
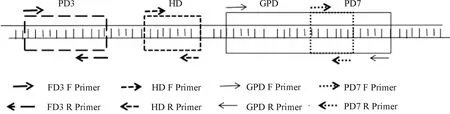
图1 Pax3a结构域示意图
1 材料与方法
1.1 材料和试剂
1.1.1 实验试剂和仪器
实时荧光定量聚合酶链式反应(real-time quantitative PCR,qPCR)试剂盒、PCR扩增试剂、DH5α感受态细胞、pEASY-Blunt M2试剂盒及鼠抗Myc标签抗体均是购于北京全式金生物技术有限公司;DNA扩增产物纯化试剂盒(天根生化科技(北京)有限公司);脂质体转染试剂盒、全蛋白提取试剂盒和Trizol(生工生物工程有限公司);Hieff UNICON® qPCR SYBR Green Master Mix(上海翊圣生物科技有限公司);L15培养基(赛佰慷(上海)生物技术有限公司);羊抗鼠 IgG-HRP、羊抗鼠IgG-dylight488和Fetal Bovine Serum (Thermo Scientific);无内毒素质粒小提中量试剂盒(天根生化科技有限公司);DAPI(Sigma).主要仪器包括qPCR仪(Applied Biosystems);激光共聚焦显微镜(德国徕卡高清晰光学仪器)和倒置荧光显微镜(Zeiss).
1.1.2 实验用鱼
所用斑马鱼为实验室自养野生型(TAB系,是AB和TU品系杂交产生).实验选取在温度为28 ℃,按14 h/10 h昼夜节律条件饲养下的1年左右的成年斑马鱼,交配产受精卵[13].
1.2 实验方法
1.2.1 设计引物
先从NCBI网站上查找斑马鱼Pax3a基因编码蛋白的4个结构域:PD3、HD、GPD和PD7,然后根据每个结构域的mRNA序列,设计引物如下:

表1 Pax3a结构域的引物序列
1.2.2 过表达载体构建
用3 d的TAB仔鱼,提取总RNA,反转录制备cDNA.然后以cDNA为模板PCR扩增结构域cDNA片段.将扩增得到的PCR产物克隆到p-M2-myc质粒(pEASY-Blunt M2).转化DH5α感受态菌株后提取质粒,进行PCR筛选和测序验证.
1.2.3 体外细胞培养和转染
斑马鱼胚胎成纤维细胞(Pac2)在32 ℃用L15完全培养基(L15培养基,质量分数为10% 胎牛血清,质量分数为1%青霉素/链霉素)培养[14].10 μg表达载体与脂质体转染试剂以1∶3的体积比,分别添加到L15培养基,各自混匀5 min后,将两种混合物于室温静置15 min,添加到铺满Pac2细胞的培养瓶中.32 ℃培养8 h后换液,再培养48 h.抽提细胞总蛋白进行免疫印迹试验.
1.2.4 qPCR
同样方法转染的Pac2细胞,提取总RNA,并反转录成cDNA.再进行qPCR检测,以β-actin作为内参.采用2-ΔΔCt法计算mRNA的相对表达量.
1.2.5 细胞免疫荧光
细胞转染48 h后,用PBS清洗和体积分数4% PFA固定.空气干燥后加体积分数0.5% Triton-100透膜.含体积分数0.1%吐温20和质量分数1% BSA的封闭液封闭后,依次用鼠抗myc单抗、羊抗鼠 IgG-dylight488孵育1h.PBS清洗后,滴加DAPI.在激光共聚焦荧光显微镜下观察.
1.2.6 斑马鱼胚胎显微注射
收集受精1 h内受精卵,按文献[15]的显微注射方法,每个胚胎注射质量浓度为100 ng/μL的质粒2 nL.每组注射200颗同期受精胚胎.倒置显微镜拍摄,并统计眼球、腹部、尾鳍、脊椎和头部等部位的表型变异量.
1.2.7 细胞划痕实验
在32 ℃条件下,L15完全培养基培养Pac2细胞.脂质体转染质粒后,在培养皿中单层细胞表面划两道相隔2 cm的平行线,在0、16、25、40、48 h 5个时间点,相应时间点的5组分别取10个点,进行测量划痕两侧细胞的距离.取迁移距离平均值,t-test统计分析,GraphPad Prism 8软件作图.
1.2.8 表型测量和统计学分析
挑选发育25 d斑马鱼,比较PD3、GPD、HD、PD7、NC结构域过表达胚胎表型差异,每组不少于42个统计点.质量浓度0.25 μg/mL MS222麻醉,放置固体琼脂糖模具上固定,置于体视镜下方观察内眦、尾鳍、腹部色素、眼球、头部和脊椎等部位.在眼球上部,最外侧边缘的中间为外眦中心点,眼球内侧阴影可见最靠近内侧边缘,作为内眦中心点.并结合文献方法[16]分别测量两侧眼球的外眦和内眦.内眦是斑马鱼两眼球内侧距离,外眦是两侧眼球上方中点间的距离,瞳孔半径是单侧瞳孔中心到边缘的距离,眼球半径是单侧瞳孔中心到眼球边缘的距离(图2A).计算公式:
内外眦比=x/y×100%
眼瞳面积比=(z/w)2×100%(图2B).
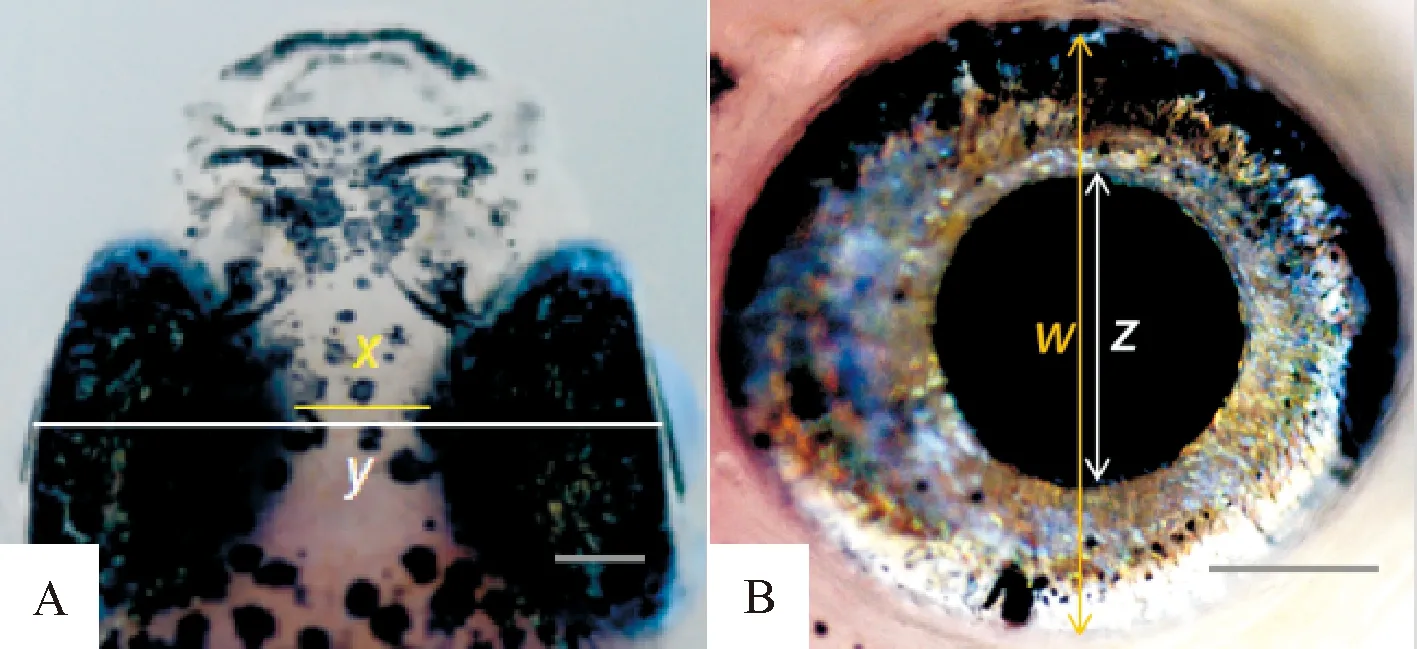
A:x: 内眦;y: 外眦;B:z: 瞳孔;w: 眼球; 标尺:100 μm.
A:x: Inner Canthus;y: External Canthus; B:z: Pupil;w: Eyeball; Scan bar: 100 μm.
图2 斑马鱼内外眦和眼瞳面积比示意图
Fig.2 Diagram of the ratio of inner/outer canthus and eye pupil area of zebrafish
2 结果
2.1 Pax3a结构域过表达载体克隆检测
在Pax3a各个结构域cDNA的PCR扩增产物克隆后,PCR检测阳性克隆.图3显示电泳结果.PCR条带大小与预期一致,结构域的碱基对即PD3(375 bp),GPD(468 bp),HD (165 bp),PD7 (138 bp),NC为空载体(阴性克隆),M(marker,DNA碱基对标记)、GPD结构域过表达后蛋白免疫印迹,有特异性条带(图3).
A:4种结构域PCR电泳结果;B:GPD-myc融合蛋白免疫印迹结果.
A: PCR result of gel electrophoresis of four domains; B: Western blot result of GPD-myc.
图3 4种保守结构域PCR电泳和蛋白免疫印迹图
Fig.3 PCR electrophoresis and Western blot image ofPax3aconserved domains
2.2 Pax3a结构域的过表达检测
2.2.1Pax3a结构域过表达细胞的免疫荧光观察
将4种结构域过表达质粒和空白质粒分别转染细胞,过表达72 h后进行抗体免疫荧光.实验结果显示,与对照组NC相比,4种结构域过表达的细胞都有明显的绿色荧光(图4).

A:PD3;B:HD;C:GPD;D:PD7;E:NC
2.2.2Pax3a结构域过表达的mRNA相对表达量检测
为了验证每个结构域过表达量,本实验通过qPCR检测对照组和实验组每个结构域的转录水平.实验结果显示,每个转染的结构域转录只在相应的样本中有极显著上调,证明结构域的过表达载体确实在细胞中表达.因为PD7是GPD结构域中的一部分,所以在GPD结构域过表达时,也显示PD7高表达(图5).

A:PD3载体的mRNA相对表达量;B:HD载体的mRNA相对表达量;C:GPD载体的mRNA相对表达量;D:PD7载体的mRNA相对表达量.1)与对照组比较,P<0.01.
A: The mRNA relativity expression of PD3 vector; B: The mRNA relativity expression of HD vector; C: The mRNA relativity expression of GPD vector; D: The mRNA relativity expression of PD7 vector.1)Compare to NCP<0.01.
图5Pax3a结构域过表达的mRNA相对表达量
Fig.5 RNA level test ofPax3adomain overexpression
2.3 胚胎注射存活率
为了探索最佳注射量,先向斑马鱼受精胚胎中分别注射质量浓度为0、100、200、300 ng/μL的PD3质粒各2 nL,每组不少于150个胚胎,3 d后统计结果.注射质量浓度为100 ng/μL的PD3质粒胚胎存活率最高并有较高的畸形率(图6).

A:分别注射质量浓度为0、100、200、300 ng/μL的PD3过表达载体,统计3 d内胚胎存活率;B:分别注射质量浓度为0、100、200、300 ng/μL的PD3过表达载体,统计3 d内胚胎畸形率.
A: Statistics of embryo survival ratio in three days of PD3 vector with 0、100、200、300 ng/μL concentrations; B: Statistics of embryo malformation ratio in three days of PD3 vector with 0、100、200、300 ng/μL concentrations.
图6 PD3结构域过表达载体注射量优化
Fig.6 Quantity optimization of PD3 domain overexpression vector injection
然后向斑马鱼胚胎中分别注射2 nL的质量浓度为100 ng/μL的PD3、GPD、HD和PD7结构域过表达载体,以NC空白组作为对照,比较存活率.每组不低于150个胚胎,3 d后统计存活率.结果发现4种结构域注射胚胎的存活率并非都比空白对照低,其中存活率大小依次是:HD>NC>PD3>GPD>PD7(图7).
2.4 Pax3a结构域特征性表型鉴定
在胚胎显微注射结构域过表达质粒后,观察发育25 d的幼鱼头部、腹部、尾鳍、脊椎和眼球等部位都有色素分布变异.发现PD3过表达组出现眼球花色变异特别明显(图8,9).
为了进一步鉴定结构域特异性表型,于是统计斑马鱼头部、尾鳍、背鳍至侧腹中央部位,侧腹部上边缘、侧腹部下边缘、眼球上边缘等部位色素分布变异数.PD3、GPD、HD、NC和PD7结构域的色素分布变异率分别是55%、29%、21%、17%和14%(图10).可见PD3和GPD在色素分布变异方面的发病率相对HD高,而PD7对色素变化偏低.与对照组相比,PD3和GPD结构域过表达对胚胎眼瞳面积比有显著性差异,也对内外眦距离比有极显著性差异,HD结构域有显著性差异.而PD7对眼瞳和内外眦均无显著性差异.

图7 4种结构域胚胎注射存活率

A-B: 眼球;C-D:头部; E-F: 上腹部;G-H: 中腹部;I-J: 尾鳍;K-L:脊椎;体视镜显微镜拍摄,标尺:100 μm
A-B: Eyeball; C-D: Head; E-F:Upper abdomen;G-H: Middle abdomen; I-J: Tail fin; K-L: Vertebration; Shot by stereomicroscope, Scan bar:100 μm
图8Pax3a结构域过表达的胚胎特异性色素表型
Fig.8 Characteristic pigment phenotypes ofPax3adomain overexpressed embryos

A:实验组过表达变异眼球色素变异;B:野生型眼球色素;C:实验组尾部色素变异;D:野生型尾部色素;体视镜显微镜拍摄,标尺:100 μm.
A:Eyeball pigment variation of PD3 overexpression;B:Eyeball pigment variation of wildtype;C:tail fin pigment variation of PD3 overexpression; D:Tail fin pigment variation of wildtype; Shot by stereomicroscope, Scan bar:100 μm.
图9 PD3结构域过表达胚胎特异性表型
Fig.9 PD3 domain overexpressing embryo-specific phenotypes

A:眼球瞳孔距离比值; B:内眦距离和外眦距离比值; C:色素变异率.与对照组比较, 1)P<0.05; 2)P<0.01.
A:Distance ratio between eyeball and pupil; B:Distance ratio between canthus and outer canthus; C:Pigment variation rate.Compare to NC, 1)P<0.05; 2)P<0.01.
图10 斑马鱼胚胎表型变异统计
Fig.10 Statistics of phenotypic variation of zebrafish embryos
2.5 Pax3a结构域过表达影响细胞迁移
为了比较结构域对细胞行为的影响,采用细胞培养结合划痕试验.结构域转染和划痕后距离测量统计学分析发现,结构域过表达对划痕间迁移距离大小依次是:GPD组>NC组>HD组>PD7组>PD3组,并且在16、25、40、48 h 4个时间点的迁移与对照组有显著性差异.其中GPD结构域过表达显示促进细胞迁移,而PD3、HD和PD7结构域在细胞中过表达会抑制细胞迁移,且PD3结构域过表达对细胞迁移抑制作用最大(图11和表2).

图11 Pax3a结构域对细胞迁移的影响(×100)
表2 细胞迁移距离统计分析


组别不同时段/h16254048NC1 180.2±42.31 632.0±25.91 977.7±38.72 294.6±28.1PD3674.9±29.31)890.5±32.21)1 043.8±28.51)1 196.7±14.11)GPD1 223.3±23.91)1 697.6±39.31)2 084.6±47.71)2 448.2±43.61)HD1 051.2±28.11)1 406.1±23.01)1 701.1±44.41)1 981.6±25.41)PD7942.2±54.01)1 301.8±40.61)1 573.3±47.91)1 827.5±57.41)
1)与对照组比较,P<0.05
3 讨论
本实验成功构建了斑马鱼Pax3a的4种结构域(PD3、GPD、HD和PD7)的过表达载体.胚胎注射后,观察发育25 d的斑马鱼,发现PD3过表达的色素变异比例达到55%,远高于其他结构域过表达以及空白对照组,同时眼瞳比和内外眦比减小.有报道显示,Pax3杂合突变的小鼠在其腹部、尾部、四肢也会出现白色的斑点[17].根据色素减退和眼球发育变异,本研究认为Pax3a结构域过表达引起的表型变异与人类I型瓦氏症中白斑症、虹膜异色和内眦移位症状非常类似[18].
PAX3在色素形成过程中具有高度保守的作用[19].在黑色素细胞中PAX3被认为能够调节黑色素生成谱系基因MITF和TRP-1(tyrosinase-related protein-1)[19-21].PAX3通过NCAM1(neural cell adhesion molecule 1)等调节黑色素干细胞的迁移和分化[17,22].当黑色素干细胞中在Wnt信号肽存在的条件下,PAX3通过β-cat(β-catenin)、Dct(l-dopachrome tautomerase)、SOX10、TRP-1和MITF协同作用,激活酪氨酸激酶通路,生成黑色素[8,23].据报道PAX3同源基因Pax3a对黑色素细胞迁移有抑制[11]作用.这些报道可以解释我们的结果,即Pax3a结构域过表达会抑制细胞迁移和黑色素生存.
Pax3a每个结构域对细胞行为有不同作用.与对照组和其他实验组相比,PD3和GPD结构域过表达产生的畸形变异最显著.同样在Pac2细胞迁移实验中,PD3和GPD结构域对细胞迁移影响最明显.在胚胎发育初期,表皮黑色素母细胞和颌面部原始的间充质细胞起源于神经嵴干细胞,具备可塑性和迁移性[12,17,24-25].由Pax3a结构域过表达引起的斑马鱼胚胎色素分布变异,眼球发育变异,可能是由于结构域对发育初期神经嵴细胞迁移异常引起的.而细胞迁移受到TGFβ调节,且TGFβ信号影响小鼠晶状体纤维细胞的分化[26].可见Pax3a结构域过表达对细胞行为的影响没有组织和细胞特异性.
Pax3a4个结构域过表达产生特征性眼球变异表型.有报道显示,PAX6(paired box 6)的表达水平对眼的发育极其敏感[27].在眼发育过程中,PAX6表达于视神经、晶状体、角膜上皮、虹膜、睫状体、视网膜及色素上皮层[28-29].当PAX6活性缺乏时,视泡与表面外胚层的接触不能维持,神经视网膜和视网膜色素上皮不能分化,最终视泡退化,表面外胚层源性的眼结构完全缺失[30].Antosova等[31]发现Wnt信号对小眼球的形成和纤维细胞分化至关重要.Yang等[32]发现PAX6通过调控Wnt通路调控晶状体的发育,并且发现FGF信号通路对于晶状体的形成是必需的,Wnt信号通路与BMP信号通路在晶状体形成过程中起到相反的作用.因为PAX6也包含PD3和HD结构域,所以推测PD3或者HD结构域通过直接或者间接作用于Wnt/BMP信号通路来调节眼球发育.据报道,MITF突变对黑素细胞有不同程度的影响,而有些还影响视网膜色素细胞,导致未着色或色素减退的眼睛比正常小(因此称为小眼炎)[33].本研究结果显示4个结构域过表达斑马鱼的眼瞳面积比都小于对照组,同时伴随色素的变化,这些表型改变类似于小眼炎.
Pax3a4个结构域过表达产生的斑马鱼胚胎表型,类似于PAX3基因突变导致的瓦氏症WS1和WS3型.WS1和WS3的特征是一种特殊的面部眼球斜视眦(或远距眦),其眼内眦侧位移被认为是WS1分类最可靠的特征,有非常高的外显率[16].杂合PAX3基因突变被认为是大多数WS1病例的病因[5].通常基因突变包括表达量减少或者增多.增加表达量可能会起到剂量效应,并导致色素或者内外眦的变化[16].
人类瓦氏症表型中,表现为色素、听力、颌面部肌肉、骨骼、结肠和心脏功能结构异常[5]等多发症状,且无固定表型.过表达Pax3a结构域不仅造成了色素的变化,同时也造成了眼球发育异常,这与文献[33]发现的PAX3-MITF基因网络中,MITF突变导致色素变化和眼球变异表型相一致.与人类瓦氏症症状对比,在体色、瞳孔、内外眦和虹膜异色等表型改变都比较符合,因此认为Pax3a结构域过表达能够复制,至少是部分复制人类PAX3基因突变引起的瓦氏症表型.
虽然本实验中对照组也出现较多的死亡和畸形,4个结构域过表达的特征性表型并不专一,发生比例也不是很高,但仍然有统计学差异.一是因为瓦氏症是属于杂合多发基因遗传性疾病,单个基因突变未必会有明显的瓦氏症症状出现;另一个原因是因为PAX3每个结构域有各自的作用通路,导致PAX3功能和表型多样,其差异在GPD和PD7之间更明显(后者是前者结构域的一部分).在生物体特定发育过程中,基因过表达或者基因突变发生引起相关的信号通路的激活,才可能会引起该症状.临床上瓦氏症的发生和遗传是异质散发型的,并非所有的都是显性遗传[5].鉴于瓦氏症病人案例不足,治疗手段有限,该类疾病研究在国内鲜有报道,在国外有少量报道,因此建立一种斑马鱼瓦氏症疾病模型,能够为研究瓦氏症表型特征和致病机制提供材料基础,也能针对开发相应的诊断方法和治疗手段.本研究结果显示瓦氏症的表型呈多样性可能与结构域相关的调控通路密切相关,值得深入研究.
致谢:感谢上海海洋大学生物系和神经科学研究所老师和徐雨雁同学对本实验课题研究上的技术帮助.
