基于二氧化钛/石墨烯纳米复合物的光电化学适体传感器测定土霉素
2019-10-23廖芳丽封科军刘丽园
冯 颖,解 芳,廖芳丽,封科军,刘丽园
(惠州学院 化学与材料工程学院, 广东 惠州 516007)
土霉素(OTC)是一种四环素类抗生素,能有效抑制致病微生物感染以及细菌生长繁殖,因其抗菌性好、成本低,在医疗卫生、农业、畜牧业和水产养殖业中得到了广泛应用。但长期使用抗生素会造成其残留量增多和在环境中的累积,增强细菌、病毒的耐药性,易引发公共安全等问题[1-3]。因此,发展简单、快速、灵敏、低成本的抗生素检测方法对环境监测、疾病预防具有重要意义。
检测抗生素的常用方法包括高效液相色谱法[4-6]、色谱-质谱联用法[7]、酶联免疫法[8]等。虽然这些方法精度好、灵敏度高,但仪器昂贵、操作复杂且耗时,往往需要专业的技术培训,限制了其在实际中的应用。光电化学检测是近年发展起来的基于光电活性材料在光照下产生光电流,因被测物质的加入而产生直接或间接的相互作用,从而导致电流信号发生变化的检测方法[9]。因其激发信号(光)与检测信号(电)相互独立,降低了背景,易获得更高的灵敏度[10],具有简单快速、成本低的优点,已成功用于蛋白质[11]、DNA[12]、细胞[13]、生物小分子[14]、离子[15]等目标物的分析。为了拓宽光电化学检测法在实际中的应用,进一步提高方法的灵敏度与选择性仍是光电化学传感器亟需解决的问题。通过与其他材料复合是增加光电转化效率,提高灵敏度的方法之一。鉴于石墨烯优异的电子传导性能、大的比表面积,将其与光电半导体材料复合有利于提高光电转化效率[9]。适配体(Aptamer)是一种通过指数富集配体系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX)[16]人工合成的单链DNA或RNA序列。与抗原、抗体间的相互作用类似,适配体能够与小分子、细胞、蛋白质等多种目标物发生高亲和力作用和特异性识别。同时较抗体相比,适配体具有易于制备和修饰、成本低、稳定性好等优点,因而在生物、环境分析等领域备受关注[17-19]。
目前,基于土霉素适配体的光电传感检测研究并不多,已有文献存在材料制备复杂、成本高等问题[20]。本文一方面采用简单的电化学方法构建石墨烯复合的TiO2纳米光电传感界面,利用石墨烯优异的电子传输性能,降低TiO2光生电子-空穴复合,以提高光电流响应;另一方面采用土霉素适配体进行特异性识别,构建用于土霉素特异性检测的光电适配体传感器。本方法成本低、操作简单快速、灵敏度高、选择性好,取得了令人满意的结果,对于实现土霉素的快速灵敏检测具有现实意义和潜在的应用价值。
1 实验部分
1.1 材料与仪器
石墨粉(青岛富润达石墨有限公司);土霉素(OTC)、金霉素、四环素(纯度大于98%,上海泰坦科技股份有限公司);钛酸正丁酯(分析纯)、90%(脱乙酰基)壳聚糖(Chitosan,CHIT)、25%戊二醛(GA)购自国药集团化学试剂有限公司;三羟甲基氨基甲烷(纯度大于99%)、牛血清白蛋白(纯度大于96%,BSA)购自上海麦克林生化科技有限公司;氨基标记的OTC适配体序列(5'-NH2-(CH2)6-GGA ATT CGC TAG CAG GTT GAC GTT GAC GCT GGTGCC CGG TTG TGG TGC GAG TGT TGT GTG GAT CCG AGC TCC ACG TG-3')由生工生物工程(上海)股份有限公司合成。其它试剂均为市售分析纯,实验用水为18.2 MΩ·cm的超纯水。
CHI600D电化学工作站(北京华科普天科技责任有限公司);KQ5200V超声波清洗仪(昆山市超声仪器有限公司);TGL-20M台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司);GZX-9030MBE电热鼓风干燥箱(上海博迅实业公司医疗设备厂);DF-101S集热式恒温磁力搅拌器(上海梅香仪器有限公司);SU8010日立高分辨场发射扫描电镜(日本株式会社公司);Nexus470傅里叶变换红外光谱仪(Nicolet公司);HSX-F/UV300氙灯光源(北京纽比特科技有限公司)。
1.2 标准溶液的配制
1.2.1 土霉素溶液称取适量OTC用PBS缓冲液(0.1 mol/L KH2PO4-0.1 mol/L Na2HPO4)溶解定容,配成0.01 mol/L OTC溶液作为母液,于-20 ℃避光保存。所需不同浓度的OTC以此逐级稀释,于4 ℃冰箱保存。
1.2.2 土霉素适配体(OTC-aptamer)溶液将所购OTC-aptamer(100 mmol/L NaCl,20 mmol/L Tris-HCl,5 mmol/L KCl,1 mmol/L CaCl2,2 mmol/L MgCl2)的链序列1 OD,在12 000 r/m下离心,加入适当体积缓冲液配成100 μmol/L的贮存液,于-20 ℃冰箱保存。用Tris-HCl缓冲液将贮存液稀释至1.5 μmol/L,于4 ℃冰箱保存。使用前,在95 ℃加热5 min后进行淬火,自然冷却至室温。
1.3 传感界面的构建
1.3.2 FTO导电玻璃的清洗将FTO导电玻璃依次在丙酮、无水乙醇和水中各超声清洗15 min后,在烘箱中烘干。
1.3.3 TiO2/FTO导电玻璃电极的制备(TiO2/FTO)先用水热法制备纳米TiO2,即在100 mL烧杯中加入30 mL 水,再加入30 mL浓盐酸,搅拌条件下缓慢加入1 mL钛酸正丁酯,搅拌30 min后得到混合液。量取适量混合液倒入反应釜中,将烘干的FTO导电面朝下插入有混合液的反应釜中,盖紧,放入160 ℃干燥箱中,反应6 h。样品自然冷却后,用水清洗玻璃,再放入450 ℃马弗炉中恒温3 h后,即得到TiO2/FTO导电玻璃电极。
1.3.4 TiO2-石墨烯/FTO纳米复合电极(TiO2-rGO/FTO)的制备将100 mg氧化石墨分散于300 mL水中,超声分散2 h,得到氧化石墨烯(GO),并以此作为工作液;用玻璃刀将TiO2/FTO导电玻璃切成1 cm×1 cm,以其作为工作电极,铂丝为对电极,饱和甘汞电极为参比电极,采用循环伏安法( 扫描范围为-2.5~2.5 V,扫描速率为50 mV·s-1)进行电化学还原,经适当时间后,取出工作电极,用水冲洗并吹干,即得到TiO2-rGO/FTO纳米复合电极。
1.3.5 土霉素适配体的固定化修饰在TiO2-rGO/FTO纳米复合材料电极表面滴涂90 μL壳聚糖溶液,在空气中干燥过夜成膜,用水清洗吹干后,将50 μL稀释的戊二醛溶液(2.5%)滴涂至修饰电极表面,室温下放置1 h。清洗并干燥后,滴涂50 μL 1 μmol/L的OTC适配体,在4 ℃冰箱中放置12 h后,用PBS缓冲液洗去未反应的OTC适配体,滴加50 μL BSA在37 ℃反应1 h,封闭残留位点,经PBS缓冲液冲洗后,即得到土霉素适配体修饰的TiO2/石墨烯复合材料电极(Aptamer/TiO2-rGO/FTO)。
1.4 OTC的检测
将制备好的传感界面(Aptamer/TiO2-rGO/FTO)与50 μL不同浓度 OTC溶液(0.1 mol/L PBS,pH 7.4)在60 ℃下反应1 h后,用水清洗。采用150 W氙灯作为激发光源,在CHI600D电化学工作站(三电极体系,其中修饰电极为工作电极,铂丝为对电极,饱和甘汞电极为参比电极)上,选用安培电流时间曲线法(初始电位-0.1 V,运行时间100 s)记录OTC反应前后的光电流值,以光电流的变化值作为与目标物浓度对应的信号值。
2 结果与讨论
2.1 光电化学适体传感器检测土霉素的原理

图1 光电化学适体传感器检测土霉素的实验原理图Fig.1 Experimental schematic diagram of photoelectrochemical aptamer sensor for detection of OTC
光电化学适体传感器检测土霉素的实验原理如图1所示。实验采用FTO导电玻璃为基底,在其表面制备了TiO2/石墨烯复合材料,通过滴涂壳聚糖溶液,使电极表面带上氨基,通过戊二醛交联,使氨基标记的土霉素适配体牢固地修饰至电极表面。采用电化学工作站检测修饰了土霉素适配体的光电流,此时得到的光电流为I0。将修饰电极用于某一浓度的土霉素溶液测定时,土霉素与其适配体发生特异性结合形成复合物,测得光电流值为I。由于目标物与适配体的特异性结合,阻碍了光电传感界面对光的有效吸收及光生电子的转移,从而导致光电流减小,其信号值用ΔI表示,ΔI=I0-I。基于电流的变化值与待测物土霉素的浓度成正比,从而实现土霉素的测定。
2.2 纳米TiO2与TiO2-rGO复合材料的扫描电子显微镜图
分别考察了纳米TiO2及TiO2-rGO复合材料的扫描电子显微镜图(SEM,见图2)。结果显示,纳米TiO2纳米管呈现棒状,直径在100 nm左右(图2A); TiO2-rGO复合材料的SEM图则显示,纳米TiO2表面均匀的覆盖着石墨烯(图2B),说明石墨烯与纳米TiO2很好的结合在一起。由于TiO2的带隙较宽,其电子空穴分离效果较差,而当石墨烯和TiO2复合时,石墨烯的较高电子传输速率特性,使得界面处的电子可及时从TiO2向石墨烯转移,从而降低TiO2光生电子-空穴复合,有利于促进电子的传输,增强光电流响应,提高方法灵敏度。

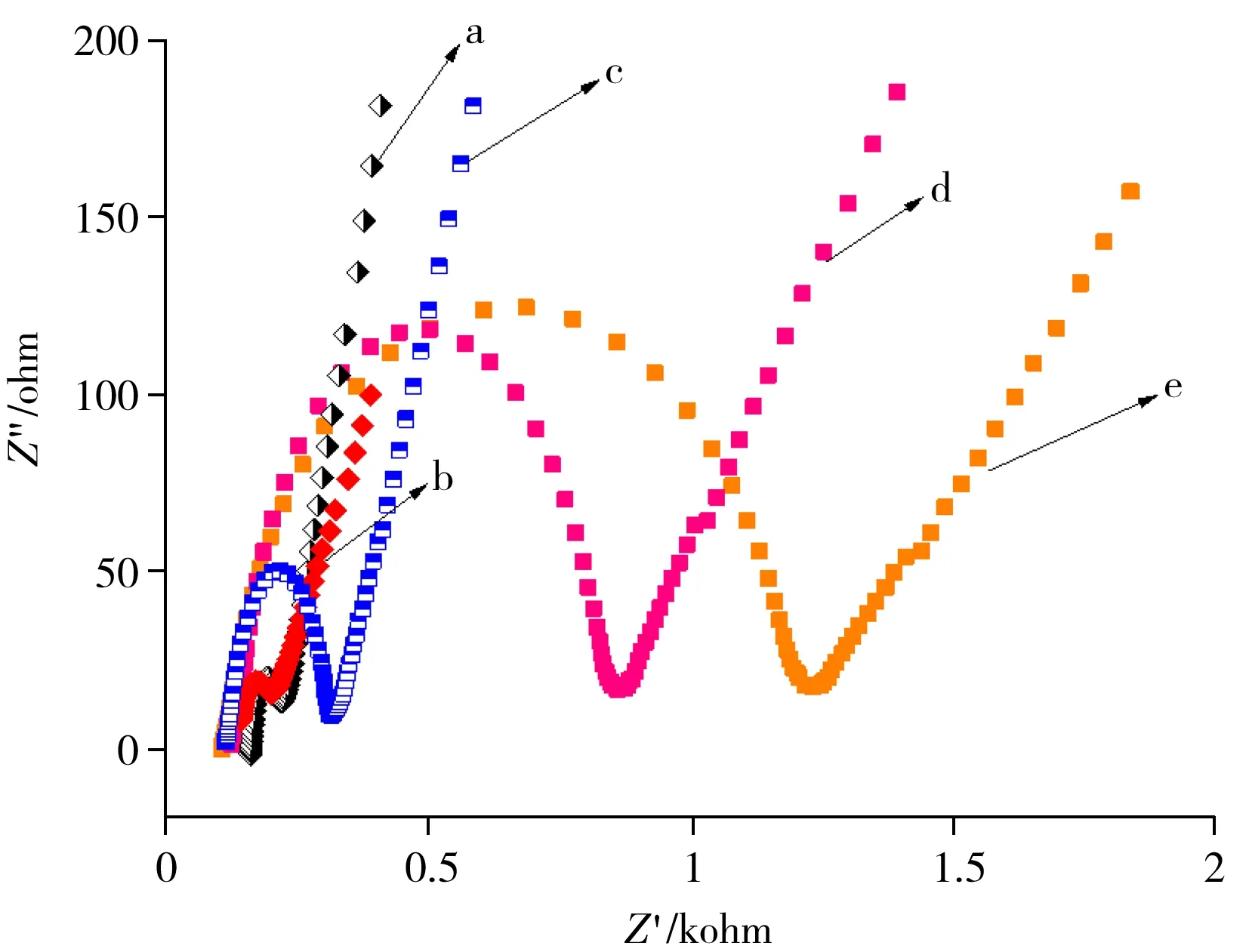
图3 不同修饰电极的阻抗图Fig.3 Impedance diagrams of different modified electrodesa.TiO2/FTO,b.TiO2-rGO/FTO,c.FTO,d.Aptamer/TiO2-rGO/FTO,e.OTC/Aptamer/TiO2-rGO/FTO
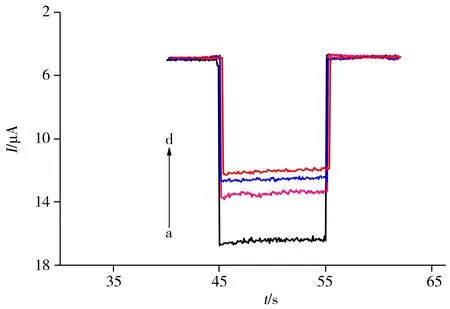
图4 不同修饰电极在PBS缓冲液中的光电流强度Fig.4 Photocurrent values of different modified electrodes in PBS buffera.TiO2-rGO/FTO,b.Aptamer/TiO2-rGO/FTO,c.TiO2/FTO,d.Aptamer/TiO2-rGO/FTO reacting with 100 nmol/L OTC
2.3 传感器的性能表征
2.3.1 不同修饰电极的阻抗分析考察了不同修饰电极(TiO2/FTO、TiO2-rGO/FTO、FTO裸电极、Aptamer/TiO2-rGO/FTO、OTC/Aptamer/TiO2-rGO/FTO)在电解质溶液 5 mmol/L K3Fe(CN)6-K4Fe(CN)6-0.2 mol/L KCl中的交流阻抗图(如图3)。根据图中的半圆直径大小,可以比较不同修饰电极的电子传递阻力,半径越大表示阻抗越大。从图中可以看出,在裸电极上修饰TiO2后,其阻抗值比裸电极小(曲线a、c),说明TiO2的修饰有利于电子的传递;在TiO2/FTO表面通过电化学法还原氧化石墨烯,得到TiO2-rGO/FTO后,其阻抗值进一步减小(曲线b),这是由于石墨烯优异的电子传输性能,有利于电子的传导。而当TiO2-rGO/FTO电极结合适配体后,由于适配体带负电荷,对氧化还原电对有排斥作用,阻碍了电子传递,因此阻抗增加(曲线d)。在其与目标物反应后,阻抗进一步增加(曲线e),说明适配体修饰电极通过适配体与目标物间的特异性作用已成功捕获OTC。
2.3.2 不同修饰电极的光电流响应图4为不同修饰电极在相同条件下的光电流响应。从图中可以观察到,TiO2-rGO/FTO电极产生的光电流明显大于TiO2/FTO电极产生的光电流(曲线a、c),这是因为石墨烯快速的电子传输性能,因此可以接收TiO2产生的光生电子并迅速地传递到导电基底上,有利于光生电荷与空穴的分离,从而使光电流增大[22]。当TiO2-rGO/FTO电极结合适配体后,所得Aptamer/TiO2-rGO/FTO电极产生的光电流(曲线b)明显小于TiO2-rGO/FTO电极产生的光电流。这是因为修饰上的碱基带负电,阻碍了光电子的转移,导致光电流变小。当Aptamer/TiO2-rGO/FTO电极结合100 nmol/L OTC后,其光电流进一步减小(曲线d),这是因为OTC与其适配体发生特异性结合,阻碍了光电子的转移,导致光电流变小。这也进一步验证了阻抗谱图的结果。
2.4 壳聚糖浓度及GO电化学还原时间的优化
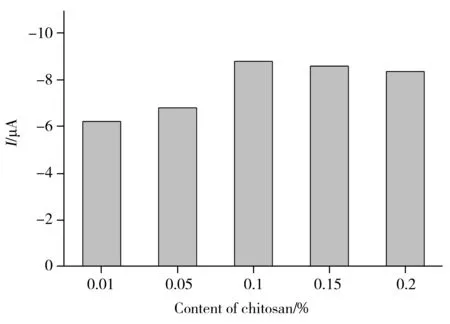
图5 壳聚糖浓度对Aptamer/TiO2-rGO/FTO电极光电流的影响Fig.5 Effect of chitosan content on photocurrent value of Aptamer/TiO2-rGO/FTO electrode
合适的壳聚糖浓度有利于提高壳聚糖成膜及稳定性,且通过壳聚糖丰富的氨基,采用戊二醛作为交联剂,可实现氨基修饰适配体的固定。因此,本实验考察了不同浓度壳聚糖对修饰电极光电流强度的影响。保持其它实验条件不变,分别向TiO2-rGO/FTO电极表面滴涂0.01%、0.05%、0.1%、0.15%、0.2%的壳聚糖溶液,通过戊二醛交联固定1.0 μmol/L适配体,得到Aptamer/TiO2-rGO/FTO电极后,测其在0.1 mol/L PBS中的光电流值(图5)。从图可知:光电流值随着壳聚糖浓度的增大而增大,当浓度达到0.1%后,继续增大壳聚糖浓度则其信号降低。这主要是因为壳聚糖达到一定浓度后,电极上修饰的适配体已饱和,继续增大壳聚糖浓度,会导致膜厚度增加,不利于电子的传递。因此,实验选择0.1%作为壳聚糖溶液的最佳浓度。
将TiO2/FTO电极浸入GO溶液中,用循环伏安法分别电化学还原不同时间(100、200、300、400、500 s)后,得到TiO2-rGO/FTO修饰电极,通过测定其在0.1 mol/L PBS溶液中的光电流值,以考察不同还原时间的影响。结果显示,随着电化学还原时间的增加,修饰电极表面还原的氧化石墨烯负载量增加,光电流响应增强,当还原时间为300 s时,光电流达到最大值,继续增加电化学还原时间,光电流值减小。这可能是由于沉积的还原氧化石墨烯量过多,不利于TiO2表面对光的吸收,从而降低了光电流响应。因此实验选择300 s作为最佳的电化学还原时间。
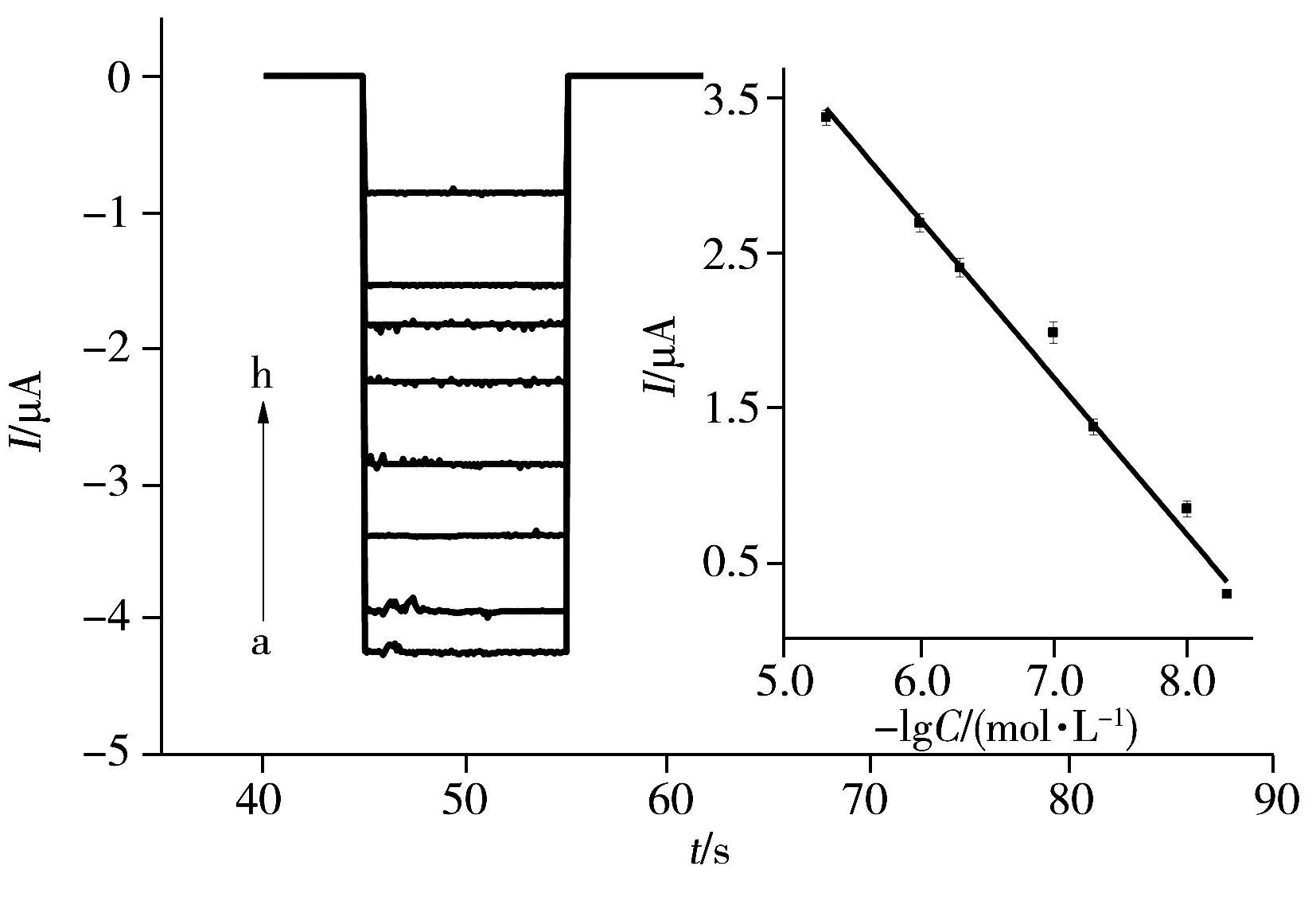
图6 Aptamer/TiO2-rGO/FTO对不同浓度土霉素的光电流值Fig.6 Photocurrent of different concentrations of oxytetracycline on Aptamer/TiO2-rGO/FTO oxytetracycline concentration(a-h):0,5.0,10 ,50,100,500,1 000,5 000(×10-9 mol/L);insert:linear relationship between photocurrent and concentration of oxytetracycline
2.5 传感器的线性范围及检出限
在上述优化条件下,于0.1 mol/L PBS(pH 7.4)缓冲溶液中,考察了适配体复合纳米材料修饰电极(Aptamer/TiO2-rGO/FTO)在不同浓度土霉素溶液中的光电流值(见图6),插图为不同浓度土霉素与光电流响应的线性图,误差棒来源于3次实验数据的标准偏差。由图可见,在5.0×10-9~5.0×10-6mol/L浓度范围内,传感器的光电流响应与目标物浓度呈良好线性,线性方程为:ΔI=-1.020 1C+8.844 5,r=0.988 7,其中ΔI为加入土霉素前后峰电流的差值(μA),C为土霉素浓度(mol/L)的负对数。依据3倍标准偏差(S/N=3)进行计算,得到此条件下土霉素的检出限为1.0×10-9mol/L。
将本方法的实验结果与文献报道的土霉素检测方法进行比较,结果如表1所示,该传感器的线性范围更宽,检出限较低,具有更好的性能。

表1 本方法与文献报道方法的比较Table 1 Comparison of the proposed detection method with the previously reported works
2.6 传感器的选择性
将构建的光电传感器用于与土霉素结构类似的其他抗生素溶液的检测。与同浓度的土霉素相比,金霉素、强力霉素、四环素、道诺霉素几乎均无光电流响应。说明构建的传感器具有良好的选择性。
2.7 传感器的重现性、重复性与稳定性
制备一支Aptamer/TiO2-rGO/FTO电极,在优化条件下,与1.0×10-7mol/L的土霉素反应60 min后,在0.1 mol/L PBS(pH 7.4)缓冲溶液中平行测定5次,测定其光电响应结果,计算出其相对标准偏差为3.5%,表明该体系的重现性良好。

图7 Aptamer/TiO2-rGO/FTO电极光电流的稳定性Fig.7 Photocurrent stability of Aptamer/TiO2-rGO/FTO electrode
制备5支Aptamer/TiO2-rGO/FTO电极,使其与1.0×10-7mol/L土霉素反应60 min后,在0.1 mol/L PBS(pH 7.4)缓冲溶液中测定其光电响应结果,计算出其相对标准偏差为3.4%,表明该体系的重复性良好。
制备一支 Aptamer/TiO2-rGO/FTO电极,在0.1 mol/L PBS(pH 7.4)缓冲溶液中测定300 s。如图7所示,可以看出其光电流基本稳定。再制备Aptamer/TiO2-rGO/FTO电极,先测定其在0.1 mol/L PBS(pH 7.4)缓冲溶液中的光电流,放入冰箱中1个星期,再次测定其光电流,得到的光电流为初始值的82.7%,表明Aptamer/TiO2-rGO/FTO电极的稳定性良好。
2.8 实验室制备样品的检测
由于采集的自来水及环境水样中均未检出土霉素,因此通过加标回收法对方法的准确性进行考察。分别向水样中加入3种不同浓度(20、4.0、2.0×10-6mol/L)土霉素进行测试(n=3),得到样品的回收率为93.0%~112%。该结果表明,本方法具有较高的准确度,有望用于实际样品的测定。
3 结 论
本文在FTO上先后用水热法及电化学方法制备了纳米TiO2/石墨烯光电传感基底,比较了单一材料及复合体系的光电化学性能。结合土霉素适配体对土霉素检测的专一性与光电化学法的快速、经济、简单、灵敏的优点,成功构建了一种性能优良、稳定性可靠、成本低、选择性好的测定土霉素的光电化学传感器,实现了对水样中微量土霉素的检测。在优化条件下,该传感器的线性范围为5.0×10-9~5.0×10-6nmol/L,检出限为1.0×10-9mol/L,有望用于实际样品中微量土霉素残留的测定。
