基于脾脏代谢组学方法研究低聚硒化氨基多糖对黑鲷的免疫调节作用
2019-10-23周秀锦邵宏宏相兴伟冷向阳杨会成
周秀锦,张 静,邵宏宏,相兴伟,冷向阳,杨会成*
(1.舟山海关综合技术服务中心,浙江 舟山 316000;2.浙江海洋开发研究院,浙江 舟山316000;3.SCIEX公司,上海 200335)
黑鲷(Acathopagrusschlegelii)是我国东南沿海地区及太平洋西岸海水养殖的经济鱼类[1],但由于其病害原因,严重阻碍了黑鲷养殖业的发展[2]。硒(Se)是生物必需的微量矿物元素,是谷胱甘肽过氧化物酶和脱碘酶的组成成分,在水产动物生长性能、抗氧化能力、免疫功能等方面有重要作用[3]。其中有机硒比无机硒具有更高的生物利用率[4]。低聚硒化氨基多糖作为一种有机硒化合物,其生物活性普遍高于多糖和硒,更易被机体吸收和利用[5]。其对小鼠单核巨噬细胞白血病细胞(RAW264.7)具有一定的免疫调节作用[6],可作为增强适应性免疫功能的潜力含硒膳食补充剂[7]。脾脏是鱼类重要的免疫和造血器官,包含多种非特异性免疫细胞和体液免疫因子[8],具有造血、滤血和免疫的功能[9]。目前,关于黑鲷对低聚硒化氨基多糖的利用已有初步研究[10],但利用代谢组学技术研究低聚硒化氨基多糖对黑鲷脾脏免疫调节机制的报道较少。
代谢组学能够将反映样品原始信息的高分辨质谱(HR MS)和核磁共振(NMR)等复杂数据经过一系列降维处理后,直接反映体内生物化学过程和状态的变化,在系统研究生物内源性小分子代谢物的整体和动态变化规律方面具有独特优势[11-17]。本研究利用高通量、高灵敏度、高分辨的超高效液相色谱-飞行时间质谱检测技术(UPLC-TOF-MS)和非靶向代谢组学方法,阐释低聚硒化氨基多糖对黑鲷免疫调节的潜在机制和靶标途径,可为黑鲷免疫增强剂的开发提供参考。
1 实验部分
1.1 材料与试剂
乙腈、甲醇、甲酸、间氨基苯甲酸乙酯甲磺酸盐(MS-222,60 mg/L)均为色谱纯,购于美国Sigma-Aldrich 公司;低聚氨基多糖(LA,浙江金壳生物化学有限公司)分子量约为50 kDa;低聚硒化氨基多糖为自制,其中硒的有效含量为27.3×103mg/kg。
1.2 仪器与设备
AB SCIEX ExionLC AD & Triple TOF 5600+液相色谱-质谱联用系统(美国AB SCIEX公司);XS105分析天平(瑞士Mettler Toledo公司);ST-16R型高速冷冻离心机(美国Thermo公司);氮吹仪(美国Organomation公司)。
1.3 实验方法
1.3.1 动物实验及样品处理黑鲷幼鱼由浙江省海洋水产研究所试验场提供,停止饲养1 d,挑选健康、大小均匀、体重为(13.00±0.20) g的幼鱼随机分为2组,每组3个重复,每个重复为25尾鱼,放入容积为310 L(水体260 L)的玻璃纤维缸内微流水式饲养。在普通饲料中添加0.6 mg Se/kg低聚硒化氨基多糖作为实验组,同时做空白组,实验周期为8周。结束后将鱼饥饿24 h,再用MS-222(60 mg/L)麻醉,取出脾脏组织,实验组和空白组各取10个平行样品,称重后,用液氮快速冷冻,然后置于-80 ℃的超低温冰箱中保存,备用。
1.3.2 样品前处理取适量的样品于15 mL离心管中,用10倍体积的甲醇(-20 ℃)进行匀浆后,于4 ℃下以13 000 r/min离心15 min,取5.0 mL上清液40 ℃氮气吹干,用1.0 mL的甲醇水(体积比4∶1)复溶,待测。以“1.3.1”中实验组和空白组为质控样品(QC)进行方法验证,各取上述样品的上清液1.0 mL,混合均匀,40 ℃氮气吹干,以1.0 mL的甲醇水(4∶1)复溶待测。在样品分析前,先运行3次QC样品;在样品检测过程中,每隔5个样品运行1次QC样品。共运行7次QC样品,以监控检测系统的稳定性。
1.3.3 色谱与质谱检测条件色谱条件:C18色谱柱:Waters HSS T3(150 mm×2.1 mm,2.5 μm)(侧重分析极性小的小分子代谢物),流动相:A为H2O(含2 mmol/L甲酸铵+0.05%甲酸),B为乙腈+异丙胺(体积比1∶1);HILIC色谱柱:Acquity UPLC BEH Amide(100 mm×2.1 mm,1.7 μm)(侧重分析极性大的小分子代谢物),流动相:C为H2O(含10 mmol/L 甲酸铵+0.1%甲酸),D为乙腈水(体积比95∶5)(含10 mmol/L 甲酸铵+0.1%甲酸),梯度洗脱程序见表1。流速:0.3 mL/min,进样盘温度:4 ℃,柱温:40 ℃,进样量:2 μL。
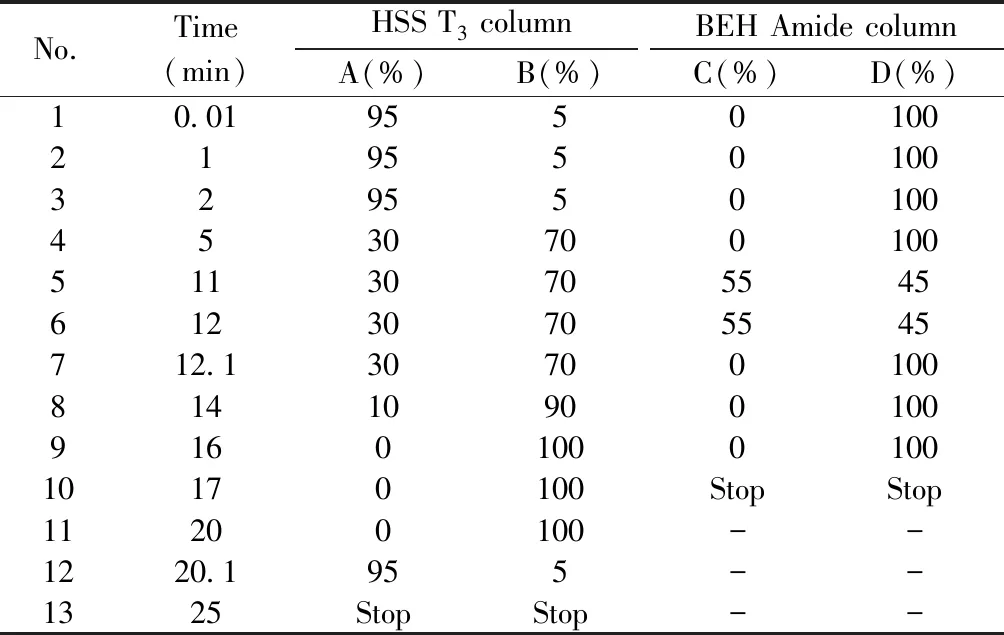
表1 不同色谱柱的流动相梯度洗脱程序Table 1 Mobile phase gradient elutions in different chromatographic column
质谱条件:采用AB SCIEX ExionLC AD & Triple TOF 5600+液相色谱-质谱联用仪进行检测,电喷雾离子化(ESI) 源正、负离子扫描模式;喷雾电压(IS):正离子5 500 V,负离子-4 500 V;离子化温度(TEM):550 ℃;雾化气:414 kPa;辅助加热气:414 kPa;气帘气:241 kPa。一级质谱采集范围:m/z100~1 250,累积时间:0.10 s;去簇电压:80 V。采用数据关联采集(IDA)模式采集二级质谱,采集范围:m/z50~1 250,累积时间:0.05 s,去簇电压:80 V;碰撞能量:(40±20) eV。IDA转换标准为:信号强度>100 cps,分子量误差为50 mDa,每个循环最多监测10个离子,在4 Da内排除同位素。采用Analyst TF 1.7.1软件控制液相色谱-质谱分析系统,并采集分析数据。
1.4 数据处理
利用XCMSplus[16]对采集的数据进行非靶向代谢组学分析,采用Centwave特征检测算法(峰值宽度为5~20 s,质量允差为5 ppm)进行峰的发现和匹配,找到有差异的化合物,XCMSPlus软件会自动链接到METLIN数据库(该库有超过24万个代谢物信息,其中12 127个代谢物有高分辨二级图谱)。结合SCIEX公司的内源性代谢物二级谱库(Metabolite HR MS2library,包含550多个常见内源性代谢物的分子式、分子量、CAS编号、化学名、结构图),通过与谱库中化合物的精确一级m/z、同位素丰度比和二级质谱信息比对,鉴定得到差异物,并对这些差异物进行聚类分析,找出差异通路。
2 结果与讨论
2.1 质谱分析
代谢物是根据测量的质量数来确定,因此,持续准确的质量测量对于代谢组学实验至关重要。飞行时间(TOF)质谱仪对温度波动很敏感,需定期校准。本实验使用的AB SCIEX ExionLC AD & Triple TOF 5600+系统采用外部校准方法,测量的质量误差控制在5 ppm以内,可确保获得的数据准确有效。IDA模式下,在触发 TOF-MS/MS时,需要监控TOF-MS/MS的最大数,这会影响数据采集的信息量。在最大限度地增加TOF-MS/MS事件数来提高子离子采集量的同时,也需确保色谱峰有足够的采集数据点数。此外,质量精度受离子积累时间的影响,当积累时间设置过低时,获得谱数较少,导致质量精度较差。本实验采用的IDA方法为:扫描时间0.15 s和10个MS/MS事件,每个事件的子离子累积时间为0.05 s,循环时间为0.7 s,可使每个色谱峰均具有10~12个采集数据点,为质谱的统计评价和代谢物鉴定提供了高质量的TOF-MS和TOF-MS/MS数据。在对分析数据进行预处理前,首先对获得的分析数据质量和有效性进行验证。数据有效性验证结果表明,QC样品中分布于不同保留时间(tR)的代表性离子色谱峰强度的相对标准偏差(RSD)<5%,tR的漂移<0.1 min,m/z波动范围不超过5 ppm。对不同采集模式下运行7次的QC样品总离子流(TIC)色谱图进行比较,结果显示7次QC样品的TIC图谱重合,无明显偏差,确保了采集数据的有效性。
2.2 脾脏代谢轮廓分析
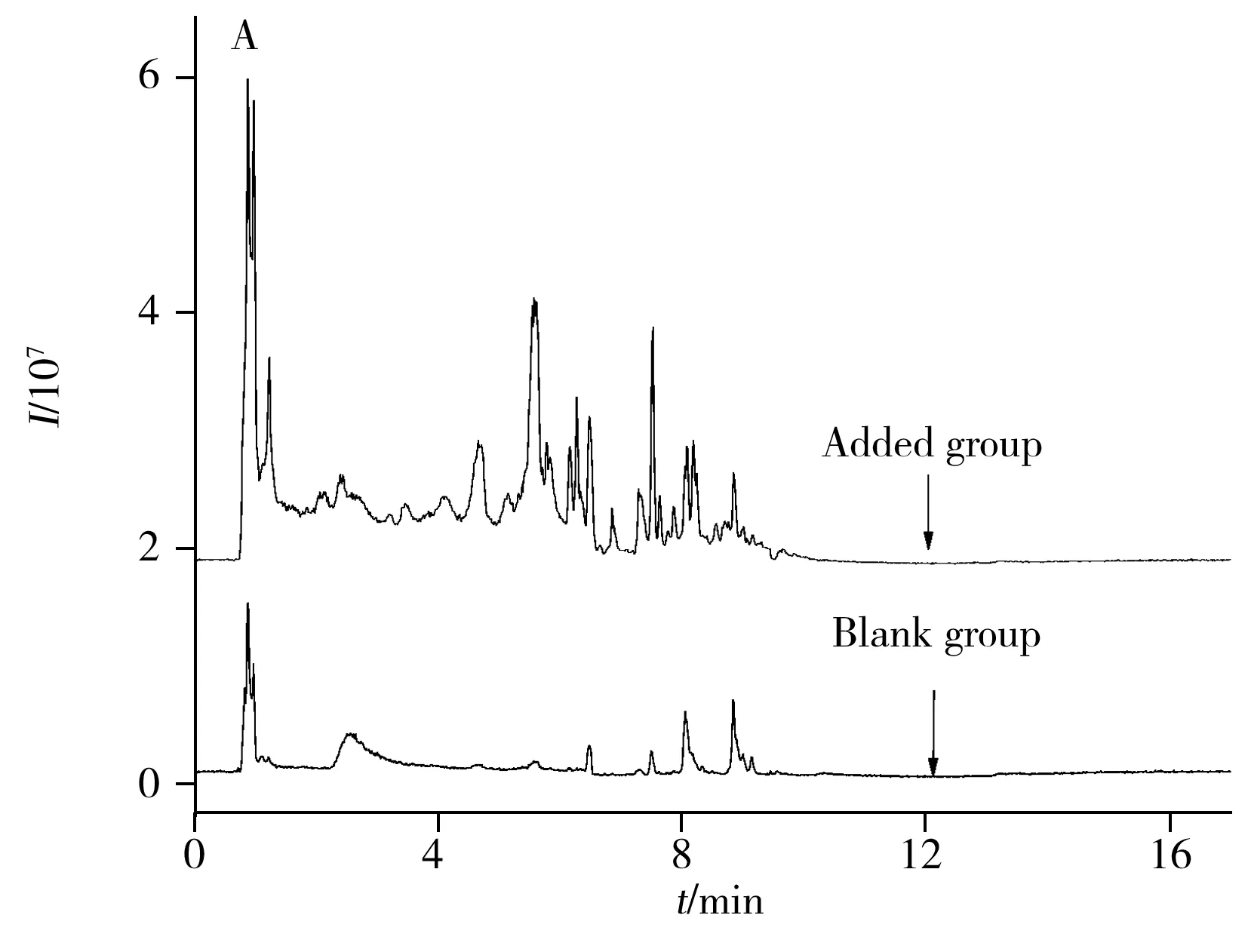
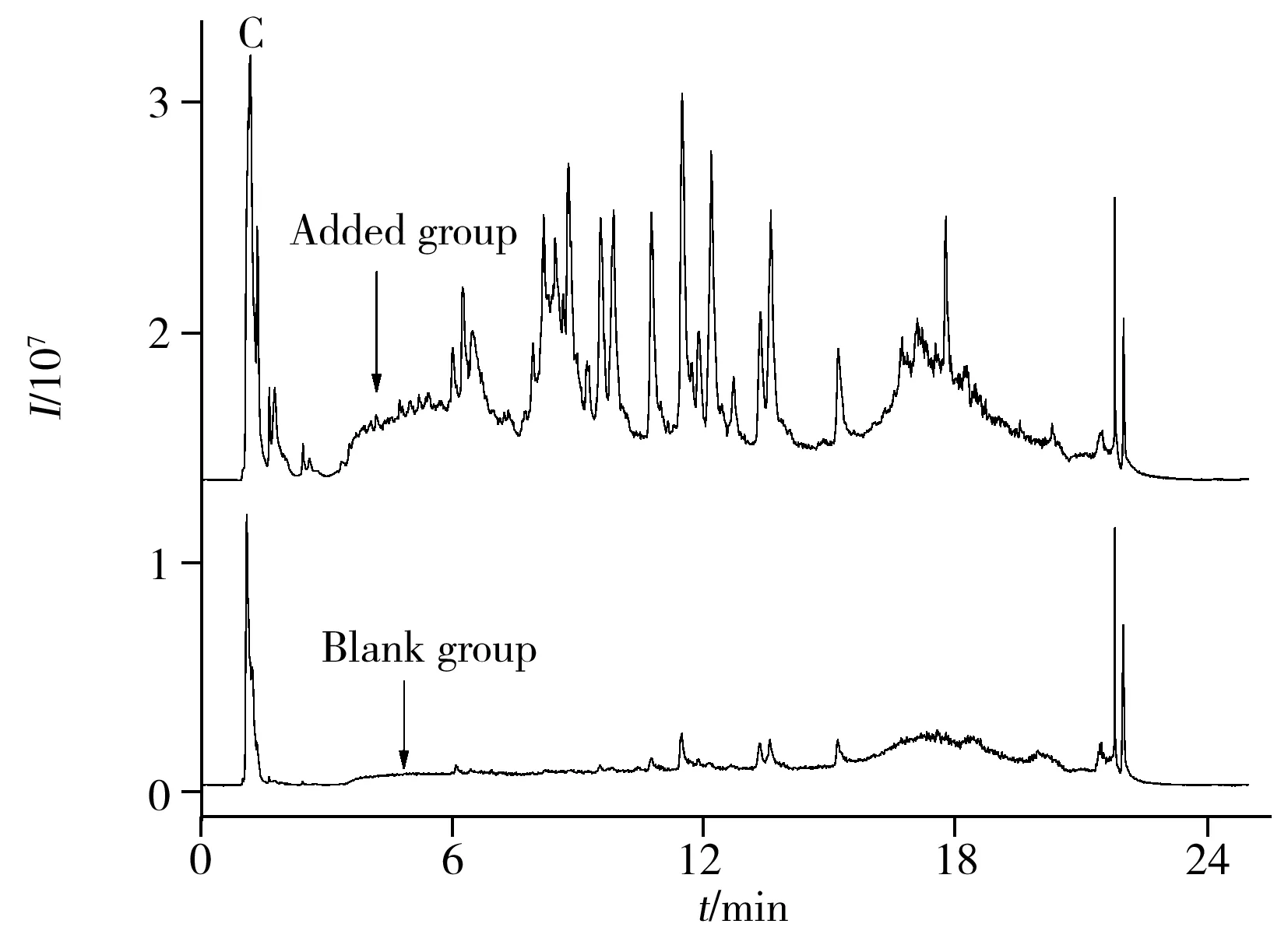
针对脾脏样品中极性小和极性大的小分子代谢物,本研究分别采用C18和HILIC两种不同的色谱柱进行分离,以甲酸铵、甲酸与乙腈(添加异丙胺或水)为流动相[17-18]梯度洗脱,并结合TOF-MS技术分别在正、负离子模式下对脾脏样品进行分离和数据采集,提高了非靶向分析的准确性。图1为不同采集模式下各组样品典型的总离子流色谱图(TIC)。由图1可知,空白组和饲喂低聚硒化氨基多糖实验组相比,后者的指纹图谱均多于前者,表明低聚硒化氨基多糖对黑鲷脾脏的内源性代谢物有一定的影响。
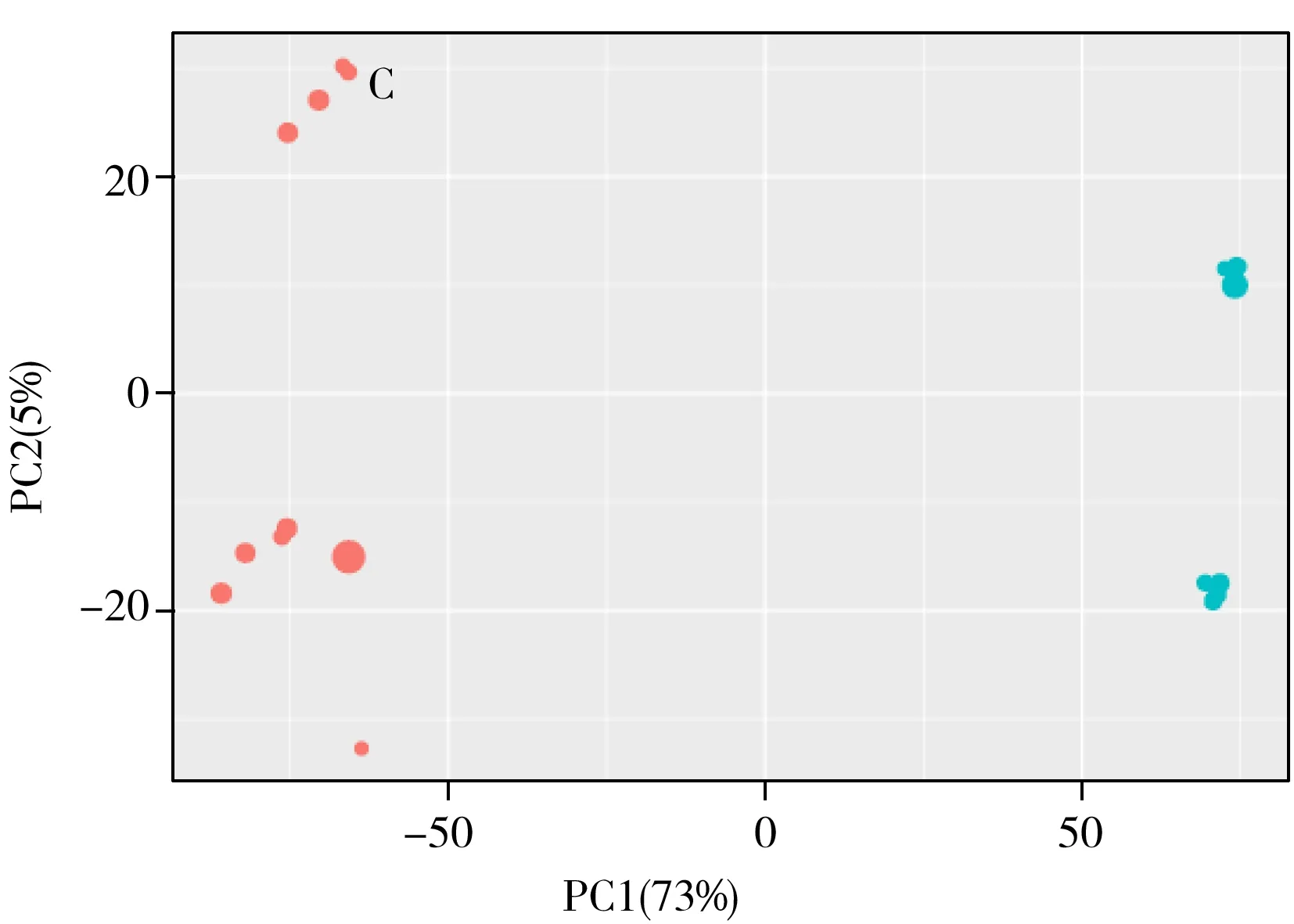
通过XCMSplus软件分析质谱采集的数据,采用有监督的主成分分析(PCA)法自动进行PCA轮廓分析,在正、负离子模式下,饲喂低聚硒化氨基多糖实验组和空白组的黑鲷脾脏代谢轮廓分析的PCA结果见图2。由图2可知,在4种采集模式下,实验组与空白组均可明显区分,无交叉和重叠,表明饲喂低聚硒化氨基多糖后,黑鲷脾脏代谢产物的指纹图谱均发生了显著变化。
2.3 潜在生物标志物的鉴定
通过一级质谱信息确定相对分子量,利用二级质谱信息获得其结构碎片数据以鉴定潜在生物标志物。将C18色谱柱和HILIC色谱柱在正、负离子模式下的质谱检测结果通过检索Metabolite HR MS2library数据库,共准确鉴定出36个有差异的潜在生物标志物(见表2)。以C18色谱柱在正离子扫描模式下的离子m/z148.060 1为例,该离子的保留时间为1.20 min,质谱图符合[M+H]+模式,其提取离子色谱图与一级质谱图见图3A和图3B,与标准品的二级质谱图(3C)完全一致,确定该潜在生物标志物为L-谷氨酸。由表2可知,与空白组相比,实验组有27种生物标志物的水平升高,有9种降低,说明低聚硒化氨基多糖对黑鲷脾脏代谢水平具有显著的调节作用。
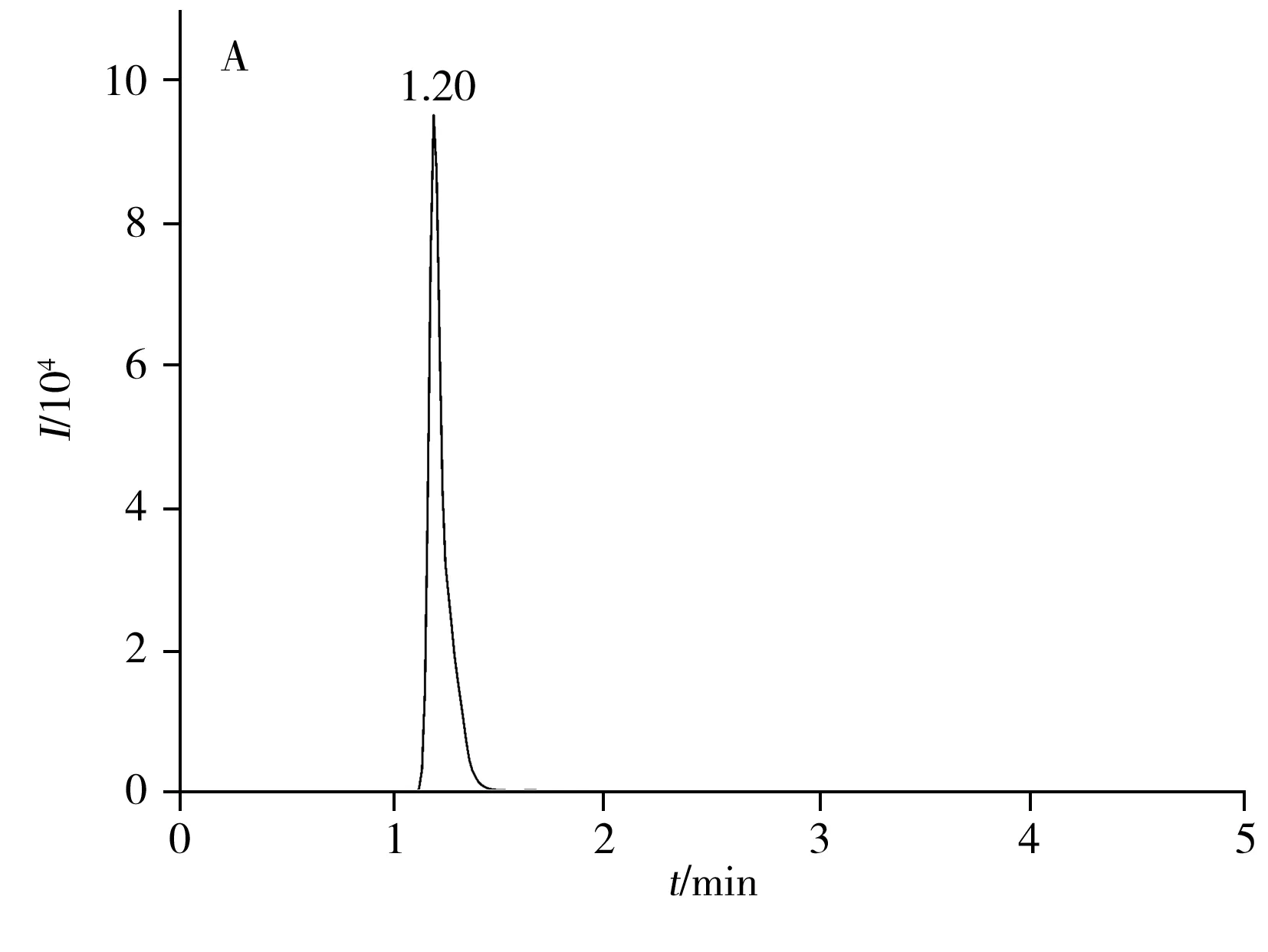
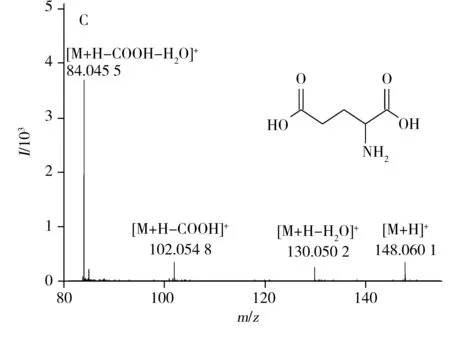
图3 正离子模式下L-谷氨酸的提取离子色谱图(A)、一级质谱图(B)及标准品的二级质谱图(C)Fig.3 Extraction ion chromatogram(A),full MS spectrum(B) and standard MS/MS spectrum(C) of L-glutamic acid in positive ion mode
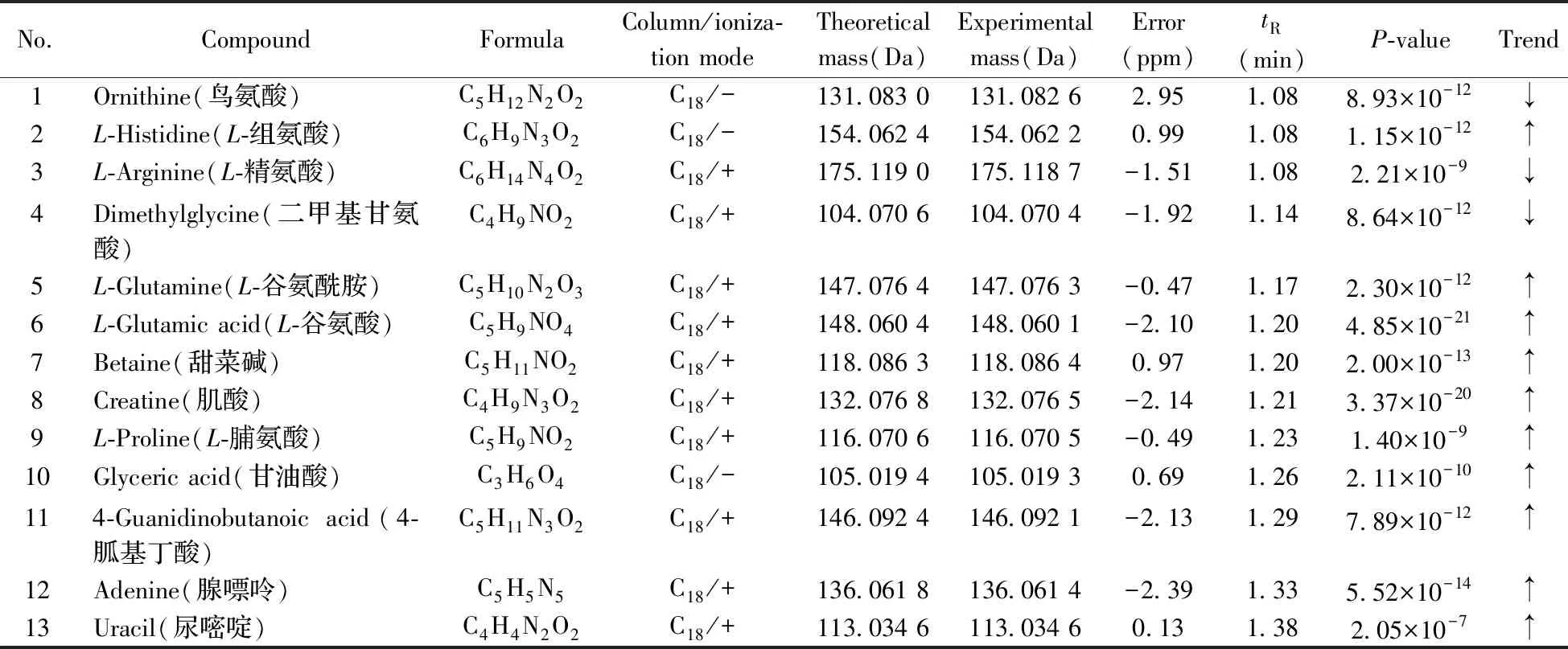
No.CompoundFormulaColumn/ioniza-tion modeTheoretical mass(Da)Experimental mass(Da)Error(ppm)tR(min)P-valueTrend1Ornithine(鸟氨酸)C5H12N2O2C18/-131.083 0131.082 62.951.088.93×10-12↓2L-Histidine(L-组氨酸)C6H9N3O2C18/-154.062 4154.062 20.991.081.15×10-12↑3L-Arginine(L-精氨酸)C6H14N4O2C18/+175.119 0175.118 7-1.511.082.21×10-9↓4Dimethylglycine(二甲基甘氨酸)C4H9NO2C18/+104.070 6104.070 4-1.921.148.64×10-12↓5L-Glutamine(L-谷氨酰胺)C5H10N2O3C18/+147.076 4147.076 3-0.471.172.30×10-12↑6L-Glutamic acid(L-谷氨酸)C5H9NO4C18/+148.060 4148.060 1-2.101.204.85×10-21↑7Betaine(甜菜碱)C5H11NO2C18/+118.086 3118.086 40.971.202.00×10-13↑8Creatine(肌酸)C4H9N3O2C18/+132.076 8132.076 5-2.141.213.37×10-20↑9L-Proline(L-脯氨酸)C5H9NO2C18/+116.070 6116.070 5-0.491.231.40×10-9↑10Glyceric acid(甘油酸)C3H6O4C18/-105.019 4105.019 30.691.262.11×10-10↑114-Guanidinobutanoic acid(4-胍基丁酸)C5H11N3O2C18/+146.092 4146.092 1-2.131.297.89×10-12↑12Adenine(腺嘌呤)C5H5N5C18/+136.061 8136.061 4-2.391.335.52×10-14↑13Uracil(尿嘧啶)C4H4N2O2C18/+113.034 6113.034 60.131.382.05×10-7↑
(续表2)
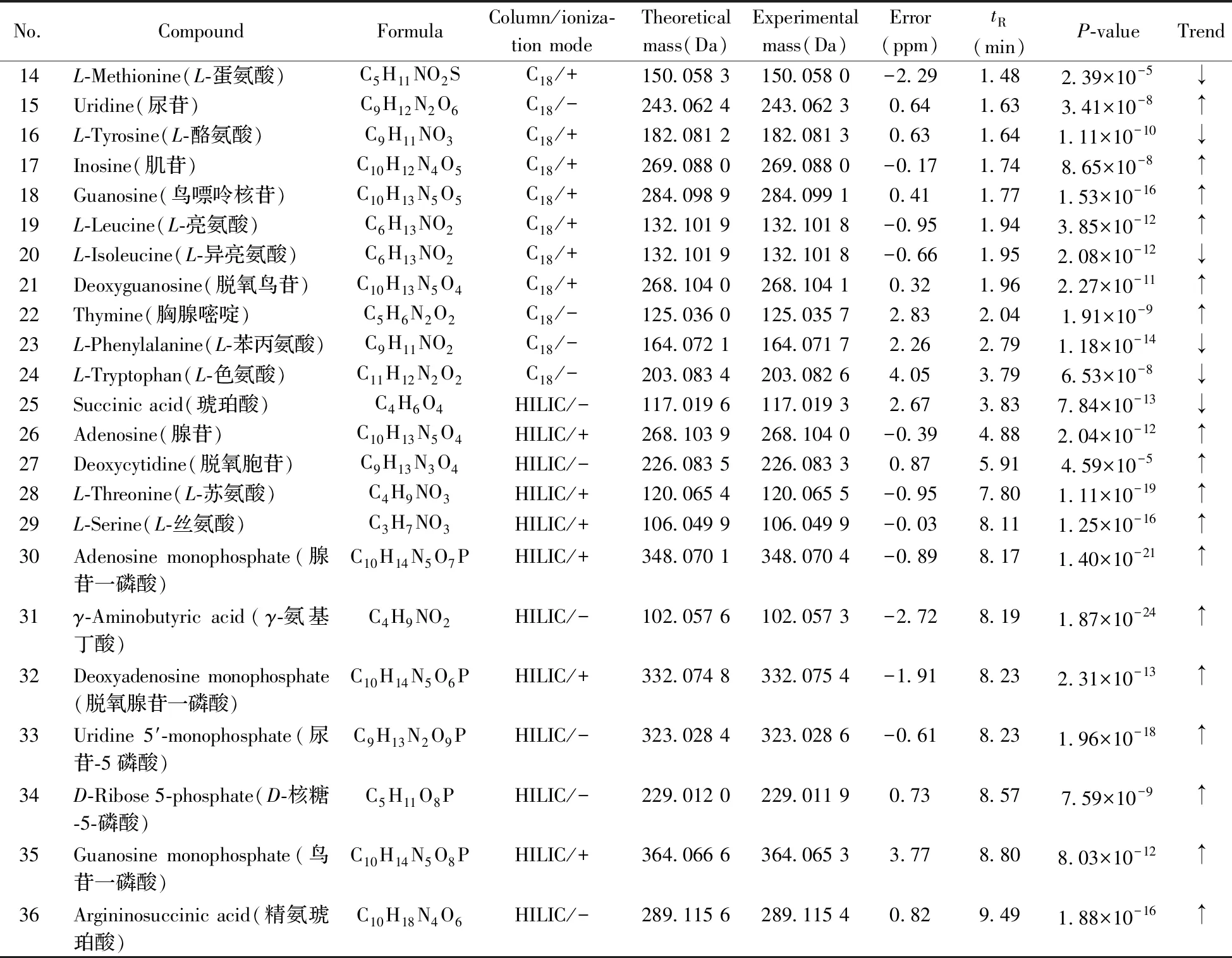
No.CompoundFormulaColumn/ioniza-tion modeTheoretical mass(Da)Experimental mass(Da)Error(ppm)tR(min)P-valueTrend14L-Methionine(L-蛋氨酸)C5H11NO2SC18/+150.058 3150.058 0-2.291.482.39×10-5↓15Uridine(尿苷)C9H12N2O6C18/-243.062 4243.062 30.641.633.41×10-8↑16L-Tyrosine(L-酪氨酸)C9H11NO3C18/+182.081 2182.081 30.631.641.11×10-10↓17Inosine(肌苷)C10H12N4O5C18/+269.088 0269.088 0-0.171.748.65×10-8↑18Guanosine(鸟嘌呤核苷)C10H13N5O5C18/+284.098 9284.099 10.411.771.53×10-16↑19L-Leucine(L-亮氨酸)C6H13NO2C18/+132.101 9132.101 8-0.951.943.85×10-12↑20L-Isoleucine(L-异亮氨酸)C6H13NO2C18/+132.101 9132.101 8-0.661.952.08×10-12↓21Deoxyguanosine(脱氧鸟苷)C10H13N5O4C18/+268.104 0268.104 10.321.962.27×10-11↑22Thymine(胸腺嘧啶)C5H6N2O2C18/-125.036 0125.035 72.832.041.91×10-9↑23L-Phenylalanine(L-苯丙氨酸)C9H11NO2C18/-164.072 1164.071 72.262.791.18×10-14↓24L-Tryptophan(L-色氨酸)C11H12N2O2C18/-203.083 4203.082 64.053.796.53×10-8↓25Succinic acid(琥珀酸)C4H6O4HILIC/-117.019 6117.019 32.673.837.84×10-13↓26Adenosine(腺苷)C10H13N5O4HILIC/+268.103 9268.104 0-0.394.882.04×10-12↑27Deoxycytidine(脱氧胞苷)C9H13N3O4HILIC/-226.083 5226.083 30.875.914.59×10-5↑28L-Threonine(L-苏氨酸)C4H9NO3HILIC/+120.065 4120.065 5-0.957.801.11×10-19↑29L-Serine(L-丝氨酸)C3H7NO3HILIC/+106.049 9106.049 9-0.038.111.25×10-16↑30Adenosine monophosphate(腺苷一磷酸)C10H14N5O7PHILIC/+348.070 1348.070 4-0.898.171.40×10-21↑31γ-Aminobutyric acid(γ-氨基丁酸)C4H9NO2HILIC/-102.057 6102.057 3-2.728.191.87×10-24↑32Deoxyadenosine monophosphate(脱氧腺苷一磷酸)C10H14N5O6PHILIC/+332.074 8332.075 4-1.918.232.31×10-13↑33Uridine 5′-monophosphate(尿苷-5磷酸)C9H13N2O9PHILIC/-323.028 4323.028 6-0.618.231.96×10-18↑34D-Ribose 5-phosphate(D-核糖-5-磷酸)C5H11O8PHILIC/-229.012 0229.011 90.738.577.59×10-9↑35Guanosine monophosphate(鸟苷一磷酸)C10H14N5O8PHILIC/+364.066 6364.065 33.778.808.03×10-12↑36Argininosuccinic acid(精氨琥珀酸)C10H18N4O6HILIC/-289.115 6289.115 40.829.491.88×10-16↑
2.4 代谢途径分析
根据鉴定出的潜在生物标志物,利用MetaboAnalyst 4.0网站,选择鱼为分析模型进行相关的代谢通路分析。经过软件分析,上述36种潜在生物标志物主要指向9条代谢通路(P<0.05),包括氨酰-转运RNA(tRNA)合成、氨基酸代谢、核苷酸代谢、氮代谢等(见表3)。
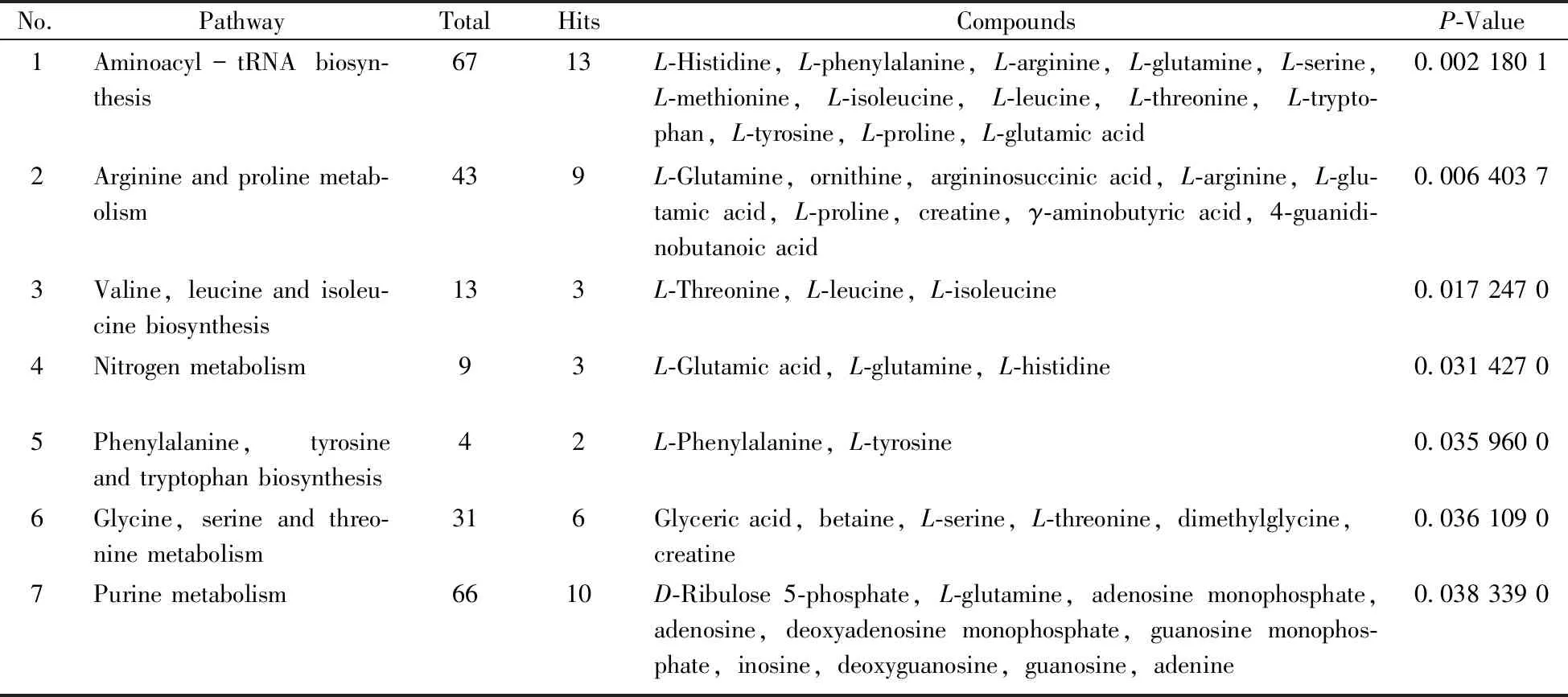
表3 36种潜在生物标志物的代谢通路分析结果Table 3 Metabolic pathways results of 36 potential biomarkers
(续表3)
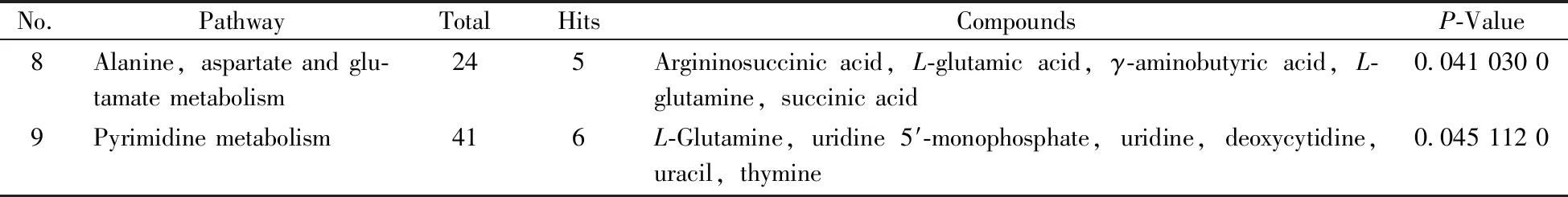
No.PathwayTotalHitsCompoundsP-Value8Alanine,aspartate and glu-tamate metabolism245Argininosuccinic acid,L-glutamic acid,γ-aminobutyric acid,L-glutamine,succinic acid0.041 030 09Pyrimidine metabolism416L-Glutamine,uridine 5′-monophosphate,uridine,deoxycytidine,uracil,thymine0.045 112 0
2.5 潜在生物标志物的功能性分析
氨基酸是构成机体免疫系统的基本物质,与免疫系统的形成、器官发育以及功能的发挥有着密切关系。经代谢通路分析发现,低聚硒化氨基多糖实验组与空白组相比,在氨基酸合成或代谢、氨酰-tRNA生物合成、嘌呤代谢、氮代谢上存在较显著的差异(P<0.05),潜在标志物(表2)结果表明,在给予低聚硒化氨基多糖后共有 27个潜在标志物的浓度水平显著上调。代谢通路(表3)结果表明,有13个氨基酸代谢产物参与黑鲷脾脏的氨酰-tRNA生物合成通路,每种tRNA分子均需与相应的氨基酸结合,将氨基酸运送到核糖体进行蛋白质合成,若氨酰-tRNA合成通路发生障碍,蛋白质的合成必受影响,进而降低脾脏的免疫能力。有3个潜在标志物参与了缬氨酸、亮氨酸和异亮氨酸的生物合成,亮氨酸和异亮氨酸属于支链氨基酸,具有促进蛋白质合成、抑制蛋白质分解的多种生理功能,其合成所需的碳骨架来源于糖无氧代谢和有氧代谢的中间产物,L-苏氨酸和L-亮氨酸上调可能是通过参与机体能量代谢来促进乳酸-葡萄糖的循环和通过促进糖异生来维持糖原水平、缓解肌肉酸痛并延缓疲劳的发生发展[19-20]。结果显示黑鲷脾脏的免疫功能与氨基酸代谢有密切关系。
在精氨酸和脯氨酸代谢通路中,与空白组相比,实验组中精氨酸的含量呈下降趋势。精氨酸是鱼类的必需氨基酸之一,可促进免疫系统分泌自然杀手细胞、吞噬细胞、白血球内烯素等内生性物质,通过作用于哺乳动物雷帕霉素靶蛋白(mTOR)复合体Ⅰ[21-22]参与对抗癌细胞及预防病毒感染,提高机体免疫力。精氨酸代谢在调节先天免疫和适应性免疫中同样具有重要作用[23]。精氨酸及其代谢产物一氧化氮(NO)、鸟氨酸和瓜氨酸可通过生长激素等内分泌激素起到增强细胞吞噬和杀菌、促进免疫球蛋白的合成等免疫调节作用[24-26]。在机体中精氨酸主要通过2个代谢途径参与免疫调控[27-28]:其一为精氨酸酶途径,即精氨酸转化成鸟氨酸并进一步生成多胺,鸟氨酸和多胺在动物的免疫调节中发挥着重要作用;另一途径为精氨酸代谢成NO,NO不仅对巨噬细胞发挥吞噬效应有重要作用,还对巨噬细胞和淋巴细胞的连接和激活有影响,有助于提高免疫细胞的呼吸爆发活性、吞噬作用和溶菌酶的活力[29-30]。本实验中精氨酸含量的降低可能是由于硒化氨基多糖促进精氨酸酶解为鸟氨酸和代谢为NO,从而增强机体的免疫调节作用。谷氨酰胺[31-32]可以促进巨噬细胞和淋巴细胞的有丝分裂和分化增殖,增加机体的免疫功能。实验组和空白组中多种代谢生物标志物的含量存在显著差别,表明低聚硒化氨基多糖的免疫增强作用可能与氨基酸代谢密切相关。
3 结 论
本文采用UPLC-TOF-MS技术对饲喂低聚硒化氨基多糖的黑鲷脾脏进行了代谢组学研究。采用C18和HILIC两种色谱柱结合XCMSPlus软件进行数据分析,共筛选出36个有差异的潜在生物标志物,均呈现一定的上调或下调趋势。经MetaboAnalyst4.0网站分析,发现饲喂低聚硒化氨基多糖对黑鲷的氨基酸合成或代谢、氨酰-tRNA生物合成、嘌呤代谢、氮代谢通路产生了影响,低聚硒化氨基多糖发挥免疫增强作用可能与氨基酸代谢有较为密切的关系。本研究从整体水平上反映了饲喂低聚硒化氨基多糖后黑鲷脾脏内源性小分子的代谢变化,为深入探讨低聚硒化氨基多糖的免疫增强机制奠定了一定基础,并有助于黑鲷免疫增强剂的开发。
