变化观念与平衡思想中“博弈”意识的树立
2019-10-23李旭林
李旭林
(山西省临汾第一中学校 041000)
发挥化学课程的整体育人功能,就必须立足于学生适应现代生活和未来发展的需要.而博弈论目前已经在经济学、国际关系学、政治学、军事战略、生物学等很多学科广泛地应用.所以“变化观念与平衡思想”核心素养的构成要素中,不仅要有物质变化与能量变化、方向与限度、速率与平衡、守恒与定量关系的表征,还应该逐步渗透“博弈与平衡”思维意识.
化学平衡状态存在于可逆反应,而可逆反应是在一定条件下,正反应和逆反应同时发生的反应.既然正、逆反应同时发生,它们之间就会存在相互的“博弈”,博弈的结果就是可逆反应在达到平衡状态时存在一定的限度.本文就应用“博弈与平衡”思维意识解决酸碱反应、氧还反应以及电化学相关问题进行分析,阐述如下.
一、酸碱反应中的“博弈与平衡”意识

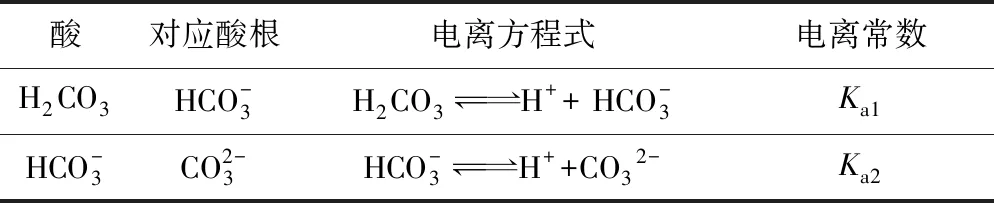
酸对应酸根电离方程式电离常数H2CO3HCO- 3H2CO3H+ + HCO-3Ka1HCO-3CO2-3HCO-3H++CO32-Ka2
因为较强的酸易电离出H+,即其对应的酸根难以与H+结合;同理较弱的酸难电离出H+,即其对应的酸根就易与H+结合.所以,当较强的酸遇到较弱酸对应的盐溶液时,就存在“强酸与弱酸根反应”与“弱酸与强酸根反应”之间的博弈,其结果就是以“弱酸根与强酸电离出的H+结合生成弱酸”为主.可以表征为:强酸 + 弱酸盐(弱酸根)= 弱酸 + 强酸盐(强酸根).

例1(2015年课标Ⅰ卷26题节选)设计实验证明:草酸的酸性比碳酸的强____.
例2(2015年福建卷23题节选)25℃,两种酸的电离平衡常数如下表:

Ka1Ka2H2SO31.3×10-26.3×10-8H2CO34.2×10-75.6×10-11
H2SO3溶液和NaHCO3溶液反应的主要离子方程式为____.
二、原电池原理中的“博弈与平衡”意识
大多数学生在初学原电池原理时,总是想不通化学电源的“电动势”从何而来.不需引入“双电层”理论、电极电势、能斯特方程等复杂知识,利用“博弈与平衡”意识来分析,便可以轻松理解.例如,对人教版选修4中锌铜原电池(丹尼尔电池)装置(如图1所示)分析如下.


2.在未形成闭合回路时,上述两平衡互不干涉.但是,用导线连接锌棒和铜棒,并用盐桥连接两个烧杯中的溶液形成闭合回路后,两个平衡就会开始“博弈”.由于Zn(s)失电子能力(还原性)比Cu(s)强,而Cu2+得电子能力(氧化性)比Zn2+强,而且导线的电阻几乎为0,所以Zn失电子通过导线向Cu移动,Cu2+得电子生成Cu.


两个平衡的博弈,就是产生“电动势”的原因.
例3(2019年广东七校高考冲刺11题)因存在浓度差而产生电动势的电池称为浓差电池.利用如图所示装置进行实验,开始先闭合K2,断开KL,一段时间后,再断开K2,闭合KL,形成浓差电池,电流计指针偏转(Ag+浓度越大,氧化性越强).下列说法不正确的是( ).

A. 闭合K2,断开KL一段时间后,X电极质量增加
B. 闭合K2,断开KL一段时间后,右池c(AgNO3)增大
C. 断开K2,闭合K1,X电极发生氧化反应


三、氧化还原反应中的“博弈与平衡”意识
与酸碱反应类似,氧还反应中同样存在“强强成弱”的规律,也就是在一个氧还反应中氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物.这条规律,在解题时经常用到,但一部分同学只是一般性套用规律,平时备考复习过程中没有深刻体会其中的“博弈与平衡”的思维方式,所以在遇到2019年全国I卷28题,就会“深入山中”,不知所云.

(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250.②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192.
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO____H2(填“大于”或“小于”).
(2)721℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为____(填标号).
A.<0.25 B.0.25 C.0.25~0.50
D.0.50 E.>0.50

(3)Shoichi研究了467℃、489℃时水煤气变换中CO和H2分压随时间变化关系(如右图所示),催化剂为氧化铁,实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等.
467℃时p(H2)和p(CO)随时间变化关系的曲线分别是____、____.489 ℃时p(H2)和p(CO)随时间变化关系的曲线分别是____、____.



起始/mol 1 1 0 0
转化/molxxxx
平衡/mol 1-x1-xxx

(3)该题综合性较强,须同时从变化观念与平衡思想的三个角度考虑得出结论:
①定量转化:30~90 min的变化量b增0.34 kPa,c减0.34 kPa;a减0.28 kPa,d增0.28 kPa.可知,b、c为同一温度下两物质的变化曲线,a、d为另一温度下两物质的变化曲线.
②“博弈”意识:721℃下,CO的还原性强于H2,平衡时CO分压小于H2分压.且467℃、489℃均小于721℃,该反应为放热反应,温度降低平衡正向移动,CO的分压会更小,H2分压会更大.所以,A、B为H2的变化曲线;c、d为CO的变化曲线.
③勒夏特列原理:该反应为放热反应,温度降低平衡正向移动,467℃比489℃时H2的平衡分压大,CO的平衡分压小.所以,467℃时p(H2)和p(CO)随时间变化关系的曲线分别是b、c.489 ℃时p(H2)和p(CO)随时间变化关系的曲线分别是a、d.